参枝苓口服液对App/Ps1双转基因小鼠早期海马突触和髓鞘改变的影响
巩卓彦,黄帅阳,陈芳,盛宁,冯慧利,董云芳,任映,杨金铎,王蓬文
(北京中医药大学东直门医院中医内科学教育部和北京市重点实验室,北京 100700)
目前的研究广泛认为阿尔茨海默病(Alzheimer’s disease,AD)是一种皮质疾病,但AD发病中白质的超微结构改变如髓鞘和少突胶质细胞破坏会加速认知障碍[1]。AD患者体内磁共振成像研究证实了AD中白质受累的假设,发现了白质微观结构的改变。AD患者尸检发现白质总蛋白、髓鞘碱性蛋白、髓鞘蛋白脂蛋白,环核苷酸磷酸水解酶和胆固醇显著降低,这表明髓鞘的丢失。髓鞘完整性受损也会导致神经回路和认知功能的损害,髓鞘障碍引起的突触功能破坏,会进一步影响神经元回路,导致AD临床症状的出现[2]。电子显微镜在澄清髓鞘精细结构方面发挥了重要作用[3]。β-淀粉样蛋白(Amyloid-beta,Aβ)的聚集不仅会损伤改变髓鞘的完整性,也会影响成熟少突胶质细胞的组织结构[4]。因此,观察髓鞘和少突胶质细胞的病理结构在AD中的变化具有重要意义。
参枝苓口服液作为我国第一个获批用于轻、中度AD的中药复方,在改善AD早期症状发挥着重要作用[5]。研究证明,参枝苓口服液可以通过增强扣带回后部和大脑特定区域之间的互通性进而提高大脑功能,还能够通过改善AD模型小鼠细胞内Aβ的沉积和细胞外tau蛋白的高度磷酸化,从而提高其认知功能[6]。本研究通过观察AD动物模型App/Ps1双转基因小鼠海马CA1区髓鞘和突触超微结构和突触数量变化,探讨参枝苓口服液对AD模型小鼠早期神经保护作用。
1 材料与方法
1.1 材料
1.1.1 动物
3月龄SPF级雄性App/Ps1小鼠45只,以及同背景同月龄雄性C57BL/6J小鼠9只,体重在(20 ± 2)g,购自北京华阜康生物科技有限公司【SCXK(京)2014-0004】,由北京中医药大学东直门医院屏障环境动物室【SYXK(京)2015-0001】进行饲养,实验过程中动物单笼饲养、自由饮水和摄食。本实验获得北京中医药大学东直门医院实验动物伦理委员会批准(伦理号:15-26)。
1.1.2 试剂及仪器
盐酸多奈哌齐由卫材(中国)药业有限公司提供(批号140635);参枝苓口服液(由人参,远志,茯苓和石菖蒲共同组成)来自山东沃华药业(国药准字Z20120010);神经髓鞘固蓝染色法(luxol fast blue)髓鞘染色液试剂盒(货号G3240)由北京索莱宝科技有限公司提供;2.5%戊二醛溶液购自北京军区陆军总医院八一脑科医院电镜室;氯化钠、多聚甲醛、水合氯醛、二甲苯、无水乙醇(将100%乙醇和双蒸水配制成95%乙醇、80%乙醇和70%乙醇)来自北京化学试剂公司;JEM-2100F型透射电镜来自日本电子公司。
1.2 方法
1.2.1 分组与给药
将45只3月龄App/Ps1双转基因小鼠随机等分成5组:模型组、多奈哌齐组0.92 mg/(kg·d)、参枝苓高剂量组50 g/(kg·d)、参枝苓中剂量组25 g/(kg·d)和参枝苓低剂量组12.5 g/(kg·d),药物均溶于蒸馏水中进行灌胃。9只同窝同月龄C57BL/6J雄性小鼠为对照组。适应性喂养3 d。给予模型组和对照组等体积的蒸馏水进行灌胃。连续3个月,1次/日。
1.2.2 小鼠脑组织取材
实验灌胃结束后,将小鼠麻醉后固定于实验台,用手术剪充分暴露心脏和肝,灌注针插入心脏顶端并固定,同时从右心耳剪开一小口并注射0.9%氯化钠溶液至肝变白,继续推注4%多聚甲醛固定液以充分灌注直至小鼠全身僵硬停止。固定后随即断头剪开颅骨,暴露脑组织,置于冰上快速取出海马CA1区,储存于盛有2.5%戊二醛溶液的EP管内,4℃静置2 h充分固定后用PBS缓冲液冲洗3次。
1.2.3 透射电镜观察
对海马组织进行常规制备超薄切片,采用透射电镜在1500倍的视野下随机取5个视野计算突触数量并比较其平均值,在2000倍的视野下观察每组小鼠海马CA1区神经元和少突胶质细胞的超微结构,在4000倍数的视野下观察每组小鼠海马CA1区髓鞘的超微结构,分析其形态学变化。
1.2.4 Luxol fast blue髓鞘染色(伊红法)
将用4%多聚甲醛固定后的脑组织进行冠状面后部取材、脱水、透明、石蜡包埋。包埋结束后对每组海马组织进行连续冠状切片,片厚4 μm,然后对切片进行luxol fast blue髓鞘染色(伊红法)。
在60℃恒温烤箱中对制好的石蜡切片进行烤片,1 h后立即放入二甲苯Ι中脱蜡20 min,再依次放入二甲苯ΙΙ中20 min、100%乙醇3 min、95%乙醇3 min、80%乙醇5 min、70%乙醇5 min,最后在双蒸水中冲洗。将清洗好的切片放入95%乙醇蘸洗,随后将切片置于luxol fast blue髓鞘染色剂中,室温过夜后于第2天取出切片依次用95%乙醇、双蒸水冲洗残余染色液。将切片依次用luxol分化液分色15 s、70%乙醇分色30 s,用光学显微镜下观察灰白质直至清晰,放置于双蒸水中。用伊红染液将分化好的切片复染2 min,随后放入蒸馏水中进行冲洗,用光学显微镜观察。观察结束后依次用无水乙醇5 min、95%乙醇5 min脱水,先后放入二甲苯Ι和二甲苯ΙΙ中分别透明20 min、中性树胶封片。晾干后用光学显微镜观察脑髓鞘的分布形态。
1.3 统计学分析
2 结果
2.1 透射电镜观察小鼠海马CA1区突触数量的变化
电镜×1.5 k倍视野下观察神经毡中的突触数目,计算随机选择的5个神经毡视野中的突触数量并比较其平均值。与对照组相比,模型组小鼠海马CA1区突触数目显著减少(P< 0.01);各给药组突触数目均多于模型组(P< 0.01)。(图1)。

注:A. 神经毡(标尺=2.0 μm);B. 突触数量。图1 各组小鼠海马组织种的突触结构Note. A. Nerve felts (Bar=2.0 μm). B. Number of synapses.Figure 1 Ultrastructural images of synapses in the mouse hypocampus
2.2 透射电镜观察App/Ps1小鼠海马CA1区髓鞘等相关超微结构的形态学变化
电镜×4.0 k倍数下显示对照组髓鞘结构较为完整(图2a),模型组髓鞘结构发生显著破坏(图2b);与模型组相比,各药物组髓鞘结构均有不同程度改善(图2c-f)。电镜×2.0 k倍数下观察对照组少突胶质细胞结构基本完整、核膜较连续、核染色质分布较均匀(图3a);模型组的少突胶质细胞内核染色质固缩,呈凋亡前状态,(图3b);与模型组相比,各给药组的少突胶质细胞结构明显好转,核染色质分布均匀(图3c-f)。电镜×1.5 k倍数下显示对照组神经元结构完整,染色质均匀分布,核形态正常,胞质结构正常(图4a);模型组神经元呈凋亡早期改变,核染色质固缩,胞质内可见解聚的多聚核糖体、线粒体肿胀,部分线粒体出现嵴断裂现象,整个细胞发生退行性改变(图4b);与模型组比较,多奈哌齐组神经元结构基本正常,参枝苓各剂量组神经元结构均有改善,形态完整,核染色质分布较均匀,多聚核糖体和线粒体较丰富(图4c-f)。
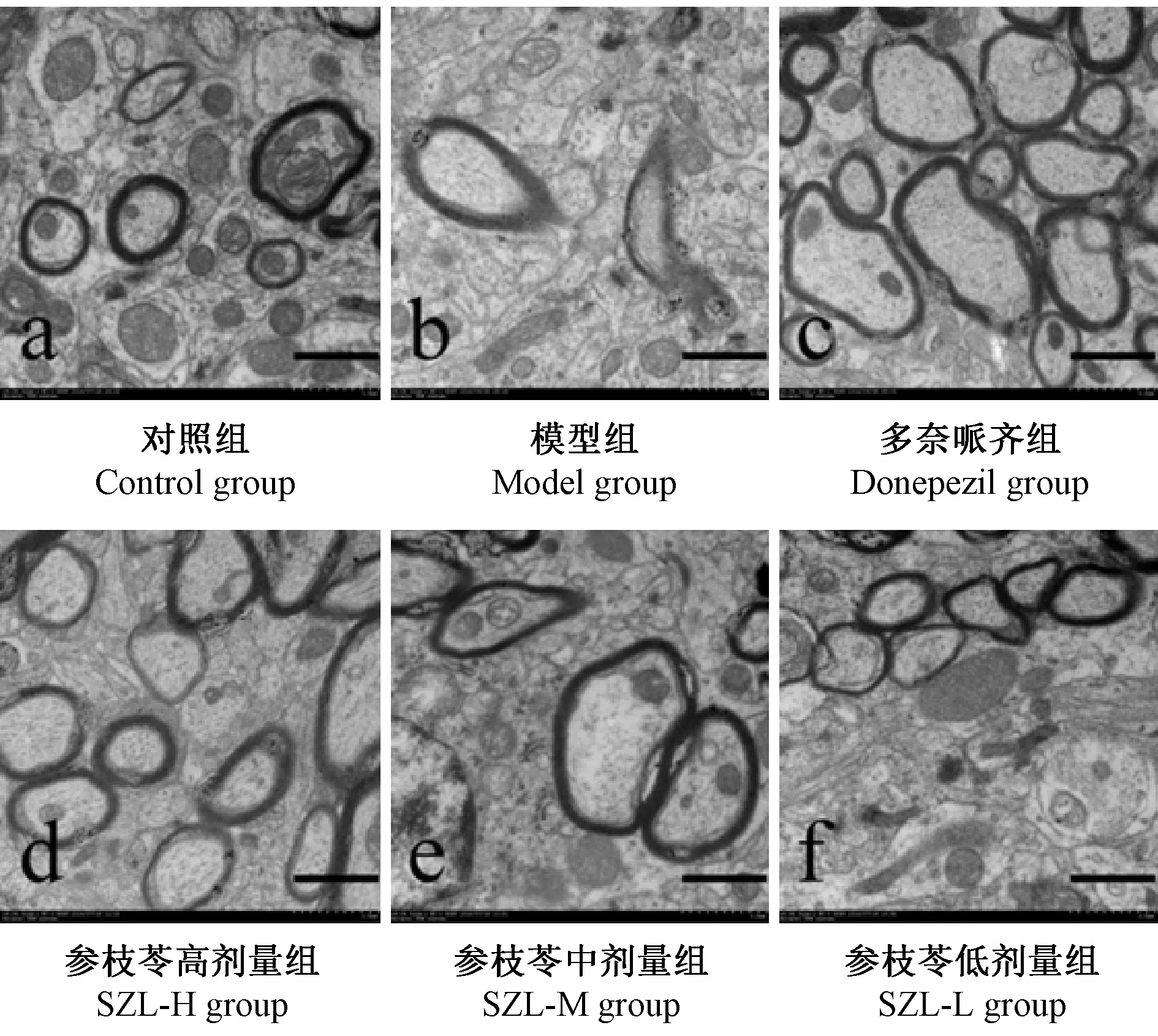
图2 各组小鼠髓鞘超微结构(标尺=1.0 μm)Figure 2 Ultrastructure of myelin sheath in each group (Bar=1.0 μm)
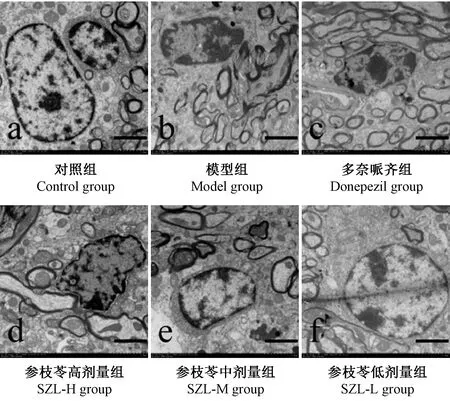
图3 各组小鼠少突胶质细胞超微结构(标尺=2.0 μm)Figure 3 Ultrastructure of oligodendrocytes in the mouse hippocampus CA1 area of each group (Bar=2.0 μm)
2.3 Luxol fast blue髓鞘染色(伊红法)观察小鼠海马髓鞘变化
髓鞘经luxol fast blue特殊染色后,白质纤维呈深蓝色,对照组髓鞘出现密集分布的深蓝色白质纤维(图5a,图6a);模型组白质纤维明显减少且染色变淡,显示髓鞘减少(图5b,图6b);较模型组,多奈哌齐组和参枝苓各剂量组小鼠脑内髓鞘白质纤维分布显著增加且染色变深(图5c-f,图6c-f)。
3 讨论

图4 各组小鼠神经元超微结构(标尺=2.0 μm)Figure 4 Ultrastructure of neurons in the mouse hippocampus CA1 area of each group (Bar=2.0 μm)
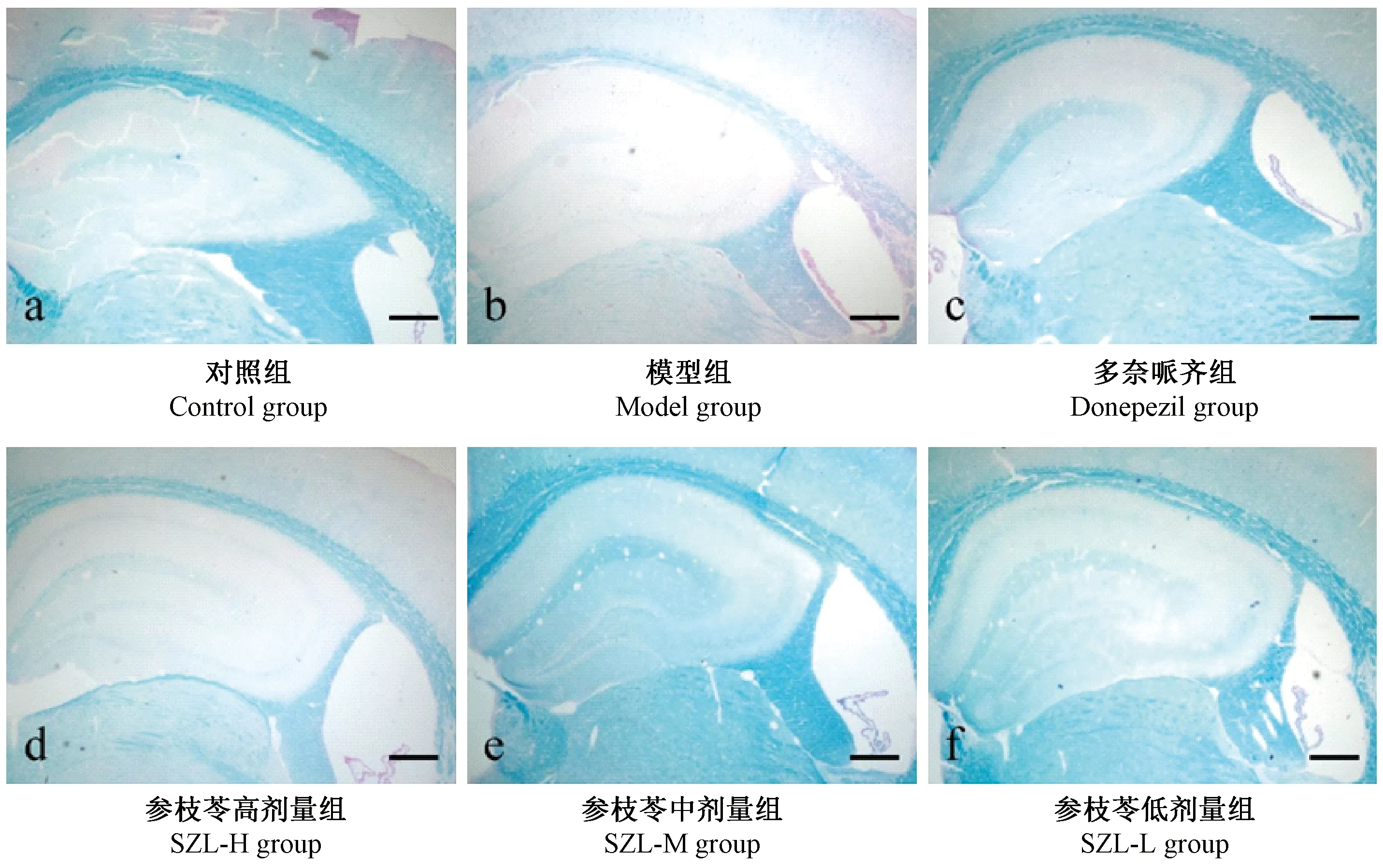
图5 各组小鼠Luxol fast blue髓鞘染色(标尺=500 μm)Figiure 5 Changes of myelin sheath in the mouse brain tissues of each group (Luxol fast blue staining. Bar=500 μm)
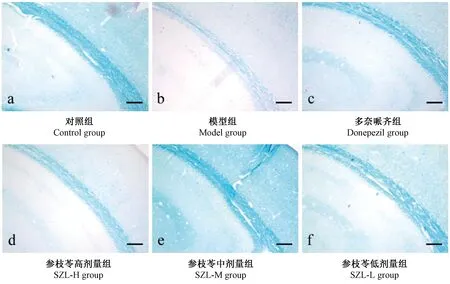
图6 各组小鼠Luxol fast blue髓鞘染色 (Bar=200 μm)Figiure 6 Changes of myelin sheath in the mouse brain tissues of each group (Luxol fast blue staining. Bar=200 μm)
研究发现先于轴突异常发生的髓鞘损伤与AD紧密相关。髓鞘破坏是指轴突周围髓鞘的损伤和丢失,并早于老年斑沉积和神经纤维缠结发生[7]。早在1964年就有研究人员利用电子显微镜首次发现在AD患者白质中存在广泛的脱髓鞘病变,发现髓鞘板层之间有空间较大且充满致密的颗粒状碎片和空泡[8],而目前的研究针对AD具体髓鞘变化知之甚少。研究显示,少突胶质细胞在AD进展期间表现出特定的形态学变化,通过原位缺口末端标记的方法发现Aβ通常会导致少突胶质细胞破裂和细胞体收缩[9]。各种观察结果表明,髓鞘和少突胶质细胞受损可能会加速认知障碍。但目前针对AD病理变化中髓鞘及少突胶质细胞超微结构变化鲜有报道。突触功能异常也会引发各种神经系统疾病[10],突触丢失和神经元破坏也是造成AD早期记忆损伤的重要原因[11]。课题组前期对App/Ps1小鼠突触的超微结构进行了研究,发现参枝苓口服液能改善突触结构[12],可能会进一步改变突触可塑性,从而增强其早期空间记忆能力和记忆保持能力[13]。
目前尚无有效方法能够治愈AD,西药针对AD的某一环节有阻断作用,中医药由于其整体观和辨证论治的特点及优势越来越受到研究者的青睐。参枝苓口服液以开心散为基础进行遣药组方,从心论治。方中党参补气安神,桂枝温经振阳,茯苓益气凝神,远志、石菖蒲、龙骨和牡蛎能够通窍安神,炙甘草和干姜健脾和中。针对AD本虚标实的病机本质,一则补益心气、振奋心阳,二则行气化痰开窍[14]。
本实验利用透射电镜研究参枝苓口服液对App/Ps1小鼠海马CA1区髓鞘、少突胶质细胞、突触和神经元超微结构的影响。结果显示,模型组App/Ps1小鼠海马CA1区髓鞘板层结构发生显著损坏、少突胶质细胞呈凋亡前状态、突触数目减少、神经元出现退行性改变;Luxol fast blue 染色显示髓鞘纤维明显减少,染色变浅。与模型组相比,参枝苓各剂量组App/Ps1小鼠海马CA1区髓鞘板层结构均明显好转、少突胶质细胞结构有所改善且染色分布均匀,突触数目增多,神经元结构呈现不同程度的改善;Luxol fast blue染色显示髓鞘纤维分布显著增加且染色加深。以上结果都表明,参枝苓口服液可能是通过改善小鼠海马CA1区髓鞘、少突胶质细胞和神经元的形态学变化,以及增加突触数目从而影响突触功能来发挥早期AD患者的神经保护作用。

