金黄色葡萄球菌感染小鼠乳房炎模型的建立及IL-2和IL-4的变化
吕琛,张全伟,王琪,张勇,,马友记,赵兴绪,*
(1. 甘肃农业大学动物医学院,兰州 730070; 2. 甘肃农业大学生命科学技术学院,兰州 730070;3. 甘肃农业大学动物科技学院 兰州 730070)
乳房炎是指动物乳腺组织受到病原微生物、理化因素等刺激所引起的一类炎症疾病[1]。细菌引起的乳房炎最为显著,其中金黄色葡萄球菌(Staphylococcusaureus,S.aureus)是引起乳房炎的主要病原菌之一[2]。细菌感染乳腺组织时被吸附到上皮细胞,导致乳腺局部组织处于异常的生理状态[3]。乳房炎致使动物产奶量和奶品质下降,治疗成本增加和淘汰率提高,对奶业造成严重的经济损失。治疗乳房炎的关键是抑制炎症及其继发性反应。早期,乳房炎的治疗方法主要通过药物(抗菌药和中草药等)抑制炎症的发生。但长期使用药物导致机体耐药性增加,药物治疗效果降低。此外,绿色食品和抗生素残留问题也越来越为人们关注。随着现代分子生物学的发展,乳房炎的“基因疗法”已成为解决该问题的有效途径之一。
研究表明,白介素家族(interleukin,IL)炎症因子与乳房炎发生有密切的联系[4]。IL是一类作用于免疫细胞间的淋巴因子,在炎症反应中起着关键的效用[5]。IL-2与淋巴细胞和单核细胞表面的IL-2受体结合,增强淋巴细胞的杀伤性[6]。IL-4是一种促进B细胞增殖的因子,对淋巴细胞具有免疫调节作用,能抑制单核巨噬细胞产生肿瘤坏死因子(tumor necrosis factor-α,TNF-α)和IL-1β[7]。研究报道小尾寒羊乳房炎模型的乳腺组织中Toll样受体-4(Toll-like receptor 4,TLR4)表达明显上调[8]。荷斯坦奶牛乳房部灌注脂多糖引起乳房炎,奶牛乳腺上皮细胞中炎症因子IL-6、IL-12和TNF-α mRNA表达量均上调[9]。虽然已有关于乳房炎模型的报道[10-11],但实验动物和引发乳房炎的细菌浓度及检测指标存在较大差异,未见构建乳房炎模型的统一标准。小鼠个体小,易繁殖,实惠,且小鼠第四对和第五对乳腺组织相当于哺乳动物的乳腺组织[10],以小鼠为模型具有较多优势。本研究采集甘肃金昌某养殖场奶牛乳房炎的乳样,经肉汤、革兰染色和生化鉴定等,分离纯化获得金黄色葡萄球菌。利用金黄色葡萄球菌悬液感染小鼠乳房,建立小鼠乳房炎模型。采用H&E染色法观察其病理变化,研究IL-2和IL-4在小鼠乳房炎发病过程中蛋白和mRNA转录水平的变化,探讨IL-2和IL-4在乳房炎发病过程中的作用,为哺乳动物乳房炎发病机制提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
3周龄清洁级BALB/C雄性小鼠12只,体重9.552 ~ 8.805 g,雌性小鼠12只,体重8.712 ~ 7.995 g。来源于中国兰州生物制品研究所【SCXK(甘)2017-0001】,饲养于中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室【SYXK(甘)2015-0003】,饲养温度19 ~ 25℃,标准饲料喂养,自由饮水。金黄色葡萄球菌来源于患乳房炎奶牛的乳样,由本实验室分离鉴定获得,并低温保存。
1.1.2 仪器和试剂
实时荧光定量PCR仪器(FTC-3000P,加拿大),凝胶成像系统(Bio-Rad,美国),电泳仪和电转槽(Bio-Rad,美国),免疫组化检测试剂盒(索莱宝,中国),Rabbit Anti-IL-2(博奥森,中国),Mouse Anti-IL-4(Santa,美国)。其他试剂均为国产分析纯。
1.2 方法
1.2.1 小鼠乳房炎模型的建立和指标检测
取金黄色葡萄球菌菌株10 μL接种于适量的营养培养基中[12],37℃培养箱过夜。采用等比稀释法(10×)稀释后,接种于营养琼脂培养基,涂抹平板计数法计算菌液浓度。根据文献报道[13],选取菌液浓度为1.2×105、1.2×104、6.0×103CFU/mL。
小鼠性成熟后,腹腔注射孕马血清促性腺激素(PMSG),同期发情处理后合笼繁殖。将12只泌乳期的母鼠随机分为4组:A组为对照组(乳部皮内注射生理盐水50 μL),模型组:B组(乳部皮内注射1.2×105CFU/mL菌液50 μL);C组(乳部皮内注射1.2×104CFU/mL菌液50 μL);D组(乳部皮内注射6.0×103CFU/mL菌液50 μL)。接种24 h后,无菌条件下采集小鼠血液进行白细胞数检测;采集小鼠乳腺组织,部分置于4%甲醛溶液固定,部分-80℃冷存备用。
1.2.2 H&E和免疫组织化学染色
将固定组织常规方法制作石蜡切片。经二甲苯脱蜡,梯度酒精脱水,苏木精染色,盐酸分化液分化,伊红染色,梯度酒精脱水,二甲苯透明,树胶封片。随机选5个视野,镜下组织病理学观察。
乳腺切片经65℃烤片,二甲苯脱蜡,梯度酒精水化,柠檬酸盐缓冲液抗原修复,H2O2室温孵育,封闭液(试剂A)封闭,IL-2(1/85)和IL-4(1/250)过夜孵育,二抗(试剂B)、试剂C室温孵育,DAB显色,苏木素复染,盐酸乙醇分化,梯度酒精、二甲苯脱水透明,树胶封片。镜下观察照相。每个组织取3张切片,每张切片随机选5个视野。Image-Pro Plus 6.0扫描其灰度值进行统计学分析。
1.2.3 实时荧光定量PCR
取1 mg小鼠乳腺组织,根据TransZol UP RNA操作说明,提取Total RNA。取3 μL Total RNA样品,经1.5%琼脂糖凝胶电泳检测其完整性后,测定Total RNA浓度。根据测定结果,将其浓度调至500 ng/μL。按RevertAid First Strand cDNA Synthesis Kit操作说明两步法合成cDNA,产物于-20℃保存备用。根据NCBI中小鼠IL-2(NM_008366.3),IL-4(NM_021283.2)和GAPDH(NM_001289726.1)的序列,使用Primer Premier 5.0设计特异性引物,由西安擎科泽西生物技术有限公司合成(表1)。
以cDNA为模板,qRT-PCR检测IL-2、IL-4和GAPDH mRNA的表达丰度。反应体系为20 μL:2×TranStart Tip Green qPCR SuperMix 10 μL,上游下游引物各1 μL,cDNA 1 μL,ddH2O 7 μL。扩增程序采用三步法:94℃ 30 s,94℃ 5 s,56℃ 15 s,72℃ 10 s;共45个循环。每个样品重复3次,反应结束后观察扩增曲线和溶解曲线,采集Ct值。采用2-△△Ct法进行数据处理[14]。

表1 引物序列信息Table 1 Information of the primer sequences
1.2.4 蛋白质免疫印迹
取100 mg乳腺组织彻底研磨后,加入1 mL RIPA裂解液,置于冰上裂解30 min,经12 000 r/min,4℃离心30 min,轻轻吸取上清液。Bradford G250法测定总蛋白浓度,定量后与蛋白缓冲液混合,煮沸变性,-20℃保存。取30 μg蛋白样品,经5% SDS-PAGE浓缩胶和12%分离胶电泳后,蛋白转移至聚偏氟乙烯膜(PVDF),5%脱脂奶粉室温封闭2 h,加入Rabbit Anti-IL-2(1/250)和Mouse Anti-IL-4(1/500)抗体,4℃孵育过夜,辣根过氧化物酶HRP标记的二抗(1/4000)37℃孵育2 h。ECL化学发光试剂进行显影,拍照。Image-Pro Plus 6.0软件扫描其灰度值。
1.3 统计学分析
2 结果
2.1 金黄色葡萄球菌感染小鼠的指标检测
感染金黄色葡萄球菌24 h后,模型组血液白细胞数和中性粒细胞数均显著高于对照组(P< 0.05),B组白细胞和中性粒细胞数明显高于C组和D组(P< 0.01)(表2)。白细胞和中性粒细胞数目增多,表明是由细菌引发的炎症反应。

表2 金黄色葡萄球菌感染小鼠时24 h白细胞数的变化Table 2 Changes of leukocyte counts in the mice infected with S.
注:A:对照组;B:模型组,菌液浓度为1.2×105CFU/mL;C:模型组,菌液浓度为1.2×104CFU/mL;D:模型组,菌液浓度为6.0×103CFU/mL。*P< 0.05,**P< 0.01。(下同)
Note. A. Control group. B, C and D. Model groups infected withS.aureusof 1.2×105CFU/mL, 1.2×104CFU/mL and 6.0×103CFU/mL, respectively.*P< 0.05,**P< 0.01. (The same below)

注:A1-D1:对照组和模型组乳房示意图;A2-D2:对照组和模型组乳房解剖示意图。A系列为未感染组;B系列为高剂量组;C系列为中剂量组;D系列为低剂量组(下同)。→:乳腺组织;☆:对照组和模型组乳房;★;充血部位;▲:脓液。图1 金黄色葡萄球菌感染小鼠的乳腺组织解剖结构观察Note. A1-D1. Gross appearance of the breasts of mice in the control and model groups. A2-D2. Anatomical changes of the mouse mammary glands in the control and model groups. A1, A2. Uninfected group. B1, B2. High dose group. C1, C2. Moderate dose group. D1, D2. Low dose group. (The same below). →: breast tissue; ☆: breast in the control and model groups; ★; hyperemia; ▲: pus.Figure 1 Observation of the anatomical structure of the mammary glands of mice infected with S. aureus
2.2 金黄色葡萄球菌感染小鼠的病理变化
不同浓度的菌液感染小鼠24 h后,模型组和对照组均无死亡,肉眼观测小鼠乳房外部无异常变化(图1)。模型组小鼠精神沉郁,采食和饮水均减少。临床诊断发现:A组小鼠乳头触感柔软,乳腺组织正常,乳汁为乳白色。B组小鼠乳头触感坚硬如沙粒状,乳腺组织及周围组织有大量充血,乳汁中有大量脓液。C组和D组小鼠乳头触感较硬,乳腺组织有充血点,乳汁中含少量脓液。结果表明感染浓度不同,组间存在明显差异。
2.3 金黄色葡萄球菌感染小鼠乳腺组织的变化
正常乳腺上皮细胞分为两层,肌上皮细胞和腺上皮细胞。A组肌上皮细胞和腺上皮细胞结构完整,轮廓清晰。B组乳腺上皮细胞(肌上皮细胞和腺上皮细胞)发生溶解,伴随着大量脂肪细胞浸润。C组乳腺上皮细胞萎缩,腔内有少量分泌物。D组乳腺上皮细胞之间排列松散,伴有脂肪细胞浸润现象(图2)。结果表明,成功建立了金黄色葡萄球菌感染的小鼠乳房炎模型,随着感染浓度的增加,炎症程度逐渐加剧。
2.4 金黄色葡萄球菌感染小鼠的乳腺组织中IL-2和IL-4蛋白分析
菌种感染小鼠24 h后,免疫组织化学染色显示,对照组和模型组小鼠乳腺组织中均有IL-2和IL-4阳性表达,呈棕色颗粒,主要定位于乳腺上皮细胞的细胞质中(图3)。IL-2和IL-4分布部位相同,但不同感染程度中存在差异。与A组相比,B组、C组和D组乳腺组织中IL-2和IL-4蛋白阳性反应明显增强。通过积分光密度分析发现(图4),D组IL-2表达量最高,表达趋势随着浓度降低而增高(P< 0.05);而B组IL-4的表达量最高,表达趋势随着浓度增加而增高(P< 0.05)。
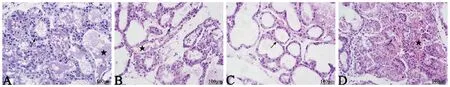
注:→:乳腺上皮细胞;★:乳腺分泌物;☆:脂肪细胞。图2 金黄色葡萄球菌感染小鼠的乳腺组织病理H&E染色观察(40×)Note. →: Glandular epithelial cells. ★: Mammary secretion. ☆: adipocytes.Figure 2 Pathological changes in the mouse breast tissues infected with S. aureus (H&E staining,40×)
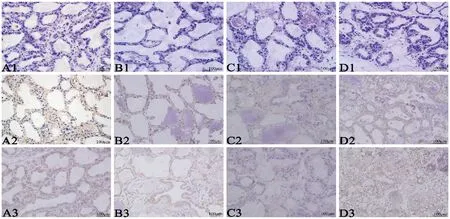
注:A1-D1:对照组和模型组小鼠乳腺组织的阴性对照;A2-D2:对照组和模型组小鼠乳腺组织中IL-2蛋白的表达变化;A3-D3:对照组和模型组小鼠乳腺组织中IL-4蛋白的表达变化。A系列为未感染组,B系列为高剂量组,C系列为中剂量组,D系列为低剂量组。图3 金黄色葡萄球菌感染小鼠的乳腺组织中IL-2和IL-4蛋白表达Note. A1-D1. Negative control of mammary gland tissues in the control and model groups. A2-D2. Expression of IL-2 protein in mammary gland tissues of the control and model groups. A3-D3. Expression of IL-4 protein in mammary gland tissues of the control and model groups. Series A. Uninfected group. Series B. High dose group. Series C. Moderate dose group. Series D. Low dose group.Figure 3 Expression of IL-2 and IL-4 proteins in the breast tissues of mice infected with S. aureus
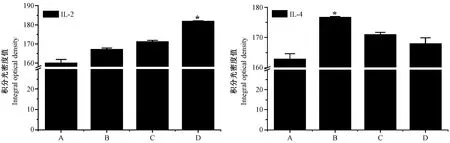
注:A:对照组;B:模型组,菌液浓度为1.2×105 CFU/mL;C:模型组,菌液浓度为1.2×104 CFU/mL;D:模型组,菌液浓度为6.0×103 CFU/mL。* P< 0.05。(下同)图4 金黄色葡萄球菌感染小鼠的乳腺组织中IL-2和IL-4蛋白阳性反应的积分光密度值Note. A. Control group. B, C and D. Model groups infected with S-aureus of 1.2×105 CFU/mL, 1.2×104 CFU/mL, and 6.0×103 CFU/mL, respectively. * P< 0.05. (The same below)Figure 4 Integral optical density values of IL-2 and IL-4 proteins in the mouse breast tissues
2.5 金黄色葡萄球菌感染小鼠的乳腺组织中IL-2和IL-4 mRNA变化
qRT-PCR检测感染小鼠乳腺组织IL-2和IL-4 mRNA表达丰度。对照组和模型组中均可见IL-2和IL-4 mRNA的表达(图5)。D组IL-2 mRNA的相对表达量最高(P< 0.05);B组IL-4 mRNA的相对表达量最高(P< 0.05),说明IL-2和IL-4 mRNA在乳房炎发生过程中存在差异性表达。

图5 金黄色葡萄球菌感染小鼠的乳腺组织中IL-2和IL-4 mRNA相对表达Figure 5 Relative expression level of IL-2 and IL-4 mRNA in the mouse breast tissues infected with S. aureus
2.6 金黄色葡萄球菌感染小鼠的乳腺组织中IL-2和IL-4蛋白的表达
Western blot检测感染小鼠乳腺组织中IL-2和IL-4蛋白的表达。结果显示,IL-2和IL-4蛋白在对照组和模型组中均有表达,但不同感染浓度存在显著差异(图6)。D组IL-2 蛋白表达量显著高于其他组(P< 0.05),B组和C组差异不明显;B组IL-4蛋白的表达量最高(P< 0.05),显著高于C组和D组。IL-2和IL-4蛋白和mRNA表达趋势基本一致。

图6 金黄色葡萄球菌感染小鼠的乳腺组织中IL-2和IL-4蛋白免疫印迹相对表达量Figure 6 The relative expression of IL-2 and IL-4 proteins in the mouse breast tissues (Western blot)
3 讨论
目前,乳房炎是奶业所面临的主要疾病之一,其中奶牛和奶山羊乳房炎最为显著。乳房炎危害大、治疗花费高,对奶业造成极大的经济损失,严重制约着奶业的发展。以家畜为模型研究乳房炎的发病机理,受多重因素如成本、管理及时效等限制。以小鼠为模型研究乳房炎,具有多种优势,可以更方便地研究乳房炎的发病机制。以此为借鉴,可为家畜乳房炎的研究提供主要的依据。
本研究从患病奶牛乳汁中分离获得致病性的金黄色葡萄球菌,利用其建立小鼠乳房炎模型。杨明锋等[13]构建的小鼠乳房炎模型中,三种注射量均能诱发小鼠乳腺组织生理和病理变化,且菌液浓度越高,引起小鼠乳房炎症越严重。与本实验小鼠模型结果相似,但HE染色与本实验各组的病理变化均不同,原因可能取决于诱发乳房炎细菌浓度的差异。吕英等[15]构建的奶山羊隐性乳房炎模型中,体细胞和细菌浓度呈显著正相关,结果发现细菌浓度可以正向诱导体细胞数的增加。与本研究小鼠乳房炎血常规结果类似,结果表明B组白细胞数均高于A组、C组和D组(P< 0.01)。实验结果说明本研究成功构建了金黄色葡萄球菌诱发的小鼠乳房炎模型,根据白细胞数和H&E染色这两个指标结合临床表现,确定每只小鼠注射1.2×105CFU/mL金黄色葡萄球菌菌液50 μL可以引起典型症状的乳房炎。
调节机体的免疫状态可以更有效防治乳房炎,免疫状态分为促炎和抗炎两方面[16]。辅助性T细胞1(T helper cells, Th1)分泌IL-2等促炎因子介导细胞免疫;Th2分泌IL-4等抗炎因子介导体液免疫。两者处于动态平衡,能维持机体正常的免疫功能,当失衡时则引起炎症反应[17]。罗小丽等[18]通过免疫组化发现,阳性表达主要在乳腺癌细胞和正常的乳腺组织上皮细胞中。本实验通过免疫组织化学发现,阳性表达也主要在正常和病理的乳腺上皮细胞中表达。同样,通过积分光密度值发现,以低浓度感染小鼠时,IL-2的表达水平达到最高,IL-4表达水平较低,可能起初炎症反应由抗炎因子激活,因此抗炎因子抑制炎症的发生;当高浓度感染时,表达水平发生逆转,此时由抗炎因子为主导。当促炎因子表达增加时,存在负反馈机制。为了拮抗体内促炎因子对组织器官的损害,抗炎因子水平也同时升高,维持促炎因子和抗炎因子之间的平衡,如果不能维持这种平衡,就会发生炎症扩散,这种平衡的机制还需进一步研究。
qRT-PCR和Western blot检测发现,随着感染浓度的增加,IL-2在乳腺组织的表达先升高后降低;而IL-4表达水平先下调后上调。实验结果与岳文杰等[19]检测结肠炎组织中IL-2和IL-4表达量与疾病活动度的结果趋势相似。Miller等[20]研究发现,慢性前列腺患者的促炎因子IL-8和抗炎因子IL-10的表达水平之间呈负相关,即IL-8表达水平的增高伴随着IL-10表达水平的降低,与本实验中IL-2表达水平和IL-4表达水平的结果趋势相一致。虽然识别受体能快速检测到金黄色葡萄球菌感染乳腺上皮细胞,但金黄色葡萄球菌不能激活核因子,不能有效地促进免疫应答,最终导致隐性乳房炎[21],这可能与乳腺炎症反应的强弱有关,也可能是本实验中感染24 h后IL-2和IL-4在不同浓度时表达水平不同的原因。在乳房炎发生过程中,促炎因子IL-2和抗炎因子IL-4相互约束,发挥着一定的作用,但其相关机制有待进一步探究,为今后哺乳动物乳房炎的发病机制提供科学的理论依据,为进一步研究提供可靠的技术支持。
4 结论
成功的建立了乳房炎模型,且不同浓度金黄色葡萄球菌感染小鼠乳腺组织时IL-2和IL-4的表达均不同,证实炎症因子IL-2和IL-4参与乳房炎的发生与发展。

