改性处理对猪肌原纤维蛋白结构及凝胶特性的影响
姜国川,王丽岩,刘亚春,孙洪蕊,张佳霖,刘学军,*,闫晓慧*
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.吉林省农业科学院农产品加工研究所,吉林 长春 130033;3.吉林省轻工业设计研究院,吉林 长春 130021;4.吉林工商学院财税学院,吉林 长春 130507)
肌原纤维蛋白是猪肌肉的重要组成部分,约占肌肉总蛋白含量的55%。肌原纤维蛋白的凝胶特性对肉及肉制品的质构特性以及品质特性有着重要的影响。蛋白质的凝胶特性及其他功能特性受蛋白质结构的影响,改善肌原纤维蛋白凝胶特性有助于提高肉制品的品质。
超声波处理对生物大分子的改性具有较好的作用,Li Ke等[1]研究了超声波改性对鸡胸肉凝胶性和持水性的影响,研究结果表明高功率的超声波技术可以降低鸡肉中盐的添加量,改善鸡肉的凝胶性能。Chang Haijun[2]、Latoch[3]等的研究结果表明超声波通过空化作用等相关机制引起肉组织的物理破坏并加速传质,使肌原纤维蛋白断裂,溶解度增加。Jayasooriya等[4]报道了高强度超声波可以改变蛋白质凝胶性,因为肌肉组织内的空化可导致自由基形成,进而发生化学变化,自由基可改变蛋白质的结构和分子间力。
谷氨酰胺转氨酶(glutamine transaminase,TG)是通过酰基转移反应催化蛋白质交联的转移酶。蛋白质中伯胺的氨基或赖氨酸残基的ε-氨基作为酰基受体,谷氨酰胺残基的γ-羧酰胺基为酰基供体,反应生成ε-(γ-谷氨酰胺)赖氨酸肽,提供交联蛋白或肽[5]。Chanarat等[6]利用微生物TG来增加鱼糜的凝胶强度,微生物TG作用于天然肌动蛋白,蛋白质的ε-氨基含量下降,交联蛋白含量增加,鱼糜的凝胶强度增加,研究结果表明TG对蛋白质的交联作用与鱼糜的凝胶强度呈现出一定的相关性。
目前,国内外对于将超声波处理与TG改性相结合来改善肌原纤维蛋白凝胶特性的研究少有报道。基于此,为提高肌原纤维蛋白凝胶性,本实验将肌原纤维蛋白进行改性处理。以凝胶的强度、硬度、弹性、持水性、化学作用力、白度等为评价指标,研究改性处理对肌原纤维蛋白凝胶特性的影响。以蛋白质二级结构、差示扫描量热法、紫外吸收光谱表征改性处理对肌原纤维蛋白结构的影响。以期扩大肌原纤维蛋白在肉制品加工中的应用范围,实现肌原纤维蛋白的综合利用。
1 材料与方法
1.1 材料与试剂
TG(酶活力46.8 U/g) 泰兴市东圣食品科技有限公司;磷酸二氢钠、磷酸氢二钠 天津市大茂化学试剂厂;牛血清白蛋白标准品 北京梦怡美生物科技有限公司;乙二胺四乙酸 天津市北晨方正试剂厂;除非另有说明,所有试剂均为分析级。
1.2 仪器与设备
IRTracer-10傅里叶变换红外光谱仪 日本岛津公司;Diamond TG/DTA差示扫描量热仪 美国PE公司;TMS-Pro物性仪 美国FTC公司;JY99-IIDN超声波破碎机 新芝生物科技公司;TU-1901紫外分光光度计 北京普析仪器有限公司;色差仪 美国HunterLab公司。
1.3 方法
1.3.1 猪肌原纤维蛋白的提取
参照Park等[7]的实验方法进行猪肌原纤维蛋白的提取。
1.3.2 猪肌原纤维蛋白的改性处理
配制肌原纤维蛋白溶液(40 mg/mL),分别进行以下改性处理。
超声波改性参数:超声时间30 min、功率400 W。
TG改性参数:TG添加量0.60%(质量分数,下同)、pH 6.0、温度45 ℃、反应时间2 h。
超声波-TG复合改性参数:超声时间30 min、功率400 W、温度45 ℃、pH 6.0、TG添加量0.60%、反应时间2 h。
1.3.3 凝胶样品制备
将肌原纤维蛋白质溶解在磷酸盐缓冲液(pH 6.5、50 mmol/L)中,调整蛋白质溶液的质量浓度至40 mg/mL。将蛋白质溶液升温至45 ℃,保温1 h。将蛋白质溶液进一步加热至85 ℃持续10 min,然后将样品冷却30 min,置于4 ℃环境下贮存[8]。
1.3.4 质构特性测定
凝胶强度测定参数设置:探头A/BE、穿刺距离5 mm、测前速率5 mm/s、测试速率1.0 mm/s、测后速率5.0 mm/s。
凝胶硬度、弹性测定参数设置:探头P/0.5、触发式自动、起始点感应力5.0 g、压缩比50%、测前速率5 mm/s、测试速率1.0 mm/s、测后速率5.0 mm/s,循环2 次。
1.3.5 巯基含量测定
参考Liu Qian等[9]的实验方法测定凝胶巯基含量。
1.3.6 持水性测定
参考Salvador等[8]的实验方法,并作适当修改。将凝胶样品离心处理(8 000 r/min、15 min),凝胶持水性按式(1)计算。

式中:m0为离心管质量/g;m1为未离心时凝胶与离心管质量/g;m2为离心结束后凝胶与离心管质量/g。
1.3.7 白度测定
参考Salvador等[8]的实验方法测定凝胶切面不同位置的色差a、b、L值,取各个点的平均值。凝胶白度按式(2)计算。
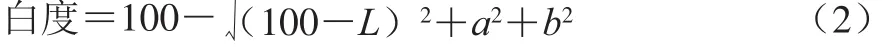
1.3.8 化学力测定
根据Gómez-Guillén等[10]的实验方法,并适当修改。
分别配制下述4 种溶液,a溶液:取蛋白质凝胶样品1.5 g与8 mL NaCl溶液(0.05 mol/L)混匀均质;b溶液:取蛋白质凝胶样品1.5 g与8 mL NaCl溶液(0.6 mol/L)混匀均质;c溶液:取蛋白质凝胶样品1.5 g与8 mL混合液(NaCl溶液(0.6 mol/L)+尿素溶液(1.5 mo1/L))混匀均质;d溶液:取蛋白质凝胶样品1.5 g与8 mL混合液(NaCl溶液(0.6 mol/L)+尿素溶液(8 mo1/L))混匀均质。
将以上4 种溶液置于4 ℃条件下静置60 min,离心处理(10 000 r/min、15 min)后测定上清液中蛋白质量浓度,其中疏水相互作用力为d溶液中蛋白质量浓度与c溶液中蛋白质量浓度的差值;离子键作用力为b溶液中蛋白质量浓度与a溶液中蛋白质量浓度的差值;氢键作用力为c溶液中蛋白质量浓度与b溶液中蛋白质量浓度差。
1.3.9 差示扫描量热分析
参考Xia Xiufang等[11]实验方法,并稍加改动。将样品溶解在pH 6.5的磷酸盐缓冲液中(0.6 mo1/L NaCl、50 mmol/L Na2HPO4/NaH2PO4),控制蛋白质量浓度为40 mg/mL。用注射器吸取适量样品溶解液于铝盒中,以空的铝盒压片作为空白对照。设置扫描速率参数为10 ℃/min,温度扫描范围为30~120 ℃。
1.3.10 二级结构分析
参考李顺等[12]的实验方法对肌原纤维蛋白进行傅里叶变换红外光谱扫描以及二级结构预测。
1.3.11 紫外吸收光谱分析
参考Lange等[13]的实验方法对样品进行紫外吸收光谱扫描。
1.4 数据统计与分析
利用Excel、Origin 8.5.1、Statistic软件对实验数据进行处理,采用Tukey’s Honestly Significant Difference(HSD)进行显著性分析,实验重复3 次,取平均值。
2 结果与分析
2.1 改性处理对猪肌原纤维蛋白凝胶特性的影响
2.1.1 改性处理对猪肌原纤维蛋白凝胶强度、硬度和弹性的影响
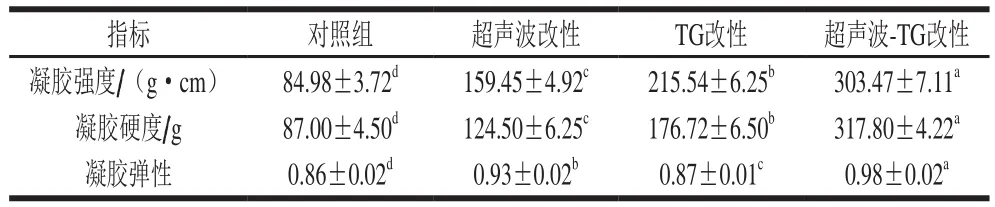
表1 改性处理对猪肌原纤维蛋白凝胶质构特性的影响Table 1 Effect of modification on texture properties of porcine myofibrillar protein gel
凝胶硬度、强度、弹性是评价凝胶质构特性的重要指标。如表1所示,改性处理均可改善肌原纤维蛋白凝胶的强度、硬度和弹性,其中对凝胶强度和硬度的改善效果由强到弱的顺序为:超声波-TG复合改性>TG改性>超声波改性;对凝胶弹性的改善效果由强到弱为:超声波-TG复合改性>超声波改性>TG改性。结合以上实验数据,超声波-TG复合改性效果最优,其凝胶强度、硬度、弹性分别是未经改性处理对照组的3.57、3.65、1.15 倍。韩敏义[14]的研究结果表明,TG能够催化酰基发生转移反应,产生ε-(γ-谷氨酰胺)赖氨酸键交联,形成高分子聚合物,增强了凝胶的网络结构。而超声波可促使肌原纤维蛋白暴露部分疏水基团,并促使蛋白质结构由天然的卷曲状态解折叠[15],增加了TG与蛋白质的结合位点,使得TG能够更好地改变蛋白质的凝胶特性。
2.1.2 改性处理对猪肌原纤维蛋白凝胶巯基含量和持水性的影响
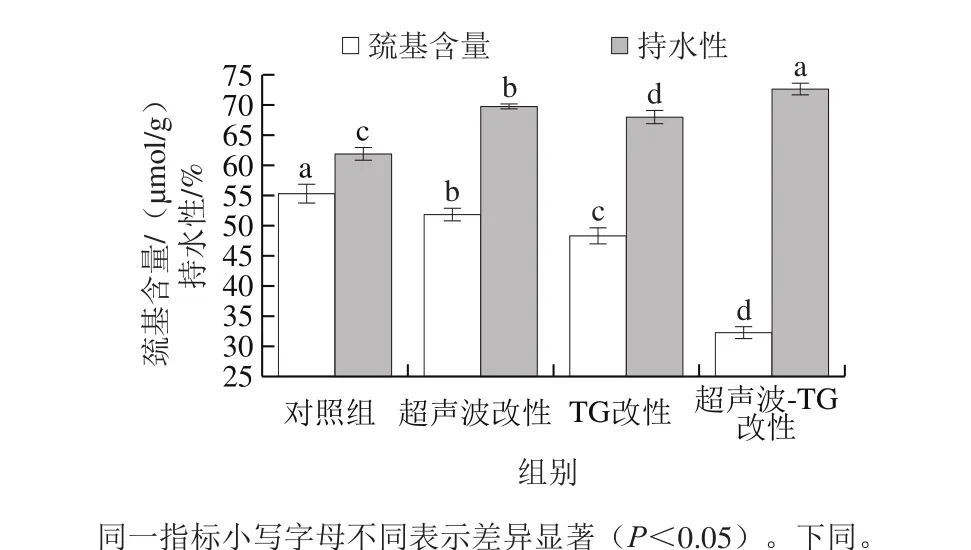
图1 改性处理对猪肌原纤维蛋白凝胶巯基含量、持水性的影响Fig. 1 Effect of modification on sulfhydryl content and water-holding capacity of porcine myofibrillar protein gel
在肌原纤维蛋白凝胶形成过程中,巯基基团发生氧化反应生成二硫键,其是凝胶网络形成过程中的重要作用力[16]。测定改性处理后猪肌原纤维蛋白凝胶巯基含量的变化可以表征二硫键含量的变化[17]。如图1所示,改性处理均能使肌原纤维蛋白凝胶的巯基含量降低,其中超声波-TG复合改性处理后的蛋白质凝胶巯基含量最低,说明改性处理能促使凝胶形成过程中巯基基团转变为二硫键,增强凝胶的强度。Zhang Ziye等[18]的研究结果表明,超声波处理可促使水分子解离成活性自由基,进而生成过氧化氢,过氧化氢作用于肌原纤维蛋白中的巯基,将其氧化成二硫键,使巯基含量减少。
如图1所示,超声波-TG复合改性处理组凝胶持水性最高。超声波可以破环蛋白质的刚性结构,促使TG更好地发生交联反应,形成均匀、紧密的凝胶网络结构,从而增强了对水分的包容束缚能力、限制了水分子的移动,进而增强了凝胶的持水性。Ionescu[19]、Motoki[20]等的研究结果表明,TG可以强化肌原纤维蛋白的凝胶网络结构或通过改变肌原纤维蛋白结合水的能力提高凝胶的持水性。常海霞[21]的研究结果表明,经超声波处理后,草鱼肌原纤维蛋白凝胶的持水性、质构特性等明显优于未经改性处理的肌原纤维蛋白凝胶。以上研究结果与本实验结果相似,进一步证实了实验数据的准确性。
2.1.3 改性处理对猪肌原纤维蛋白凝胶白度的影响
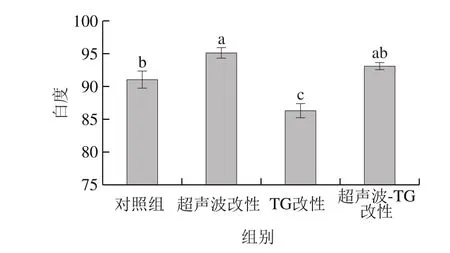
图2 改性处理对猪肌原纤维蛋白凝胶白度值的影响Fig. 2 Effect of modification on whiteness of porcine myofibrillar protein gel
如图2所示,改性处理对肌原纤维蛋白凝胶白度的影响较显著,其中超声波改性与超声波-TG复合改性对肌原纤维蛋白凝胶的颜色有正面的影响,表现为白度高于对照组,分别为95.24、93.35,超声波改性效果最佳。利用超声波对肌原纤维蛋白进行改性处理,超声波的机械作用以及空化效应会使蛋白质分子粒径变小,使网络结构变得均匀而紧密,提高凝胶的持水性,进而提高凝胶的亮度L值。Chen Hongsheng等[22]的研究结果表明,蛋白质凝胶的亮度与白度密切相关,超声波改性处理可以通过提高凝胶的亮度值来影响白度的变化。TG改性对肌原纤维蛋白凝胶的颜色有负面的影响,表现为白度低于对照组,原因可能是由于TG本身颜色呈黄褐色,降低了肌原纤维蛋白凝胶的白度。
2.1.4 改性处理对猪肌原纤维蛋白凝胶化学作用力的影响
肌原纤维蛋白经热诱导形成凝胶的过程中,疏水作用、离子键、氢键等作用力参与其中,蛋白质结构发生变化,这些变化对蛋白质凝胶特性产生一定的影响[23]。本实验比较了改性处理对猪肌原纤维蛋白凝胶化学力的影响。如图3所示,改性处理均对蛋白质凝胶的化学力有较显著的影响,表现为疏水相互作用蛋白质量浓度升高,氢键以及离子键蛋白质量浓度降低。其中,肌原纤维蛋白凝胶中疏水相互作用的蛋白质量浓度由高到低的顺序为:超声波-TG复合改性组>TG改性组>超声波改性组>对照组,超声波-TG复合改性组凝胶中疏水相互作用的蛋白质量浓度约是未经改性对照组的2 倍。原因可能是改性处理破环了肌原纤维蛋白原有的有序状态,促使蛋白质的疏水性残基暴露,从而导致疏水相互作用增强。超声波-TG复合改性组提高凝胶疏水相互作用最明显,可能是超声波处理与TG交联反应发生协同作用,使得蛋白质结构更稳定。
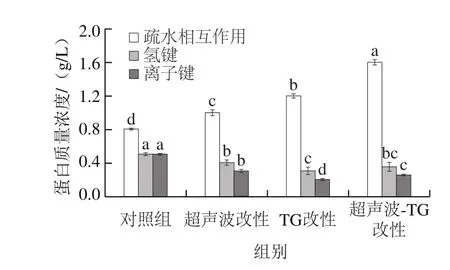
图3 改性处理对猪肌原纤维蛋白凝胶化学力的影响Fig. 3 Effect of modification on chemical forces of porcine myofibrillar protein gel
综合肌原纤维蛋白凝胶质构特性(凝胶强度、硬度、弹性)、持水性以及凝胶作用力等指标可以发现,影响肌原纤维蛋白凝胶网络结构以及其他特性的主要作用力为疏水相互作用。Westphalen等[24]的研究结果与本实验相似,即蛋白分子间的疏水相互作用对凝胶三维网状结构的形成以及稳定性起主要作用。
2.2 改性处理对猪肌原纤维蛋白结构特性的影响
2.2.1 差示扫描量热分析
差示扫描量热分析技术常被用来测定蛋白质变性过程中能量的变化[25],其作用原理是蛋白质在控温系统的作用下,从有序结构变为无序结构的过程。通过比较样品蛋白质与参照样品之间的热量差,分析蛋白质的变性温度。当达到蛋白质变性温度时,图谱上会呈现出一个吸收峰,此时的温度即为蛋白质变性温度。蛋白质变性温度越高,其结构越稳定。

表2 改性猪肌原纤维蛋白的变性温度Table 2 Denaturation temperature of modified porcine myofibrillar protein
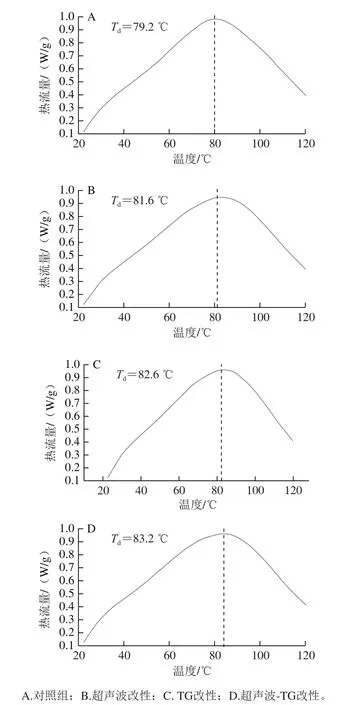
图4 改性猪肌原纤维蛋白的差示扫描量热分析Fig. 4 Differential scanning calorimetry analysis of modified porcine myofibrillar protein
如表2、图4所示,经过超声波改性、TG改性、超声波-TG复合改性后肌原纤维蛋白的热变性温度(Td)分别为81.6、82.6、83.2 ℃,均高于对照肌原纤维蛋白的变性温度(79.2 ℃),说明3 种改性处理均能提高肌原纤维蛋白的稳定性,其中超声波-TG复合改性后肌原纤维蛋白热变性温度最高,蛋白质结构最稳定。超声波改性可以促进TG发生蛋白质内或蛋白质间的交联反应,生成大分子聚合物,而这种大分子聚合物是有序的结构,热稳定性较无序结构高[26]。
2.2.2 改性处理对猪肌原纤维蛋白二级结构的影响

图5 改性猪肌原纤维蛋白的傅里叶变换红外光谱图Fig. 5 Fourier transform infrared spectrum of modified porcine myofibrillar protein
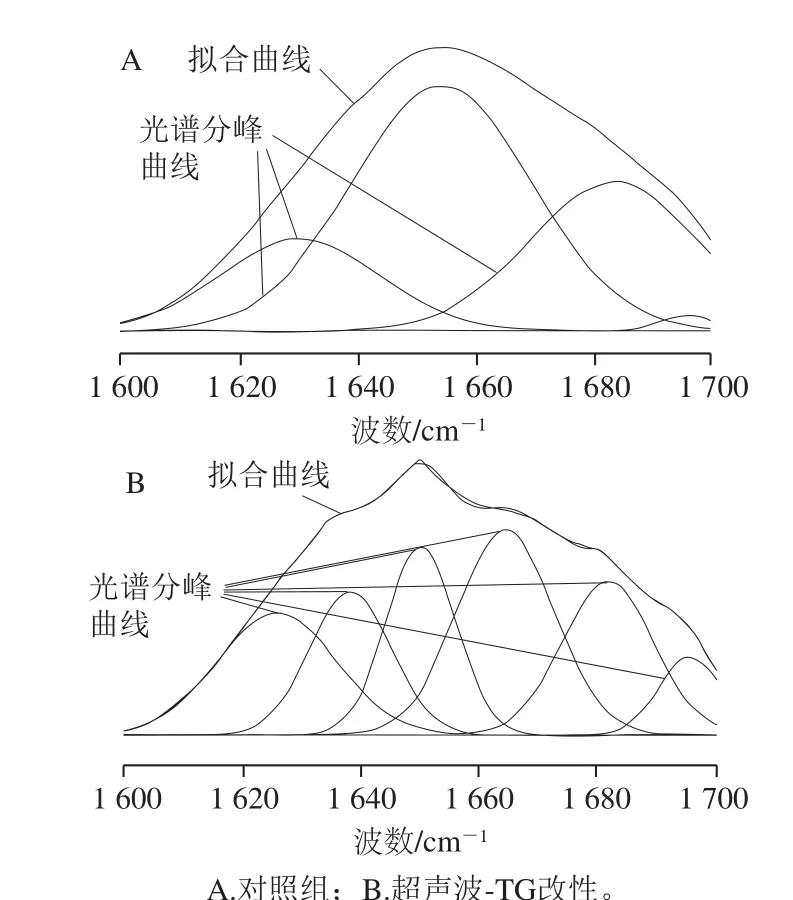
图6 酰胺I带高斯拟合图Fig. 6 Gauss fitting of amide I
图5 为对照与超声波-TG复合改性后的肌原纤维蛋白的傅里叶变换红外光谱图,在傅里叶变换红外图谱中截取酰胺I带(波数为1 600~1 700 cm-1)进行蛋白质的二级结构预测,高斯拟合结果如图6所示。其中对照组R2为0.999 83,拟合子峰数为4;超声波-TG复合改性组R2为0.999 25,拟合子峰数为6。对照组与实验组的酰胺I带拟合结果如表3所示。
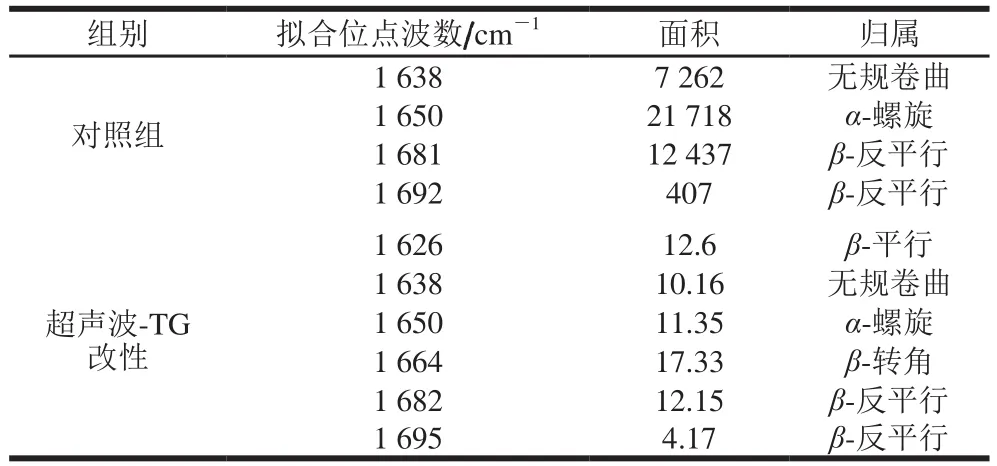
表3 酰胺I带的拟合结果Table 3 Fitting results of amide I bands
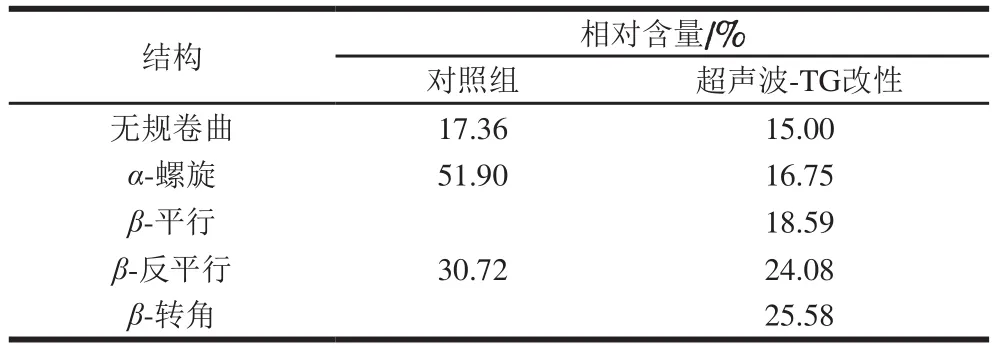
表4 猪肌原纤维蛋白改性前后二级结构相对含量Table 4 Relative percentages of secondary structures in modified porcine myofibrillar protein
综合以上数据,得到对照组蛋白质二级结构相对含量为:α-螺旋51.90%、β-反平行30.72%、无规卷曲17.36%;超声波-TG复合改性组蛋白质二级结构相对含量分别为:α-螺旋16.75%、β-转角25.58%、β-平行18.59%、β-反平行24.08%、无规卷曲15.00%(表4)。改性处理对肌原纤维蛋白二级结构有显著影响,超声波-TG复合改性后蛋白质二级结构α-螺旋相对含量下降,β-折叠、β-转角相对含量升高,无规卷曲相对含量变化不明显。超声波处理使部分蛋白质长链发生断裂,肌原纤维蛋白的刚性结构减弱,柔性增强,二级结构发生一定的改变。超声波处理后增加了底物与TG的作用位点,催化蛋白质发生交联作用,生成大分子聚合物,增强蛋白质凝胶网络的稳定性,同时蛋白质二级结构发生改变,表现为β-折叠、β-转角相对含量升高。曹莹莹[27]、Choi[28]等的研究结果表明,当蛋白质二级结构中β-折叠相对含量较高时,其蛋白质的凝胶性以及持水性较高;当蛋白质二级结构中α-螺旋相对含量较高时,其蛋白质的凝胶性以及持水性较低。Li Ke等[29]的研究结果表明,利用超声波技术对蛋白质进行改性,可促使蛋白质二级结构α-螺旋相对含量降低、β-折叠与β-转角相对含量升高,同时亦证实超声波改性有利于增强蛋白质的凝胶强度以及持水性等。Liu Ru[30]、李鹏[31]等研究蛋白质的结构对猪肉、鸡肉、鱼肉凝胶特性的影响,结果发现β-折叠相对含量的升高有益于蛋白质凝胶性的提高。以上研究结果与本实验研究结果相似,说明超声波-TG改性可促使肌原纤维蛋白二级结构的改变,使α-螺旋构象向β-折叠、β-转角构象转变,二级结构的改变有利于提高肌原纤维蛋白的凝胶性。
2.2.3 紫外吸收光谱分析
蛋白质分子中含有一些生色基团,包括酪氨酸残基、色氨酸残基等,这些生色基团能够吸收紫外区域某一波长的光,因此产生相对应的紫外吸收光谱[32]。紫外吸收光谱通常用来研究蛋白质三级结构的变化[9]。如图7所示,对照组蛋白的紫外吸收峰分别位于215、282 nm波长处附近,改性对肌原纤维蛋白的紫外吸光度影响较明显,即对肌原纤维蛋白三级结构影响较大,表现为紫外吸光度较未经改性的对照组蛋白高。由图7可知,超声波-TG复合改性后的肌原纤维蛋白的紫外吸光度增加最明显,原因可能是超声波改性与TG交联改性的协同作用导致蛋白质致密的刚性结构被破坏,使埋藏在疏水区域内的生色基团暴露在溶剂中,生色基团所处环境由原来的非极性变为极性,从而使体系中的紫外吸光度上升。

图7 改性处理对猪肌原纤维蛋白紫外吸收光谱的影响Fig. 7 Effect of modification on ultraviolet absorption spectrum of porcine myofibrillar protein
3 结 论
改性处理对肌原纤维蛋白凝胶特性影响的研究结果表明,超声波-TG复合改性效果最显著,与对照组蛋白相比,其凝胶的巯基含量降低、持水性增加、白度增加、疏水相互作用力增强,凝胶强度、硬度、弹性增加。
改性处理对肌原纤维蛋白结构的影响结果表明,超声波-TG复合改性对蛋白质结构影响最显著。经差示扫描量热分析,改性后蛋白质热变性温度(83.2 ℃)升高;对蛋白质二级结构进行预测,得到改性后的蛋白质与对照组蛋白质相比,其α-螺旋构象向β-折叠、β-转角构象转变;紫外吸收光谱分析结果表明,改性后的肌原纤维蛋白的紫外吸光度增加,说明改性使得肌原纤维蛋白的三级结构发生了改变。
超声波-TG复合改性能够使肌原纤维蛋白结构向有利于提高肌原纤维蛋白凝胶特性方向改变,进而改善肌原纤维蛋白的凝胶特性。研究结果为实现肌原纤维蛋白的综合利用提供了理论依据。

