HEK 293细胞中重组型抗体表达和分泌的监测系统的构建
何曾安,柳艺石,张慧杰,高晓冬,藤田盛久
(江南大学 生物工程学院,江苏 无锡 214122)
生物药物(biopharmaceuticals)是一类在生物体或生物组织中综合利用生物化学、生物技术、微生物学、化学和药学等多学科原理和方法制造出的,用于预防、治疗或诊断的药物。与传统的小分子药物相比,以单克隆抗体为代表的生物药物具有较高的亲和性和特异性,可高效识别靶点分子,且副作用极低。重组治疗性蛋白质正日益成为重要的医疗药剂,用以治疗癌症及自身免疫性疾病等顽固性病症[1]。截止2010年,包括生物抗体药物在内的重组蛋白质已获得了1 000亿美元的市场销售额[2]。
免疫球蛋白G(IgG)是重要的重组治疗性生物药物,目前已被广泛地应用于多种疾病的治疗和诊断,如传染病、免疫缺陷病及自身免疫性疾病等[3-4]。IgG由2条γ重链和2条轻链通过二硫键共价连接形成四聚体蛋白质,每个轻链和重链的N端均含有针对同一抗原的抗原结合域。在IgG的Fc结构域上有一个高度保守的N-糖基化位点[5]。目前生物抗体药物主要由经过基因工程改造可大规模培养的宿主细胞表达生产,这些工程细胞株主要有中国仓鼠卵巢细胞(Chinese Hamster Ovary,CHO)、幼年叙利亚地鼠肾细胞 (Baby Hamster Syrian Kidney、BHK),小鼠骨髓瘤细胞株 Sp2/0和 NSO等[6]。
如何在尽可能降低生产成本、提高产量的同时仍保持工艺的稳定性和产品的一致性,依旧是抗体工业生产研发的方向。目前虽已有研究通过改善培养技术和优化基因扩增系统显著提高了CHO细胞中抗体的产量[7-8],但工业生产中所用的CHO细胞株的抗体表达水平仍远低于人体自身浆细胞。因此,在优化产品、提升产量方面,哺乳动物细胞株仍有较大改造潜力,其中针对分泌途径进行基因工程改造以提高抗体分泌量的需求尤为迫切。
为了克服哺乳动物细胞株生产中产量较低的现状,充分理解目的蛋白质的折叠、转运及分泌途径中所须的相关因子就显得尤为重要。本研究中,作者采用HEK 293细胞即人体胚胎肾细胞构建了一个可检测抗体转运分泌的监测系统。HEK 293细胞是由人肾胚细胞改造而成的永生化细胞株[9],由于其具有较高的生长速率和较好的蛋白质分泌活性,已被广泛地应用于蛋白质工业生产[10]。本研究中采用人源抗鸡蛋清溶菌酶抗体 (anti-Hen egg white lysozyme antibody,HyHEL10) 作 为 模 式 抗 体 。HyHEL10是一种晶体结构已知的单克隆抗体,以鸡蛋清溶菌酶(hen egg white lysozyme,HEL)为抗原,且与抗原的识别机制也已十分清楚[11-12]。为了便于监测抗体在细胞内部的累积以及向胞外分泌的情况,本研究中构建的重组型抗体在重链N端融合有增强型绿色荧光蛋白单体 (monomeric enhanced green fluorescent protein,mEGFP)和 FLAG 标签,分别用蛋白质合成抑制剂和蛋白质运输抑制剂处理细胞后,细胞中代表抗体水平的EGFP绿色荧光信号强度发生改变。本研究所构建的抗体表达系统可用于抗体分泌及折叠相关因子的筛选。
1 材料与方法
1.1 细胞培养
人体胚胎肾细胞HEK 293和HEK 293T细胞株:均使用含有10%胎牛血清(FCS)的DMEM培养基(Gibco,Life technologies,USA)培养,培养条件为37 ℃、5%CO2。
1.2 重组型抗体表达载体的构建
以pME18s-HyHEL10-human-sIgG为模板,用上游引物CCCAAGCTTGAGGTGCAGCTTCAGGAG TCA和下游引物AAAAGCGGCCGCTCATTTACCCG GAGACAGGG(下划线处分别为HindIII和NotI酶切位点)PCR扩增抗体重链(HyHEL10-sIgG1)。以限制性内切酶处理并纯化PCR扩增片段,用连接酶(Ligation Mix,Takara,JP)连接入载体 pMENeo2dH-mEGFP-FCD59_CD59ss[13]的HindIII和NotI位点,构建出pME-NeodH-ssEGFP-FHyHEL10中间质粒。
在pME-NeodH-ssEGFP-F-HyHEL10质粒上用EcoRI和XhoI限制性内切酶切出抗体的重链可变区(VH),同时用NotI和XhoI限制性内切酶切出抗体的重链恒定区(CH)。之后用连接酶(Ligation Mix,Takara,JP)将两个片段同时连接入 pLIB2-pgkHyg逆转录病毒表达载体的NotI和EcoRI酶切位点,从而构建出pLIB2-pgkHyg-ssEGFP-FHyHEL10-sIgG1抗体重链表达载体。此载体可表达含有由人源hCD59信号肽引导的绿色荧光蛋白(EGFP),以及 FLAG 标签。
以pME18s-HyHEL10-human-kappa为模板,用上游引物AAAAGAATTCATGGATCCCAAAGGAT CCC和下游引物AAAAGCGGCCGCTAACACTCTC CCC(下划线分别为EcoRI和NotI酶切位点)扩增抗体的轻链(HyHEL10-human-kappa),并将纯化后的PCR扩增片段连接入pLIB2-pgkBSD逆转录病毒表达载体的NotI和EcoRI酶切位点,由此构建出pLIB2-pgkBSD-HyHEL10-human-kappa抗体轻链表达载体。
1.3 HEK 293细胞株稳定转染
在6孔板上接种HEK 293T细胞,按照Lipofectamine2000 (Invitrogen,USA) 的说明书,将pGP、pVSV-G与重组质粒pLIB2-pgkHyg-ssEGFPF-HyHEL10-sIgG1或pLIB2-pgkBSD-HyHEL10-human-kappa 按照 1∶1∶2(m∶m∶m)转染到 HEK 293T细胞,用以表达分别含有重组抗体重链(ssEGFP-FHyHEL10-sIgG1)或抗体轻链 (HyHEL10-humankappa)的逆转录病毒。病毒表达24 h后,将含有表达轻链病毒的培养基上清液与重链病毒培养基上清液以 1∶1(V∶V)混合,转染入 6 孔板中的 HEK 293细胞。转染时预先加入1 000×溴化己二甲铵(SIGMA,USA)以增加病毒转染效率。病毒转染24 h后用杀稻瘟菌素(blasticidin,InvivoGen,USA)和潮霉素(hygromycin,InvivoGen,USA)共同筛选 1 w。 用流式细胞分选仪S3e(Bio-Rad,USA)分选富集具有中等抗体表达量的阳性细胞,并用有限稀释法(limiting dilution cloning,LDC)分离单克隆细胞株,由此获得HEK 293 E-F-HyHEL10稳定表达细胞株。
1.4 流式细胞分析
用胰酶(Sangon,CN)消化处理并收集细胞,用磷酸盐缓冲液(phosphate buffered saline,PBS,Sangon,CN)洗涤并重悬 (细胞终浓度为5×105个/mL)。采用 BD Accuri C6(BD,USA)流式细胞分析仪分析代表重组抗体水平的EGFP绿色荧光蛋白信号。
1.5 蛋白质印记法
将细胞接种于6孔板,以无血清培养基培养48 h后收集培养基上清液,同时收集并裂解细胞提取胞内蛋白质。分别用还原态和非还原态的4×上样缓冲液稀释并煮沸样品。用10%SDS-PAGE进行蛋白质凝胶电泳。转膜和封闭结束后,依次使用5%脱脂牛奶稀释8 000倍的一抗 (AffiniPure Rabbit Anti-Human IgG(H+L),Jackson,USA)和二抗(Goat Anti-Rabbit IgG(H+L),HRP-Conjugated,Transgen,CN)孵育PVDF膜。最后用ECL显色试剂 (Bio-Rad,USA)显色并观察结果,从而检测 E-FHyHEL10抗体表达情况。
鸡蛋清溶菌酶 (hen egg white lysozyme,HEL,SIGMA,USA)用5×上样缓冲液稀释,95℃煮沸 5 min,在15 g/dL SDS-PAGE中进行蛋白质凝胶电泳。将HEK 293 E-F-HyHEL10细胞接种于6 cm板,用无血清培养基培养48 h,收集培养基上清液5 mL,作为一抗加入转有HEL作为抗原的PVDF膜室温孵育。并使用5%脱脂牛奶稀释8 000倍的二抗(Peroxidase AffniPure Goat Anti-Human IgG(H+L),Jackson,USA)室温孵育。最后以ECL显色试剂(Bio-Rad,USA)显色并观察结果,用以检测E-FHyHEL10抗体功能。
1.6 重组型抗体的纯化
在10块15 cm培养皿中培养HEK 293 E-FHyHEL10细胞,用含10%血清的培养基培养48 h后收集培养液,再用含1%血清的培养基培养72 h并收集培养液。 用 anti-DDDDK-tag Gel(MBL,JP)沉淀培养基中的E-F-HyHEL10重组抗体,之后用洗脱蛋白质 (DDDDK-tagged Protein,MBL,JP)洗脱。收集洗脱液并加入透析盒 (Slide-A-LyzerTMG2 Dialysis Cassettes,20K MWCO、3 mL,Thermo Scientific,USA)以去除多余的洗脱蛋白质。用BCA蛋白质浓度测定试剂盒 (Beyotime Biotechnology,CN)测定纯化获得的E-F-HyHEL10抗体标准样品质量浓度。
1.7 银染
将纯化的E-F-HyHEL10标准样品用10 g/dL SDS-PAGE进行蛋白质凝胶电泳,使用快速银染试剂盒(Beyotime Biotechnology,CN)显色,并分析显色结果。
1.8 酶联免疫吸附测定(ELISA)
用鸡蛋清溶菌酶 (HEL,SIGMA,USA)作为抗原,在 96 孔免疫板(Thermo Scientific Nunc,USA)中铺板。封闭液(PBS,10%FCS)室温封闭后,加入一抗孵育。一抗实验组采用HEK 293 E-F-HyHEL10细胞的无血清培养基上清液。一抗对照组用纯化的E-F-HyHEL10标准品并稀释至12个质量浓度梯度 :0、3.91、7.81、15.63、31.25、62.5、125、250、500、1 000、2 000、4 000 ng/mL。之后加入封闭液稀释2 000倍的二抗 (Peroxidase AffniPure Goat Anti-Human IgG(H+L),Jackson,USA) 孵育。 最后以 1×TMB 溶液(eBioscience,USA) 显色, 并用终止液 (1 mol/L H2SO4)结束显色。 用酶标仪(Bio-Rad,USA)在 450 nm下检测样品吸光度。按照对照组标准品质量浓度与吸光度的关系制作标准曲线,以此曲线函数计算出其它实验组样品的抗体质量浓度。
1.9 蛋白质合成抑制剂与分泌抑制剂的处理
在12孔板中接种HEK 293 E-F-HyHEL10细胞,培养24 h后更换为含有蛋白质合成抑制剂或运输抑制剂的无血清培养基处理细胞。蛋白质分泌抑制剂选用1.25 μg/mL布雷菲德菌素A(brefeldin A,BioLegend,USA)[14],蛋白质合成抑制剂选用 100 μg/mL放线菌酮(cycloheximide,Cell Signaling Technology,USA)[15],分别处理不同时间。药物处理结束后收集细胞,用 BD Accuri C6(BD,USA)流式细胞分析仪分析胞内抗体累积量。以BFA处理为例,对抗体胞内累积水平进行量化分析,用如下公式计算:

公式中采用相应样品的EGFP绿色荧光信号强度值进行计算,定义HEK 293细胞样品的信号值为“亲本细胞组”,未经BFA处理的HEK 293 E-FHyHEL10细胞样品信号值被定义为“BFA对照组”。依照抗体累积倍数与处理时间关系作图,同时取培养基上清液进行ELISA,分析胞外抗体分泌量。
2 结果与分析
2.1 重组型抗体表达载体的验证
为了构建一个可用于监测抗体分泌和累积情况的稳定表达细胞株,作者首先设计构建了2个逆转录病毒重组表达载体(图1(a)),共同表达重组型抗体EGFP-FLAG-HyHEL10。选取的模式抗体HyHEL10,即抗蛋清溶菌酶抗体(anti-Hen egg white lysozyme antibody),是一种表征良好的抗体,具有人源IgG1亚型。其中重组抗体重链的N端融合有一个人源CD59的内质网定位信号肽(hCD59ss),一个增强型绿色荧光蛋白单体 (mEGFP),以及一个FLAG标签(图1(b))。在分泌运输过程中,抗体的C端通常参与识别运载受体。因此,为保持C端恒定域的原有功能,作者将内质网定位信号肽引导的mEGFP和FLAG标签均融合在抗体重链的N端。共同转染表达HyHEL10轻链和重链的载体时,细胞可表达成熟的分泌型抗体。
核酸凝胶电泳结果显示,双酶切验证重组抗体表达载体pLIB2-pgkHyg-ssEGFP-F-HyHEL10-sIgG1和pLIB2-pgkBSD-HyHEL10-human-kappa均得到两个片段,其中重组抗体重链 (ssEGFP-FHyHEL10-sIgG1)大小为 2 094 bp,抗体轻链(HyHEL10-human-kappa)为 723 bp(图 1(c)),且测序结果与模板序列完全匹配。
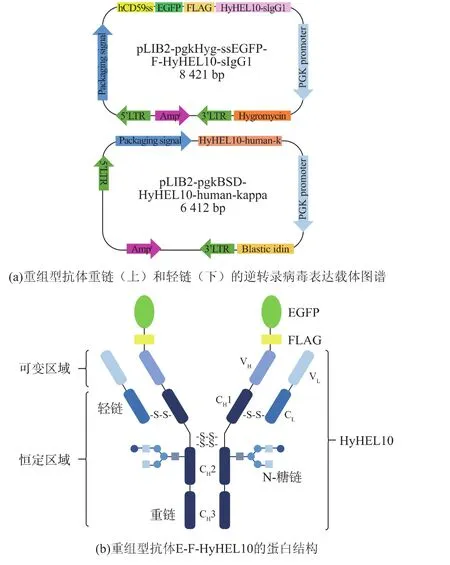
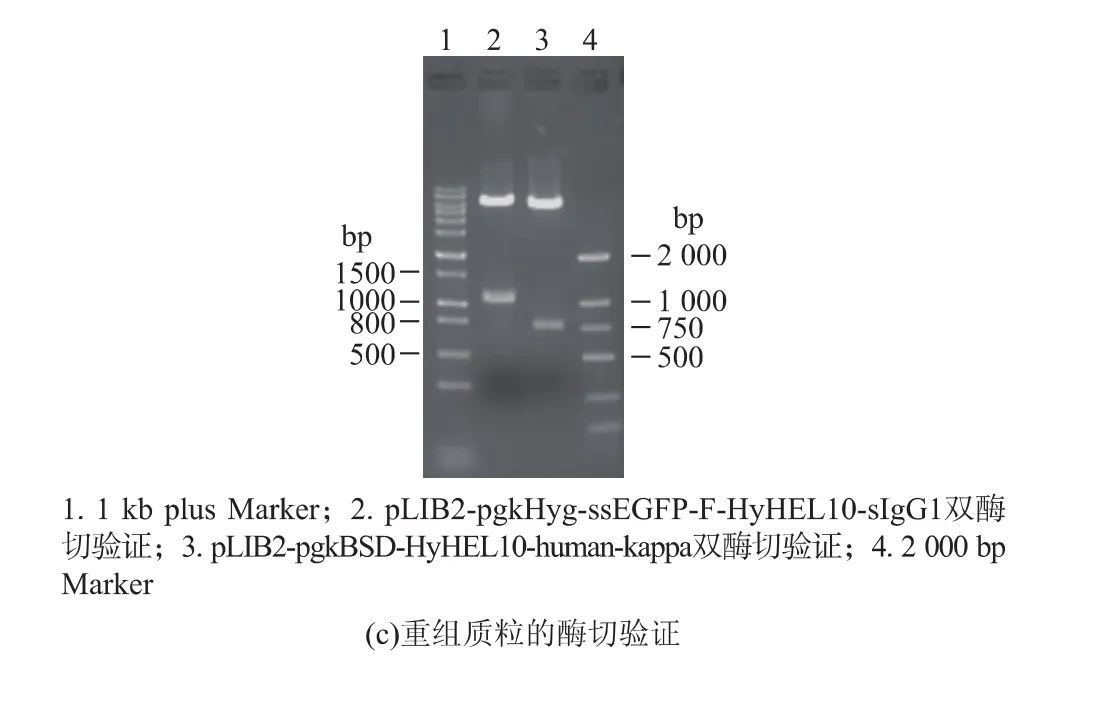
图1 重组型抗体表达载体的构建Fig.1 Construction of vectors for recombinant immunoglobulin expression
2.2 HEK 293 E-F-HyHEL10稳定表达细胞株的构建
用HEK 293T细胞分别表达的含有抗体重链和轻链的逆转录病毒转染HEK 293细胞,从而构建稳定表达EGFP-FLAG-HyHEL10的HEK 293细胞株。用流式细胞术分析每株单克隆细胞株的抗体表达量,依据EGFP荧光信号的强度,最终选取具有中等抗体表达水平的4号细胞株进行后续实验 (图2(a))。核酸凝胶电泳结果显示,PCR扩增4号细胞株基因组可得到正确大小的抗体重链和轻链DNA片段(图2(b)),证明抗体重链和轻链的表达基因已正确整合入受体细胞基因组。
作者进一步采用蛋白质印记法验证HEK 293 E-F-HyHEL10 No.4细胞株的胞内裂解样品及培养基上清液样品中抗体的表达情况。由于还原条件下抗体重链、轻链间的二硫键被打断,Western印记分析结果可以检测到还原态下约75 000的重组抗体重链(ssEGFP-F-HyHEL10-sIgG1),以及约 27 000的抗体轻链(HyHEL10-human-kappa)。同时也可检测到非还原态下200 000左右的重组抗体全长 (图2(c))。蛋白质印迹法在胞内裂解样品及培养基上清液样品中均可检测到正确大小的重组抗体,说明HEK 293 E-F-HyHEL10 No.4细胞株可以正确表达并分泌重组抗体。此外,作者推测细胞裂解样品中被检测出的其他条带应该是未完全折叠且滞留在内质网(ER)中的抗体重链,只有正确折叠聚合的抗体才可被分泌至培养基中。

图2 构建HEK 293 E-F-HyHEL10稳定表达细胞株Fig.2 Establishment of HEK 293 cells expressing an EGFP-fused antibody
2.3 EGFP融合型抗体功能的检测
由于表达的重组型抗体重链的N端融合有EGFP绿色荧光蛋白和FLAG标签,且成熟的抗体N端是识别相应抗原的抗原结合域,故对表达的重组型抗体是否能够依旧维持其生物功能进行了确认。实验中使用鸡蛋清溶菌酶 (HEL)作为E-FHyHEL10重组抗体的抗原。蛋白质印记结果显示出14 000的 HEL(图 3(a)),说明重组型抗体可以识别相应的抗原,抗体N端融合的两个标签并不影响抗体功能的发挥。
为了进一步验证重组型抗体的功能性,作者从低血清培养基上清液中纯化出E-F-HyHEL10标准样品(图3(b))。用纯化后稀释至不同浓度的E-FHyHEL10孵育经HEL铺板的免疫96孔板,并进行酶联免疫吸附测定,依据样品显色后的吸光度值与抗体加样量拟合绘制曲线。ELISA结果显示,随着抗体加样浓度的提高样品吸光度值也相应提高,由此表明E-F-HyHEL10与HEL的结合量与抗体本身的加样量有关(图3(c))。此结果进一步证明EGFP融合型抗体仍具有良好的功能活性。

图3 重组型抗体的功能验证Fig.3 EGFP-fused antibody is functional
2.4 蛋白质分泌运输抑制剂对重组抗体表达和分泌的影响
布雷菲德菌素A(BFA)可通过抑制外壳蛋白复合体 I(coat protein complex I,COPI)的形成间接抑制蛋白质从内质网(endoplasmic reticulum,ER)到高尔基体的分泌运输[16]。为了监测抗体的分泌情况,作者使用布雷菲德菌素A作为蛋白质分泌运输抑制剂,依照1.9中的试验方法处理HEK 293 E-FHyHEL10细胞。流式细胞分析结果表明,BFA处理后胞内抗体累积量有明显提升(图4(a))。进一步对抗体胞内累积水平进行量化分析,如图4(b)所示,BFA处理36 h后抗体的胞内累积量达到最大值,是对照组的1.6倍。取培养基上清液进行酶联免疫吸附测定重组抗体的胞外分泌量,结果显示BFA作为有效的蛋白质分泌抑制剂对抗体分泌至胞外有显著的抑制作用,因为几乎无法在培养液上清样品中检测到分泌的重组抗体(图4(c))。此结果与流式细胞分析结果相吻合。

图4 布雷菲德菌素A(BFA)对抗体表达细胞株的处理Fig.4 Treatment of brefeldin A (BFA)on HEK 293 EF-HyHEL10 cells
2.5 蛋白质合成抑制剂对重组抗体表达和分泌的影响
使用放线菌酮 (CHX)处理HEK 293 E-FHyHEL10细胞,流式细胞分析结果显示,CHX处理后的细胞中抗体累积量明显降低(图5(a))。使用1.9中的定量计算公式同样对CHX处理样品进行量化分析,在CHX处理12 h后抗体的胞内累积量急剧下降至对照组的0.7倍,并在后续处理的35 h内逐渐维持在0.5倍的水平(图5(b))。ELISA结果显示,无法在CHX处理的培养液上清液样品中检测到分泌的重组抗体(图5(c))。这两个结果共同证明,放线菌酮作为蛋白合成抑制剂抑制了抗体的合成,使得抗体无法在胞内合成并累积,更无重组抗体分泌到胞外。

图5 放线菌酮(CHX)对抗体表达细胞株的处理Fig.5 Treatment of cycloheximide (CHX)on HEK 293 E-F-HyHEL10 cells
3 结 语
截至目前,与细胞株基因工程改造的相关研究主要关注在以下方面:通过改造启动子或引入基因扩增系统以提高基因转录水平;通过优化表达原件以改善蛋白质翻译水平从而提高产量等[17-18]。尽管针对蛋白质折叠和运输的基因工程改造是优化的主要内容,但相应的机理研究工作仍是各项工业优化的基础。哺乳动物细胞中,抗体首先在内质网中合成,经过正确的蛋白质糖基化和折叠后被运送到高尔基体。抗体上的糖链会在高尔基体中被进一步修饰改造,并被分拣入反式高尔基网而最终分泌至培养基中。针对这一抗体分泌运输途径开展研究的最大阻碍是缺乏可以灵活检测抗体分泌运输的表达细胞株。
作者构建了可稳定表达E-F-HyHEL10重组型抗体的HEK 293细胞表达系统,这一表达系统可被成功地用于灵活检测抗体表达及分泌水平。该系统具有良好的抗体表达量及分泌量,同时稳定维持了抗体的功能活性。研究结果表明,布雷菲德菌素A和放线菌酮处理细胞,对抗体的胞内累积和胞外分泌途径均有积极影响,说明本抗体表达系统可灵敏地响应蛋白质分泌抑制剂和蛋白质合成抑制剂的扰动,进而证明本研究中构建的抗体表达系统具有灵活表征胞内胞外抗体分泌及表达情况的特性,可实现抗体表达、累积和分泌水平的准确监测。
本研究构建的可监测抗体分泌的稳定表达细胞株,未来可用于筛选鉴定与抗体分泌相关的因子。比如通过用化学药物对细胞的处理鉴定出可作用于抗体分泌的化学药物。新一代基因编辑技术CRISPR/Cas9,是现今十分高效的基因编辑工具[19],已有研究运用CRISPR/Cas9基因敲除文库进行基因组筛选[20]。本研究构建的重组抗体监控系统中亦可引入CRISPR/Cas9基因敲除文库,用于筛选与抗体折叠、分泌相关的基因。此外,可将研究中构建的逆转录病毒重组表达载体系统引入HAP1人源单倍体细胞株[21],构建重组抗体单倍体细胞表达系统,并利用HAP1细胞的单倍体基因组优势进行正向遗传学筛选。作者已先期构建了用于筛选抗体分泌相关因子的HAP1 E-F-HyHEL10稳定表达细胞株 (未发表)。用这一可监控细胞株筛选获得关键性因子后,未来可将这些因子应用于改造重组型抗体表达细胞株以提高生物药品的产量。

