基于高压结合酶法制备的低敏虾制品体内体外致敏性检测的差异性分析
王丽娟,胡志和,王星璇,李志清,罗梦娟,潘子檬,杨钰娟,刘力凤,刘 莉
(1.天津商业大学生物技术与食品科学学院,天津 300134;2.天津市食品生物技术重点实验室,天津 300134)
食物过敏是一种由食物引起的超敏反应。报道显示,成年人发生过敏反应者约3%~4%,儿童则高达6%[1]。另一项研究显示,2 岁以下婴幼儿的食物过敏发生率由1999年的3.5%增加到2009年的7.7%,呈明显上升趋势[2]。在主要引起过敏的8 种(类)食物中[3],水产品(鱼以及虾蟹在内的甲壳类)占有重要一席。海虾既是人们喜爱的食物之一,也是引起食物过敏的常见食物之一。食物过敏对人体的危害很大,可伤及机体各个系统和器官[4],甚至发生过敏性休克而危及生命。因此,研究开发低敏或脱敏的虾制品,在满足人们食欲与营养的同时,可减少过敏的风险。目前,降解虾过敏原的方法有多种,如酶解法、超高压法等。为保证开发食品的安全性,对其过敏原的检测必不可少。本实验采用高压结合酶法降解凡纳滨对虾的虾蛋白、虾仁泥(虾肉)和虾仁的过敏原,采用豚鼠过敏性休克模型和致敏离体回肠攻击实验检测上述低敏虾制品的致敏性,采用间接酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法检测上述制品的过敏原水平,比较和分析动物模型实验和体外检测的差异性,明确动物实验在过敏原检测中的不可替代性。
1 材料与方法
1.1 材料、动物与试剂
凡纳滨对虾(鲜) 天津市韩家墅水产市场。
英国种Hartly豚鼠(毛色为白色),雌雄各半,体质量为220~240 g,由北京华阜康生物科技股份有限公司提供,许可证号:SCXK(京)2014-0004。
胰蛋白酶、二硫苏糖醇(dithiothreitol,DTT)、吐温-20、牛血清白蛋白(bovine serum albumin,BSA)、辣根过氧化物酶(horseradish peroxidase,HRP)标记的兔抗豚鼠IgG抗体(-80 ℃保存)美国Sigma公司;福林-酚 国药集团化学试剂有限公司;丙酮(分析纯) 天津市凯通化学试剂有限公司;邻苯二胺(o-phenylenediamine,OPD,分析纯)天津市科密欧化学试剂有限公司;海虾过敏豚鼠血清(自制,-80 ℃保存)。其他试剂均为分析纯。
1.2 仪器与设备
HPPL2-800/2.5型超高压设备 华泰森淼生物工程技术有限公司;JJ-2型组织捣碎匀浆机 常州国华电器有限公司;Scientz-50N冷冻干燥机 宁波新芝生物科技股份有限公司;SpectraMax 190型酶标分析仪 深圳市山特科技有限公司;UV-2100紫外分光光度计 尤尼克仪器有限公司;BL-420F生物信号采集系统 成都泰盟科技有限公司。
1.3 方法
1.3.1 高压结合酶法制备凡纳滨对虾低敏虾蛋白
将新鲜凡纳滨对虾去头、尾、壳、肠线及筋膜后匀浆,将其与生理盐水1∶1(g/mL,下同)混匀,预冷5 min后加入4 倍体积的丙酮(-20 ℃预冷过夜),充分混匀后于4 ℃、4 000 r/min离心10 min,将沉淀物与4 倍体积冷丙酮混匀,4 ℃、4 000 r/min离心10 min,重复操作直至上清液澄清,将沉淀物移至干净滤纸上,分散自然风干,制成丙酮粉。将丙酮粉与KCl溶液(1 mol/L,含DTT 5 mmol/L)按1∶15(g/mL)混匀并抽提过夜。再次离心后收集上清液,沉淀物与KCl溶液混合继续抽提4 h,4 ℃、4 000 r/min离心30 min,合并上清液得到虾蛋白液,透析过夜后再冻干得到虾蛋白,-80 ℃冰箱保存备用[5]。
采用高压结合胰蛋白酶处理虾蛋白,采用福林-酚法[6]测试酶活力,找出保持胰蛋白酶活力的最佳压力与保压时间。在保持酶活性的高压条件下,先探索高压结合酶法处理虾蛋白过敏原消减效果最好的底物质量分数,再按已确定的最佳虾蛋白浓度,找出虾蛋白过敏原消减效果最好的酶加入量。
1.3.2 高压结合酶法制备低敏虾仁(虾肉)制品
将新鲜凡纳滨对虾去除头、尾、壳以及肠线、薄膜制成虾仁,将虾仁捣成肉泥即虾肉。将虾仁(虾肉)与生理盐水按不同比例混匀,加酶量为3 000 U/g(占底物质量计)。之后与1.3.1节的步骤一致,逐步制成虾仁(虾肉)丙酮粉、虾仁(虾肉)蛋白液、虾仁(虾肉)蛋白,于-80 ℃冰箱保存备用。用ELISA法检测虾仁(虾肉)蛋白过敏原的消减效果,确定虾仁(虾肉)蛋白致敏性消减的最佳底物质量分数。再按已确定的最佳底物质量分数将虾仁(虾肉)与生理盐水混匀,每个样品加酶量不同,同样工艺逐步制成虾仁(虾肉)丙酮粉、虾仁(虾肉)蛋白液、虾仁(虾肉)蛋白,将其置于-80 ℃冰箱保存备用。用ELISA法检测虾仁(虾肉)蛋白过敏原的消减效果,确定虾仁(虾肉)蛋白致敏性消减的最佳加酶量。
1.3.3 ELISA法检测高压结合酶法制备的低敏虾制品过敏原的消减效果
根据1.3.1节和1.3.2节选定的最佳条件高压结合酶处理虾蛋白、虾肉和虾仁,各平行实验3 次,将各产品平行实验产物混匀,用ELISA法测定其过敏原,通过OD492nm值评价低敏制品过敏原的消减效果。
按间接ELISA法操作步骤进行[7]。包被抗原的工作质量浓度50 μg/mL,酶标抗抗体(二抗)为兔抗豚鼠IgGHRP,底物选择OPD。反应终止后立即用酶标仪测定,在492 nm波长处测定各致敏豚鼠血清(1∶1 600稀释)的OD值,每个样品平行测定3 次,取平均值。
1.3.4 动物实验检测高压结合酶法制备的低敏虾制品过敏原的消减效果
1.3.4.1 豚鼠全身过敏性反应检测低敏虾制品的致敏性
豚鼠在实验室适应1 周后,选出30 只健康合格的豚鼠按体质量分层随机分为5 组,每组6 只,雌雄各半。分组后进行初次致敏、致敏及观察期满进行激发。各组豚鼠的致敏方法与激发方法[8]见表1。
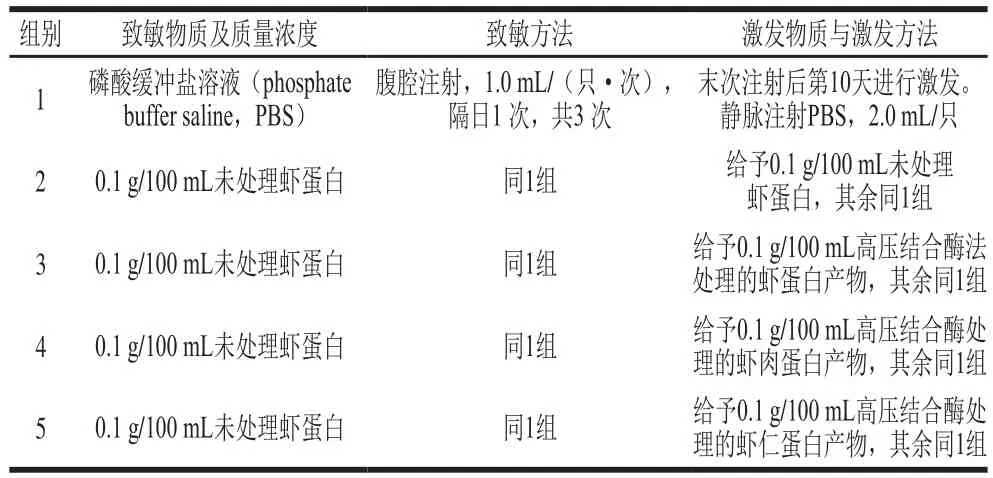
表1 豚鼠全身过敏反应致敏与激发方法Table 1 Sensitization and stimulation of systemic anaphylaxis in guinea pig
激发时采取静脉注射,如果不能一次注射成功,该例舍弃。激发后立即观察并记录1 h内豚鼠的反应,按表2观察、评价豚鼠的过敏程度。
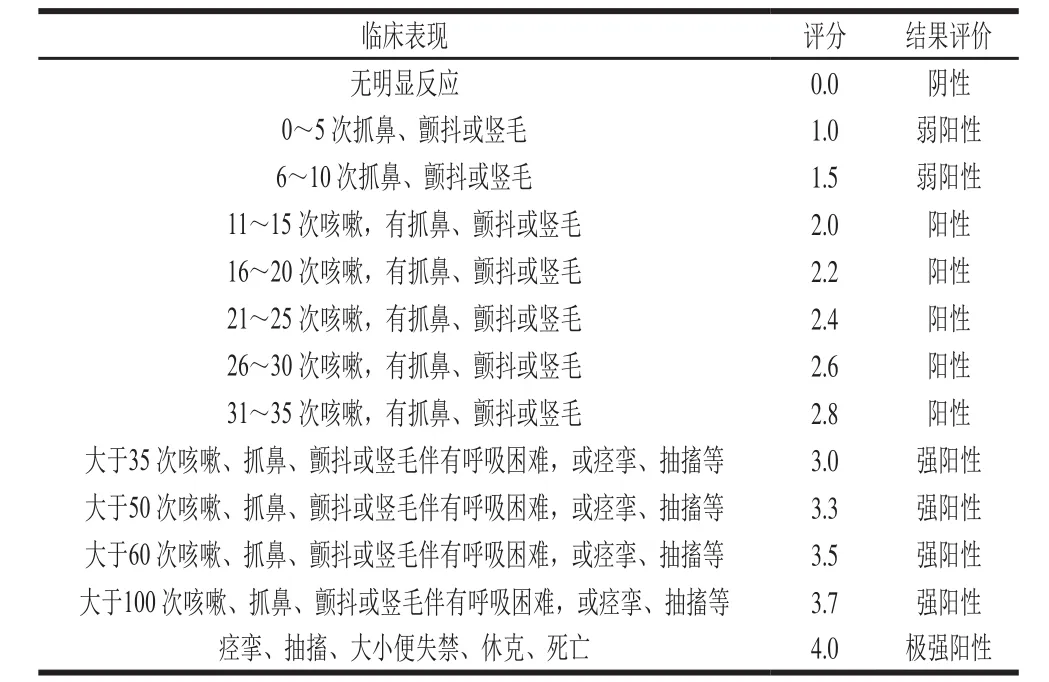
表2 豚鼠过敏反应判定标准Table 2 Criteria for assessment of systemic allergic reaction in guinea pig
1.3.4.2 致敏豚鼠离体回肠平滑肌过敏原攻击实验(Schultz-Dale反应)检测致敏性
合格豚鼠60 只,随机分10 组,每组6 只,雌雄各半。1~5组用PBS致敏,6~10组用0.1%未处理的虾蛋白致敏,各鼠腹腔注射,1.0 mL/只,隔日1 次,共3 次。末次注射后第14天进行Schultz-Dale反应实验。将致敏豚鼠断头处死,立即取出回肠一段,置于冷台氏液(通氧)中备用。按离体器官装置进行标本安装并描记,浴管内台氏液(通O2,37 ℃)保持20 mL。待肠收缩平稳后,用相应物质进行过敏原攻击(各攻击物的质量浓度均为0.1 g/mL,加入量均为0.2 mL),观察并记录肠收缩曲线,比较各组肠管收缩变化率[9],分析各高压结合酶法制备的低敏虾制品过敏原的消减效果。
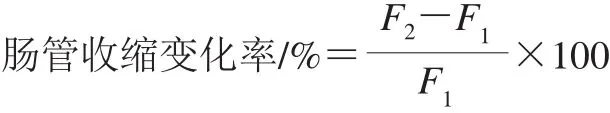
式中:F1为攻击前的肠平滑肌收缩力/g;F2为攻击后的肠平滑肌收缩力/g。
1.4 统计分析
2 结果与分析
2.1 高压结合酶法降解凡纳滨对虾过敏原的工艺条件及其低敏制品过敏原体外检测结果
采用间接ELISA法检测各样品的过敏原水平,以OD值的大小进行评价,对压力、保压时间、底物质量分数、酶加入量等因素的影响进行比较,分析并确定了虾蛋白、虾肉、虾仁过敏原降解的最佳工艺条件。按此条件进行重复实验,测得OD值,以相应原料为对照,计算低敏制品过敏原的消减效果,结果见表3。

表3 高压结合胰蛋白酶处理凡纳滨对虾过敏原的条件及其结果Table 3 Conditions for treatment of allergens of Litopenaeus vannamei by high pressure combined with trypsin and corresponding allergen reduction
从ELISA检测结果(表3)分析,经高压结合酶法处理的虾蛋白、虾肉和虾仁的过敏原性分别消减97.0%、94.1%和94.5%。
2.2 高压结合酶法制备的凡纳滨对虾低敏制品致敏性的在体检测结果
2.2.1 豚鼠全身过敏反应(过敏性休克模型)
以PBS、未处理虾蛋白进行致敏,通过豚鼠过敏性休克动物模型检测3 种经高压结合胰蛋白酶处理后的“低敏制品”中过敏原的消减效果,结果见表4。
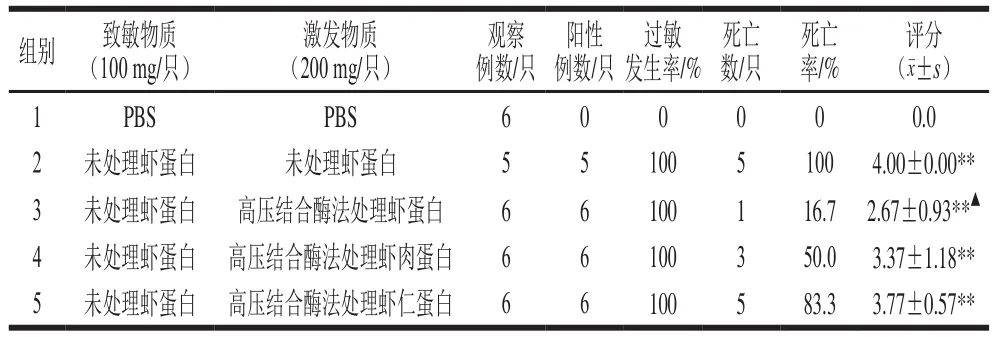
表4 豚鼠全身过敏反应结果及其评分Table 4 Results and scores of generalized anaphylaxis in guinea pigs
由表4可以看出,阴性对照组豚鼠在静脉注射后基本没有任何反应,未处理虾蛋白组(阳性对照)过敏反应发生率及死亡率均为100%,反应呈极强阳性。高压结合酶法制备的3 种“低敏虾制品”,过敏原性虽有所降低,但各组过敏反应发生仍为100%,经高压结合酶法处理的虾蛋白、虾肉和虾仁组豚鼠的死亡率分别为16.7%、50.0%和83.3%。体内实验结果表明,该工艺制备的“低敏虾制品”对于过敏体质者接触后的风险仍极高。
2.2.2 高压结合酶法制备的低敏虾制品引起的Schultz-Dale反应
分别用PBS和未处理虾蛋白进行致敏,再按分组分别用PBS、未处理虾蛋白、高压结合酶法处理获得的虾蛋白、虾肉和虾仁进行攻击,结果见表5。
表5 致敏豚鼠离体肠平滑肌攻击实验(n=6,x±s)Table 5 Results of Schultz-Dale reaction on isolated smooth muscle from guinea pigs (n= 6,x s)
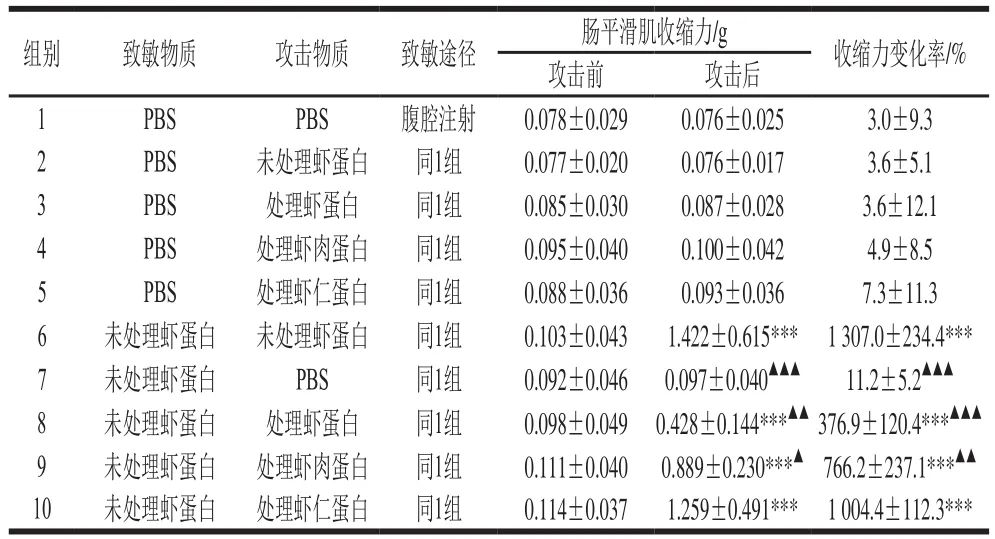
表5 致敏豚鼠离体肠平滑肌攻击实验(n=6,x±s)Table 5 Results of Schultz-Dale reaction on isolated smooth muscle from guinea pigs (n= 6,x s)
注:***.与1组(阴性对照)比较,差异显著,P<0.001;7~10组与6组(阳性对照)比较,差异显著,▲. P<0.05,▲▲. P<0.01,▲▲▲. P<0.001。
组别 致敏物质 攻击物质 致敏途径 肠平滑肌收缩力/g 收缩力变化率/%攻击前 攻击后1 PBS PBS 腹腔注射 0.078±0.029 0.076±0.025 3.0±9.3 2 PBS 未处理虾蛋白 同1组 0.077±0.020 0.076±0.017 3.6±5.1 3 PBS 处理虾蛋白 同1组 0.085±0.030 0.087±0.028 3.6±12.1 4 PBS 处理虾肉蛋白 同1组 0.095±0.040 0.100±0.042 4.9±8.5 5 PBS 处理虾仁蛋白 同1组 0.088±0.036 0.093±0.036 7.3±11.3 6 未处理虾蛋白 未处理虾蛋白 同1组 0.103±0.043 1.422±0.615*** 1 307.0±234.4***7 未处理虾蛋白 PBS 同1组 0.092±0.046 0.097±0.040▲▲▲ 11.2±5.2▲▲▲8 未处理虾蛋白 处理虾蛋白 同1组 0.098±0.049 0.428±0.144***▲▲ 376.9±120.4***▲▲▲9 未处理虾蛋白 处理虾肉蛋白 同1组 0.111±0.040 0.889±0.230***▲ 766.2±237.1***▲▲10 未处理虾蛋白 处理虾仁蛋白 同1组 0.114±0.037 1.259±0.491*** 1 004.4±112.3***
由表5可以看出,用PBS致敏的各组豚鼠,其致敏肠段给予各观察物质进行攻击,肠平滑肌的收缩力较攻击前均变化很小,与阴性对照组(1组)比较,无明显差异(P>0.05)。用未经处理的虾蛋白致敏各组豚鼠,采用PBS攻击,其肠段收缩力变化很小,与1组比较,无统计学意义;与阳性对照组(6组)比较,P<0.001;与6组比较,经未处理虾蛋白致敏的肠段,分别用经高压结合酶法处理的虾蛋白、虾肉和虾仁进行攻击,攻击后与攻击前比较,肠平滑肌的收缩力分别增强376.9%、766.2%和1 004.4%。该结果与全身过敏反应的趋势一致,并具有较明显的量效关系。说明经高压结合酶法处理的虾蛋白、虾肉和虾仁的过敏原性仍很高。
为直观比较各组肠的反应,剪辑各组豚鼠肠收缩曲线,标记后制成图1(每组取1 例)。
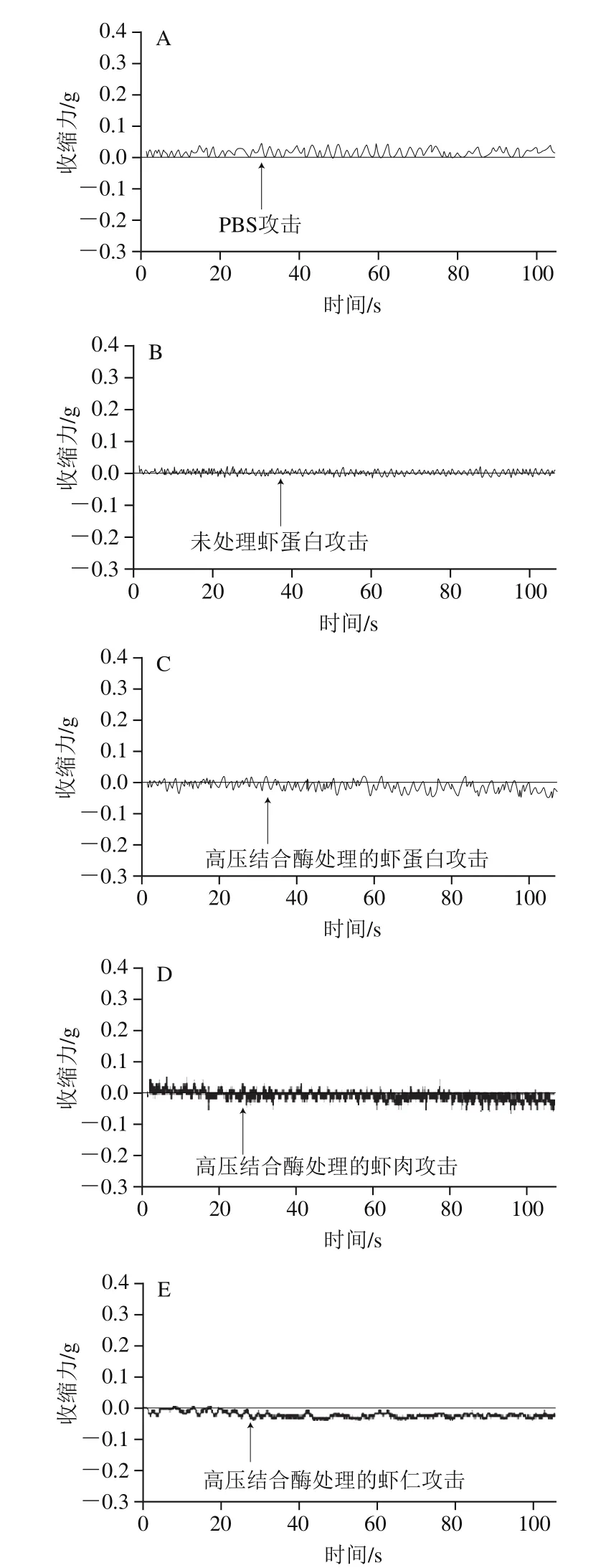
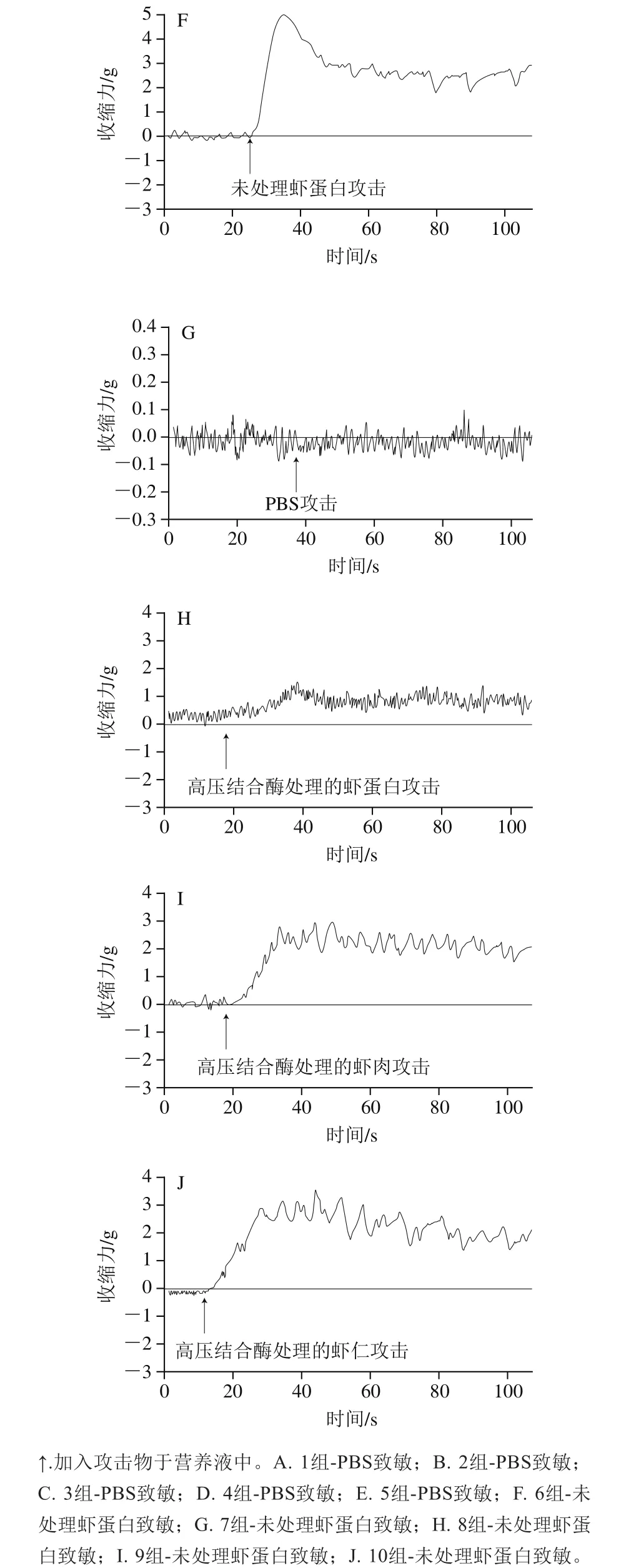
图1 各组豚鼠肠收缩曲线Fig. 1 Intestinal contraction curves of guinea pigs in each group
由表5和图1可以看出,用PBS致敏各组(1~5组)给予任何物质攻击,肠平滑肌都比较平稳,与1组比较,均为P>0.05,表明未产生过敏反应。未处理虾蛋白致敏各组(6~10组),用PBS攻击(7组),肠平滑肌也很平稳,而用未处理虾蛋白(6组,阳性对照)攻击,肠平滑肌立即发生极强烈的收缩;用高压结合酶法处理的低敏虾制品分别攻击,肠平滑肌的收缩也很迅速、强大,表明肠平滑肌处于强致敏状态,与1组(阴性对照)比较,均为P<0.001。此结果与全身过敏反应相一致。
3 讨论与结论
食物过敏,也称为食物变态反应,是由食物中的某种物质或食品添加剂等引起的,其为主要由IgE介导,部分由非IgE(如IgG)介导的超敏反应。目前,对食物过敏的研究已成为热点,但其发病机制仍不十分清楚,临床上也没有有效的治疗方法。因此,对过敏体质者来讲,预防食物过敏最好的方法是避免食入含过敏原的食物;对食品科学工作者来讲,应设法降低食物中的过敏原或开发脱敏或低敏食品,并建立行之有效的评价体系,使人们食用安全并有营养的物质。
有研究显示,通过加热等加工方式无法完全消除食物中过敏原,而微量过敏原的摄入就可能引发严重的过敏反应[10]。目前,国内外学者普遍采用酶解法降低食物中的过敏原,利用酶使蛋白质的肽链发生断裂,生成小分子肽和氨基酸,而达到降低过敏原的效果[11-12]。超高压法降解食物中的过敏原也是普遍采用的方法。超高压能影响生物大分子的结构,改变分子间和分子内的非共价作用力,采用这种方法可以通过改变过敏原物质的结构而降低其过敏原性,并且可改善食品的营养品质[13-14]。将酶解法与超高压法结合即为高压结合酶法,两者结合处理过敏原物质,过敏原性会降低更明显[15]。有报道显示,在300 MPa高压下酶解牛β-乳球蛋白AB的效果最好,高压前、高压后酶解对水解度没有显著影响[16]。本实验采用高压与酶解同时处理虾蛋白、虾肉和虾仁。经实验探索,处理3 种虾产品过敏原的优化条件为压力200 MPa、温度40 ℃、保压时间40 min、加酶量2 000~3 000 U/g。经体外间接ELISA方法检测,其中的过敏原分别消减97%、94.1%和94.5%,可认为被检测的过敏原已大部分消除。
食物过敏检测的方法主要有体内法和体外法。间接ELISA方法是检测食物过敏原最广泛、最常用的体外检测方法[17]。体内法中,人体可疑食物激发实验[18]具有一定的风险,其结果的影响因素也很多,在我国极少使用。动物实验便成为在体检测食物过敏的重要方法和手段[19]。动物实验即通过引起食物过敏的动物模型在体检测食物中过敏原的致敏性,再结合其他相关检测数据综合分析,对过敏原的致敏性做出合理、可靠性更高的评价。
检测食物过敏的动物模型有多种,常用的动物主要有小鼠[20-23]、大鼠[24-25]、豚鼠[26]、狗[27]、幼猪[28-29]等。豚鼠对过敏原敏感性高,不需要佐剂即可致敏,与人类的过敏原识别机制相似。因此,进行过敏性实验研究是极佳的备选对象[5,30-31]。本实验采用腹腔注射致敏,可以避开灌胃(口服)耐受的问题[32]。动物实验结果显示:全身过敏实验中,模型组(未处理虾蛋白致敏、未处理虾蛋白激发)全部发生过敏反应且死亡,过敏率和死亡率均为100%,过敏反应呈极强阳性。经高压结合酶处理后的虾蛋白、虾肉、虾仁组也均出现100%的过敏反应,且不同程度地由于过敏性休克而死亡,致敏强弱依次为:虾仁处理产物>虾肉处理产物>虾蛋白处理产物。在离体肠实验中,可见阳性对照组(模型组、未处理虾蛋白致敏、未处理虾蛋白攻击)在受到过敏原攻击后,肠管收缩极其明显;各致敏的肠管在经高压结合酶处理的虾蛋白、虾肉、虾仁攻击后,收缩也十分明显,与阴性对照组比较,其收缩改变率均为P<0.001;与模型组比较,均为P<0.05。动物离体实验与在体实验的结果一致,表明虾产品经高压结合酶处理后,致敏性虽然已明显减弱,但仍具有极强的致敏性,风险极大,极不安全。
本研究结果显示,体内体外的检测结果出现了不平行的现象,得出了不完全一致的结论,其可能的原因:体外检测的是过敏原的某一活性中心,虽然ELISA法灵敏度高、特异性好且操作方便,但其仅能确定抗原与抗体是否发生了特异性结合,并不能判定过敏原的致敏性强弱[33]。动物实验则是观察综合性的全身性反应,反应程度超过了体外检测结果,一方面说明过敏原消减还不够彻底、不够全面,还应做进一步的工艺优化,或在此基础上结合其他的方法进行过敏原降解。另一方面,由于食物过敏原结构复杂,体外检测过敏原要多方法结合进行综合分析。因此,在低过敏食品的开发过程中要注意过敏原的消除是否彻底,不能发生因过敏原的残留而导致过敏事件,对食物中过敏原的检测及其致敏性评价,无论方法灵敏度如何,体外检测都无法取代动物实验。

