选择性修饰MCM-41固定化脂肪酶及其催化合成甾醇酯的应用
张 欣,陈书曼,吴 楠,王 彤,裴兴武,江连洲,韩翠萍*,于殿宇*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
植物甾醇由于具有高熔点和低溶解性的物理性质而使其作为食品添加剂的使用受到限制。但是,将植物甾醇与脂类底物反应生成植物甾醇酯,可以方便地添加到食品原料中,因为植物甾醇酯的脂溶性更好[1]。目前,许多国家将植物甾醇酯添加到各类食品中以增加食品的功能性,在国内也被作为新资源食品[2-3]。植物甾醇酯可以由植物甾醇和大豆油通过酯交换反应生成。目前,可以通过化学法或者酶法合成植物甾醇酯,化学法生产植物甾醇酯过程中有副产物生成,产物需要分离除去催化剂等问题,而酶法生产植物甾醇酯则可以解决上述问题,同时温和的反应条件和生物催化剂的无毒性,可以提高生产效率[4]。
脂肪酶催化大豆油和植物甾醇酯交换反应时,游离酶由于具有不易分离且成本较高等缺点在使用中受到限制。将游离脂肪酶固定化后,能够增加单位面积内酶分子数量,提高反应效率,增强稳定性,增加使用次数,容易从反应中分离,从而有助于降低加工成本[5-6]。但是传统的共价结合法固定是以酶蛋白上游离的活性基团,如氨基、羧基、羟基、巯基等,随机与载体共价结合,会使部分处在活性中心的活性基团与载体结合形成新的键从而改变酶分子的活性中心结构,影响活性中心的作用效果,由此导致酶分子经固定化后活性大幅度降低[7]。
分子对接方法是指通过化学计量学模拟已知结构的受体(靶蛋白或活性位点)和配体间的相互作用识别,包括几何结构和分子间作用力,同时预测受体-配体复合物结构的一种方法[8-9]。南极假丝酵母脂肪酶B(Candida antarctica lipase B,CALB)作为催化剂催化底物反应时,活性中心起到主要作用,通过分子对接,可以获得CALB与其他分子结合时作用的活性位点。酶分子表面具有多种活性基团,如果在固定化过程中,使远离活性中心的活性基团与载体进行共价结合,避免活性中心的参与,就能最大程度地保持酶分子活性中心的构象不受影响,由此提高固定化酶的活性。
本实验通过分子对接技术研究CALB的活性中心,分析活性基团在酶分子上分布的特点,针对活性基团位置的分布特点,将MCM-41修饰成具有不同官能团的载体,并分别与游离的CALB进行固定化,研究修饰MCM-41载体对固定化CALB活性的影响。选取较优的固定化CALB研究其催化一级大豆油与植物甾醇的酯交换率。
1 材料与方法
1.1 材料与试剂
CALB(活性1 780.0 U/mL) 北京高瑞森生物科技有限公司;MCM-41 南京先丰纳米材料科技有限公司;γ-氨丙基三乙氧硅烷(3-aminopropyltriethoxysilane,APTES)(98%)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC)、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS) 中国医药集团上海化学试剂公司;一级大豆油、橄榄油(均为食品级)九三粮油工业集团有限公司;植物甾醇、戊二醛等其他试剂均为分析纯。
1.2 仪器与设备
DF-集热式恒温加热磁力搅拌器 上海耀特仪器设备有限公司;AR2140电子分析天平 上海精密其有限公司;JSM-2010F型透射电子显微镜 日本日立公司;7890A气相色谱仪 美国安捷伦公司;BPG-9056干燥箱上海一恒仪器有限公司;KQ-250V超声波振荡器 昆山市超声仪器有限公司;HH-1水浴锅 上海越众仪器设备有限公司;PHs-3C型pH计 上海伟业仪器厂。
1.3 方法
1.3.1 CALB活性中心及MCM-41修饰特性
1.3.1.1 CALB与配体分子对接
小分子的结构采用Chemdraw 11.0进行处理,将所得结果保存成mo12格式,然后用Autodock 4.0保存成pdbqt文件;通过同源建模获得蛋白1GWC.pdb结构,用Autodock 4.0处理蛋白结构,通过加氢、计算电荷、合并非极性氢后保存成pdb文件,最后保存成pdbqt文件;打开大小分子的pdbqt文件,然后以蛋白的活性位点为中心(center x=23.418,center y=9.189,center z=25.079),构建一个60×60×60的盒子,保存成gpf文件,通过autogrid运算生成glg文件;打开大小分子的pdbqt文件,利用默认的软件参数,小分子结构采取柔性方式,运算60 次,保存成dpf文件,通过Autodock运算生成dlg文件[10-11]。
1.3.1.2 CALB的氨基酸残基
通过在蛋白质数据库(Protein Data Bank,PDB)中查找,得到CALB的氨基酸序列,查找出其中带有活性基团及氨基酸残基,用RASWIN模拟出酶分子的结构及氨基酸残基分布,对CALB分子上的活性基团所属的氨基酸残基位置分布进行考察。
1.3.1.3 MCM-41的表面修饰
MCM-41氨基修饰:称取2.5 g MCM-41于表面皿中,在150 ℃条件下放置在干燥箱中24 h。在150 mL无水乙醇中加入2 g MCM-41和2 g γ-氨丙基三乙氧基硅烷。将得到的悬浊液在5 000 r/min条件下进行超声分散处理30 min。再将得到的悬浊液600 W、22 000 Hz超声振荡处理30 min。将得到的悬浊液在水浴中加热蒸发掉溶剂后,加入一定量的无水乙醇重复蒸发2 次,使用研钵研磨得到γ-氨丙基三乙氧基硅烷改性的氨基功能化MCM-41(NH2-MCM-41)[12]。
氨基功能化MCM-41的活化:在无水乙醇中加入20 mL NH2-MCM-41,再添加25%戊二醛溶液25 mL,在温度40 ℃,搅拌速率200 r/min处理10 h,反应结束后获得的载体即带有醛基活性基团(G-MCM-41)。将获得的载体分别用无水乙醇及去离子水冲洗4 次,再将其加入20 mL的去离子水中待用[13]。
1.3.1.4 修饰后的MCM-41载体固定CALB
G-MCM-41与CALB的固定:用磷酸缓冲液(pH 7.0)配制质量浓度为14 mg/mL的CALB酶液,在50 mL酶液中加入100 mg制得的带醛基活性基团的载体G-MCM-41,45 ℃反应5 h,反应结束后,收集固态酶,得到载体与游离ε-NH2通过共价结合法固定的CALB(G-MCM-41-CALB),最后用磷酸缓冲液(pH 7.0)洗涤3 次,测定其酶活性[14]。
NH2-MCM-41与CALB的固定:参照Kuo等[15]的方法,将2 mg EDC(2.6 mmol/L)加入到4 mL含有脂肪酶的磷酸盐(pH 8.5、50 mmol/L)缓冲溶液中,并将溶液25 ℃、150 r/min振荡反应1 h。然后,向溶液中加入2.4 mg NHS(5.2 mmol/L),反应1 h,获得被活性酯修饰过的酶。接着向溶液中加入50 mg表面修饰后的NH2-MCM-41,30 ℃、150 r/min振荡反应4 h,得到载体与—COOH通过共价结合法固定的CALB(NH2-MCM-41-CALB),最后用磷酸缓冲液(pH 7.0)洗涤3 次,测定其酶活性[16]。
1.3.2 活性高的固定化CALB催化大豆油与植物甾醇酯交换
1.3.2.1 单因素试验
称取一定量的一级大豆油加入锥形瓶中,加入植物甾醇、固定化脂肪酶和转子,置于集热式磁力搅拌器中,搅拌速率为400 r/min,调整温度,磁力搅拌反应一段时间后停止加热,反应物转入离心管中,4 000 r/min离心20 min后,取出上层油脂制品。研究反应温度、固定化脂肪酶的添加量、植物甾醇质量分数、反应时间对酯交换反应转化率的影响[17]。
1.3.2.2 响应面优化试验

表1 响应面试验设计因素与水平Table 1 Code and level of independent variables used for response surface analysis
如表1所示,以反应温度、G-MCM-41-CALB添加量、植物甾醇质量分数、反应时间为自变量,以转化率为响应值,研究各因素对酯交换反应转化率的影响。
1.3.3 指标的测定
1.3.3.1 CALB活性及相对酶活性的测定
CALB活性采用水解橄榄油乳化液的方法测定[18]。配制2%聚乙烯醇溶液,再加入橄榄油配成溶液,置于5~10 ℃水中,充分搅拌20 min,直至变成乳白色聚乙烯醇-油乳化液。以2.5 mL体积分数25%橄榄油乳化溶液作为底物,加入2 mL、0.1 mol/L磷酸盐缓冲液(pH 7.0),37 ℃水浴10 min后,加入0.5 mL游离脂肪酶(0.2 g固定化脂肪酶),在37 ℃水浴30 min后,加入5.0 mL乙醇-丙酮混合溶液(1∶1,V/V)终止反应,然后加入5.0 mL 0.05 mol/L的氢氧化钠溶液,再用0.05 mol/L盐酸溶液滴定反应溶液,计算出游离脂肪酸含量,脂肪酶的一个活性单位定义为在测定条件下每分钟释放1 mmol脂肪酸的脂肪酶添加量。相对酶活性按式(1)计算:

1.3.3.2 酶蛋白负载量的测定
反应体系中C A L B蛋白的质量浓度测定采用Bradford[19]的方法,酶蛋白负载量按式(2)计算:
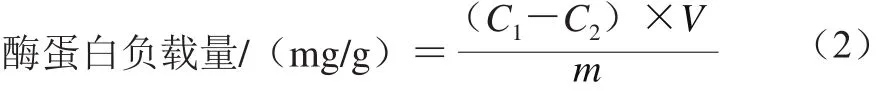
式中:C1和C2分别为反应体系中起始和反应后的CALB蛋白质量浓度/(mg/mL);V为反应液的体积/mL;m为载体MCM-41质量/g。
1.3.3.3 酯交换转化率的测定
通过气相色谱检测产品的峰值。色谱柱:CP-Sil-88石英毛细柱(0.32 mm×5 m,0.1 μm);程序升温:150 ℃保持2 min,以15 ℃/min升至370 ℃,保持5 min;分流比为80∶1;注入器和检测器温度为370 ℃;载气为氦气,流量7.0 mL/min。酯交换反应转化率按式(3)计算:

式中:植物甾醇和植物甾醇酯的峰值通过气相色谱测得到,峰值区域与质量浓度呈正比。
1.4 数据处理
2 结果与分析
2.1 CALB活性中心及修饰MCM-41固定化脂肪酶效果
2.1.1 分子对接结果
使用软件将CALB与甘油三酯进行分子对接,在对接过程中仅设定底物与酶的部分残基可以移动,酶的其它部分固定不动。以CALB为受体,三亚油酸甘油三酯为配体,三亚油酸甘油三酯可由甘油与油酸酯化合成,由3 条结构相同的支链组成,每条支链包含2 个双键。经过Chemdraw 11.0优化后,得到三亚油酸甘油三酯的长度值为29.9 Å。利用Autodock 4.0对其进行分子对接结果如图1所示。
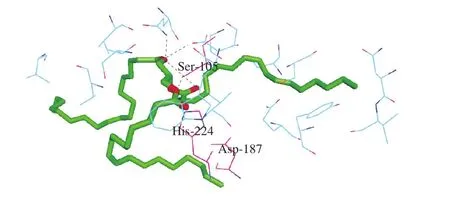
图1 CALB与配体对接结果Fig. 1 Lipase docking with ligand
从图1可以看出,小分子配体主要通过疏水、氢键、范德化力进入靶点蛋白活性位点,CALB与三亚油酸甘油三酯进行了很好的对接,多种氨基酸参与了与配体的作用,CALB与甘三酯结合的活性中心是由Ser-105、Asp-187和His-224三个氨基酸残基通过氢键组成的三维空间结构,CALB的活性中心为三联体“Ser-His-Asp”催化结构,与Uppenberg等[20]的研究结果一致。
2.1.2 CALB的基团组成

表2 CALB的氨基酸活性基团及残基个数Table 2 Number of amino acid active groups and residues in CALB
从PDB中的CALB 3D结构,选定PDB ID∶4ZV7,如表2所示,在CALB氨基酸残基中存在ε-NH2、—COOH、—OH及—SH等活性基团。活性基团在酶分子中的组成对酶的固定化有重要作用,通过CALB活性基团组成合理选择修饰到载体上的官能团种类[21]。
2.1.3 CALB分子的氨基酸残基分布
经分子对接结果可知,CALB分子催化三联体为Ser-105、Asp-187和His-224,利用RASWIN软件模拟得到具有4 个活性基团的氨基酸残基分布如图2所示。

图2 CALB分子的氨基酸残基分布Fig. 2 Distribution of amino acid residues in CALB molecule
由图2a可以看出,Lys残基主要是游离ε-NH2活性基团,Lys残基的位置距离活性中心较远,游离ε-NH2的分布比较分散,在活性中心附近没有发现游离ε-NH[22]。2由图2b可以看出,Asp、Glu残基主要是—COOH活性基团,—COOH大部分分布在远离酶活性中心的位置上,仅一小部分分布在活性中心。由图2c可以看出,Ser、Thr、Tyr残基主要是—OH活性基团,—OH含量多且分布范围广泛,并且在CALB催化活性中心分布较多,如果以—OH为结合位点,将会影响酶分子活性中心的活性。由图2d可以看出,Cys残基主要是—SH活性集团,—SH含量较少,且分布较为分散,若以其为结合位点,固定化效率降低[23]。
因此,首先将MCM-41载体修饰成具有氨基官能团的载体,以期能易与CALB的—COOH连接制得NH2-MCM-41-CALB。再将MCM-41载体修饰成具有醛基官能团的载体,以期能易与CALB的ε-NH2连接制得G-MCM-41-CALB[24],研究2 种官能团载体对CALB固定化的效果。
2.1.4 修饰MCM-41载体固定CALB的效果
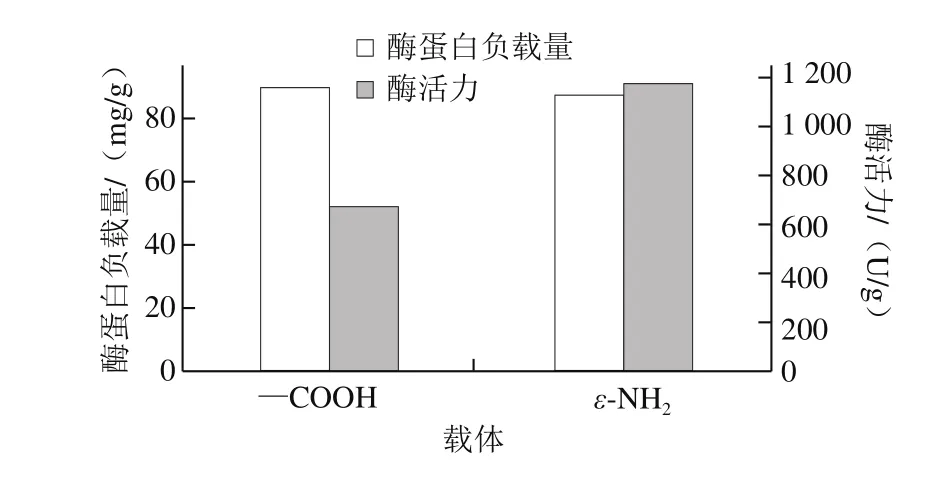
图3 载体与CALB固定效果Fig. 3 Immobilization efficiencies of CALB with different carriers
由图3可以看出,2 种载体固定得到的固定化CALB蛋白负载量均较高。用APTES对MCM-41载体改性得到的具有氨基官能团的载体NH2-MCM-41表面含有大量氨基,而CALB蛋白上最容易与氨基反应的基团是羧基,因此可以推测当CALB与NH2-MCM-41固定化时,改性后的载体NH2-MCM-41上大量的氨基与脂肪酶的羧基共价结合,制得的NH2-MCM-41-CALB活性较低,NH2-MCM-41载体加入戊二醛后得到的具有醛基官能团的载体G-MCM-41与CALB固定时,CALB表面的氨基与载体表面的氨基通过戊二醛交联固定[25]制成的G-MCM-41-CALB的活性较高。具有醛基官能团的载体易与游离ε-NH2共价结合,CALB含有游离ε-NH2的Lys残基分布在距离活性中心较远的位置(图2a),生成的共价键远离活性中心,对酶的活性影响较小[26]。具有氨基官能团的载体易与—COOH共价结合,CALB活性中心附近有一定量的—COOH(图2b),并且由分子对接结果可知含有—COOH的Asp187为催化三联体之一,当氨基与CALB活性中心附近少量的—COOH形成共价键时,就会影响CALB分子的活性中心构象,使NH2-MCM-41-CALB活性降低。
2 种不同官能团的载体对CALB固定结果与CALB分子的氨基酸残基分布结论吻合,具有醛基官能团的载体与游离酶的ε-NH2结合制成的G-MCM-41-CALB活性较高,因此,后续仅研究G-MCM-41-CALB特性。
2.2 G-MCM-41-CALB催化大豆油与植物甾醇酯交换反应的单因素试验结果
2.2.1 反应温度对酯交换反应转化率的影响
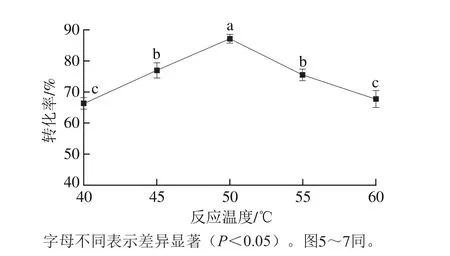
图4 反应温度对酯交换反应转化率的影响Fig. 4 Effect of reaction temperature on transesterification rate
以一级大豆油为底物,pH值为7.0,植物甾醇质量分数6.0%,酯交换时间5.0 h,G-MCM-41-CALB添加量为2.0%,搅拌速率400 r/min,结果如图4所示。随着体系反应温度的升高,G-MCM-41-CALB催化大豆油脂与植物甾醇的酯交换反应转化率呈先逐渐增加后逐渐降低的趋势(P<0.05),随着温度升高体系的黏度逐渐降低,反应体系内分子的运动速度加快,分子间的传质速率提高,促进了酶颗粒与底物之间的相互作用,当反应温度升高到50 ℃时酯交换反应转化率达到最高。随着反应温度的继续升高,可能破坏了酶分子的空间构象,导致酶分子的活性逐渐降低,G-MCM-41-CALB催化大豆油脂与植物甾醇的酯交换反应转化率逐渐降低(P<0.05),这一结果与Takanami等[27]研究的结果一致。
2.2.2 G-MCM-41-CALB添加量对酯交换反应转化率的影响
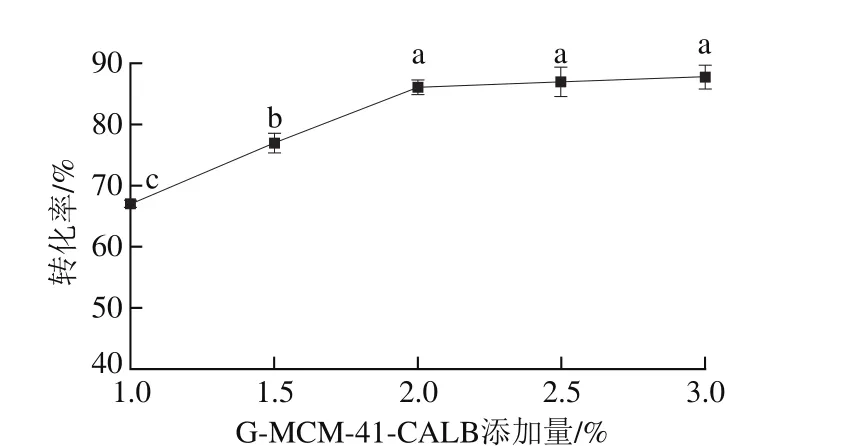
图5 G-MCM-41-CALB添加量对酯交换反应转化率的影响Fig. 5 Effect of G-MCM-41-CALB dosages on transesterification rate
以一级大豆油为底物,pH值为7.0,植物甾醇质量分数6.0%,反应温度50 ℃,反应时间5.0 h,搅拌速率400 r/min,结果如图5所示。随着G-MCM-41-CALB添加量的增加,大豆油脂与植物甾醇的酯交换反应转化率逐渐升高(P<0.05),随着G-MCM-41-CALB添加量的增加,G-MCM-41-CALB会提供较多的活性位点,增加了G-MCM-41-CALB与底物接触碰撞的机会。当G-MCM-41-CALB的添加量达到2.0%时,酯交换反应转化率上升不再明显,这可能是因为加酶量增多后,酶聚集在一起使其与底物接触的面积相对减少,脂肪酶不能更好地发挥其催化作用,从而导致酯交换转化率上升不明显,并且过多的酶用量也不利于产品精炼[28]。
2.2.3 植物甾醇质量分数对酯交换反应转化率的影响
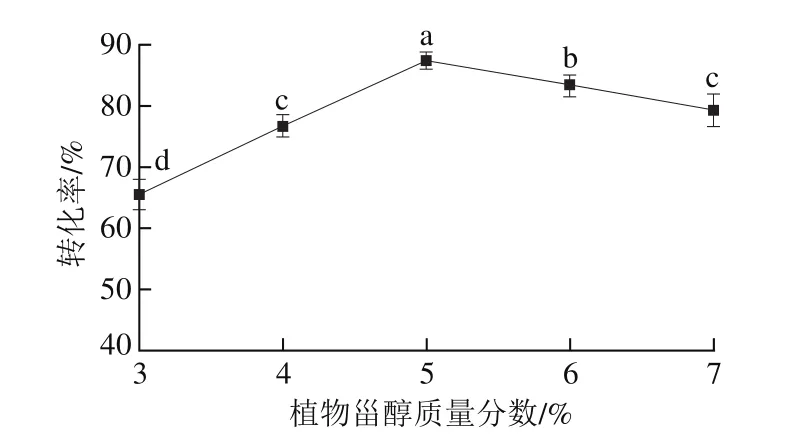
图6 植物甾醇质量分数对酯交换反应转化率的影响Fig. 6 Effect of phytosterol concentrations on transesterification rate
以一级大豆油为底物,pH值为7.0,反应温度50 ℃,酯交换时间5.0 h,G-MCM-41-CALB添加量2.0%,搅拌速率400 r/min,结果如图6所示。随着植物甾醇质量分数的增加,G-MCM-41-CALB催化大豆油脂与植物甾醇的酯交换反应转化率呈先逐渐增加后逐渐降低的趋势(P<0.05)。随着植物甾醇质量分数的增加,增加了植物甾醇的羟基吸附固定化酶活性中心的几率,大豆油脂与植物甾醇的酯交换反应转化率逐渐增加,当植物甾醇质量分数为5.0%时大豆油脂与植物甾醇的酯交换反应转化率达到最高值。随着植物甾醇质量分数继续增加,植物甾醇在一级大豆油中的溶解度达到了饱和状态,底物中植物甾醇的羟基与固定化酶活性中心的吸附与解吸达到了动态平衡,大豆油脂与植物甾醇的酯交换反应转化率逐渐降低。这一结果与王腾宇等[29]研究结果一致,其研究发现酯交换反应的最佳植物甾醇质量分数为5.0%。
2.2.4 反应时间对酯交换反应转化率的影响
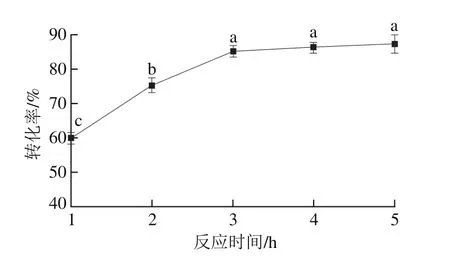
图7 反应时间对酯交换反应转化率的影响Fig. 7 Effect of reaction time on transesterification rate
以一级大豆油为底物,pH值为7.0,反应温度50 ℃,植物甾醇质量分数5.0%,G-MCM-41-CALB添加量2.0%,搅拌速率400 r/min,结果如图7所示。随着反应时间的延长,G-MCM-41-CALB催化大豆油脂与植物甾醇的酯交换反应转化率呈先逐渐增加后趋于平稳。在反应起始阶段,G-MCM-41-CALB的活性较高,随着反应时间延长,G-MCM-41-CALB与底物之间的接触充足,G-MCM-41-CALB催化大豆油脂与植物甾醇的酯交换反应转化率逐渐增加(P<0.05),当反应时间3.0 h时,酯交换反应转化率达到了85.1%。随着反应时间继续延长,G-MCM-41-CALB与底物之间的吸附与解吸达到平衡,酯交换反应转化率增加缓慢(P>0.05)。这一结果与Gharat等[30]研究结果一致,表明在最初的4 h内转化率达到86.6%,但随着反应进一步进行,酯交换反应4 h后转化率只有微小的变化。
2.3 G-MCM-41-CALB催化酯交换反应优化试验
如表3、4所示,将试验所得数据进行多元回归拟合,得到转化率(R1)对反应温度(A)、G-MCM-41-CALB添加量(B)、植物甾醇质量分数(C)以及反应时间(D)的回归方程为R1=87.33-0.27A+1.44B+0.16C+0.35D-0.18AB-0.11AC+0.37AD-0.60BC+0.18BD-0.91CD-9.49A2-3.48B2-3.21C2-3.77D2。
由表4可知,方程的自变量和因变量间具有显著的线性关系,该模型回归显著(P<0.05),失拟项不显著(P>0.05),并且该模型R2为0.999 1,R2Adj为0.998 2,说明该模型与试验拟合良好。
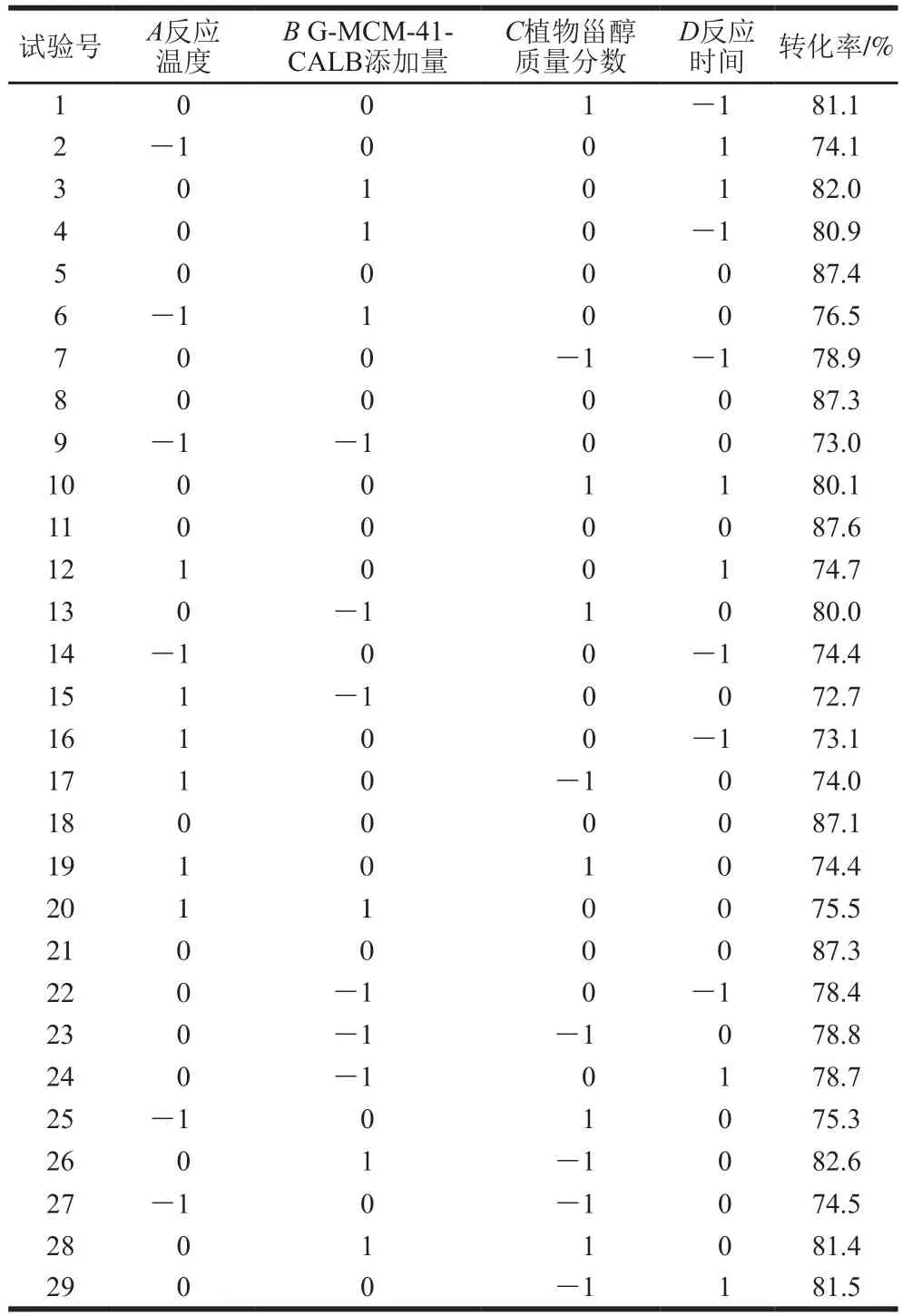
表3 响应面试验设计方案及结果Table 3 Design scheme and experimental results for response surface analysis

表4 方差分析结果Table 4 Analysis of variance of quadratic polynomial regression model
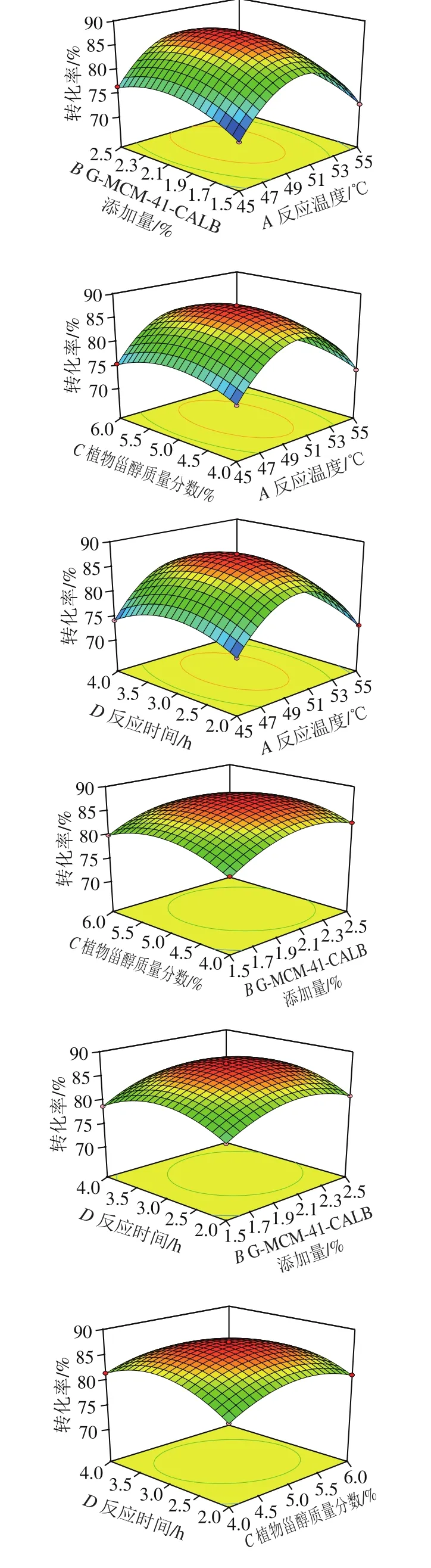
图8 各因素交互作用对酯交换转化率影响的响应面图Fig. 8 Response surface plots showing interactive effects of variables on transesterification rate
由图8可知,2 个因素交互影响时,保持一个因素不变,转化率随着另一个因素变化呈现先增加后降低的趋势,其中,反应温度和反应时间、G-MCM-41-CALB添加量和植物甾醇质量分数、植物甾醇质量分数和反应时间之间交互作用较为显著。通过试验设计优化得到G-MCM-41-CALB催化酯交换反应过程的最佳工艺参数为反应温度49.92 ℃、G-MCM-41-CALB添加量2.1%、植物甾醇质量分数5.0%、反应时间3.05 h,该条件下转化率预测值为87.5%。根据实际情况将工艺参数进行整理,得出整理值为反应温度50 ℃、G-MCM-41-CALB添加量2.1%、植物甾醇质量分数5.0%、反应时间3.0 h。为证明响应面优化出的条件下所得结果的可靠性,按照上述整理值进行3 组平行实验,得到的转化率平均值为87.4%,预测值与实验值之间具有良好的拟合性,从而证实了模型的有效性。
3 结 论
将CALB与三亚油酸甘油三酯进行分子对接,发现活性中心由Ser-105、Asp-187和His-224构成,在CALB活性中心发现大量的—OH及部分—COOH而没有发现游离ε-NH2。根据CALB活性基团的分布特点将MCM-41修饰成2 种不同官能团的载体。具有氨基官能团的载体易与—COOH结合,有部分结合位点在活性中心附近,使NH2-MCM-41-CALB活性降低。具有醛基官能团的载体易与ε-NH2结合,结合位点远离活性中心,G-MCM-41-CALB具有较高活性。结果与CALB分子的氨基酸残基分布结论吻合。G-MCM-41-CALB催化酯交换率达到87.4%。

