氨基酸手性荧光识别及光学组成测定实验设计
朱园园,王子君,古双喜,张 珩
氨基酸手性荧光识别及光学组成测定实验设计
朱园园1,王子君1,古双喜2,张 珩2
(1. 武汉工程大学 化学与环境工程学院,湖北 武汉 430205; 2. 武汉工程大学 化工与制药学院,湖北 武汉 430205)
将前沿的科研成果转化成综合实验教学内容,设计了荧光探针对氨基酸手性识别及光学组成测定的综合性实验。阐述了荧光探针的手性识别原理、实验流程、实验操作及实验结果分析。该实验属于手性化学、光物理、光化学、分析化学交叉学科的前沿研究领域,能激发学生的科研兴趣,培养学生的综合科研能力。该实验还具有可拓展性,能弥补传统综合实验的重复性和单一性问题。
综合实验;荧光探针;手性识别
在当今科技高度发展的时代,化学正从传统的化学化工领域向能源、生命、材料、信息、医药等领域渗透[1]。这就要求化学专业应以培养知识面广、综合素质高、有创新能力,且对交叉学科和前沿研究领域具有一定敏感性的高级专业人才为目标。而化学是一门建立在实验基础上的学科,教学实验的合理设计对人才的培养至关重要[2-5]。我校的化学专业综合实验是在学生完成4大化学基础实验的基础上开设的,目的是加强学生综合分析问题和解决问题的能力。本文 提出“荧光探针对氨基酸的手性识别及光学组成的测定”实验,是具有代表性的综合实验设计实例。
1 实验概述
手性是自然界的基本属性。作为生命活动基础的大分子及生命过程中发生的各种生物、化学反应均与手性密切相关。其中手性氨基酸是生命的重要组成部分,并且显示出重要的生物学功能。目前,手性药物在上市药物中的比重越来越大,而手性药物的不对称合成中,手性氨基酸常被用作手性前体和手性催化剂配体。因此,氨基酸的手性识别引起了大量关注。
近20年来,荧光探针由于其测定快速、操作简单并可批量测定的优势,在有机化合物手性识别中的应用取得很大进展[6-9]。2014年,由Pu和Yu研究组合作在中报道了Zn(II)可以显著提高基于手性醛的分子荧光探针()-1(见图1)对手性氨类的对映选择性识别[10],后续又有关于不同结构的手性醛类荧光探针在Zn(II)存在条件下对手性氨类(包括氨基酸)的对映选择性识别的报道[11-13]。
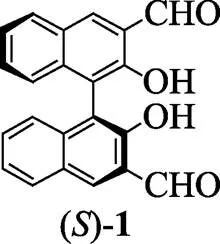
图1 荧光探针分子结构式
2019年,我们研究组与Pu研究组合作设计的一类荧光探针,将该类型的探针对氨基酸的对映选择性荧光增强比ef提高到了199[14]。ef=[L–0]/[D–0]=L/D,其中,0为探针分子的荧光强度,L和D分别为与L和D构型的底物反应后的荧光强度。将此课题研究中较为成熟的内容提炼出来,作为化学专业的综合实验“荧光探针对氨基酸的手性识别及光学组成测定”。
2 实验原理
探针分子()-1在氨基酸存在时,其醛基与氨基酸的氨基可以进行缩合反应生成亚胺。由于—C==N—与其邻位—OH存在氢键作用可以形成OH···N==C,从而使其在激发状态下存在分子内质子转移,使得荧光淬灭。但当与Zn2+络合时,这种激发态的分子内质子转移会被抑制,从而使荧光增强[10]。当()-1与不同构型的氨基酸作用时,由于空间位阻及亚胺产物的分子刚性和稳定性的差别,荧光增强程度不同,从而可以实现对氨基酸的手性识别。另外,若能找到探针荧光强度与氨基酸光学组成之间的关系,便能同时实现对氨基酸光学组成的测定。
3 实验仪器与药品
仪器:Horiba FluoroMax-4荧光分光光度计,电子天平,微量移液枪,移液管,4 mL带刻度离心管。
药品:荧光探针()-1(99%,自制),D-苯丙氨酸(D-Phe,99%,Macklin),L-苯丙氨酸(L-Phe,99%,Macklin),四丁基氢氧化铵(TBAH·30H2O,98%,Aladdin),无水醋酸锌(99.99%,Macklin),乙腈(HPLC级),去离子水(自制)。
4 实验基本流程及实验方法
本实验基本流程如图2所示,包括荧光探针分子和氨基酸母液的配置,探针分子与氨基酸反应液的制备及荧光的测定等。
图2 实验流程图
4.1 母液的配置
4 mg ()-1溶于5.8 mL CH3CN得到2 mM荧光探针母液;256 mg TBAH·30H2O溶于10 mL去离子水得到32 mmol/L的TBAH水溶液;分别称取5.3 mg D-Phe和L-Phe溶于32 mmol/L的TBAH水溶液得到32 mmol/L的氨基酸母液;5.9 mg Zn(OAc)2溶于5 mL去离子水得到6.4 mmol/L的Zn(OAc)2水溶液。
4.2 反应液的制备
2 mmol/L荧光探针母液用CH3CN稀释至0.2 mmol/L备用;将32 mmol/L的D-Phe和L-Phe氨基酸母液分别用32 mmol/L的TBAH水溶液稀释至25.6、19.2、12.8、9.6、6.4、3.2 mmol/L的氨基酸水溶液备用。
接下来进行氨基酸手性识别以及荧光强度与氨基酸当量关系测定的反应液制备。
用移液枪分别移取14份400 μL的()-1荧光探针母液(0.2 mmol/L,1 equiv)于4 mL带刻度离心管中;再用移液枪分别移取25 μL浓度为3.2、6.4、9.6、12.8、19.2、25.6、32 mmol/L的D-Phe溶液(1、2、3、4、6、8、10 equiv)依次加入7份400 μL的()-1溶液中,同样用移液枪分别移取25 μL浓度为3.2、6.4、9.6、12.8、19.2、25.6、32 mmol/L的L-Phe溶液(1、2、3、4、6、8、10 equiv)依次加入另外7份400 μL的()-1溶液中;最后用移液枪移取14份25 μL的Zn(OAc)2水溶液(6.4 mM,2 equiv)分别加入以上14份()-1和氨基酸的混合液中。
所有反应液于离心管中密闭静置2 h后加CH3CN稀释至4 mL得到荧光待测液,此待测液中()-1的浓度为0.02 mmol/L。同时,浓度为0.02 mmol/L纯的()-1探针乙腈溶液,加入了2 equiv Zn(OAc)2的探针溶液,以及同时加入了2 equiv Zn(OAc)2和10 equiv TBAH的探针溶液分别作为荧光识别的对照溶液。
最后进行荧光强度与氨基酸光学纯度关系测定的反应液制备。
将浓度为12.8 mmol/L的D-Phe和L-Phe的溶液以不同体积比混合,分别得到总体积为200 μL,L-Phe的光学纯度ee值(ee=([L]–[D])/([L]+[D]))分别为–100%、–80%、–60%、–40%、–20%、0、20%、40%、60%、80%、100%的氨基酸溶液备用。用移液枪移取11份400 μL的()-1荧光探针母液(0.2 mmol/L,1 equiv)于4 mL带刻度离心管中,再用移液枪移取25 μL如上配置的ee值为–100%~100%的11份氨基酸溶液分别加入离心管中,最后用移液枪移取25 μL的Zn(OAc)2水溶液(6.4 mmol/L, 2 equiv)加入这11份混合液中。所有反应液于离心管中密闭静置2 h后,加CH3CN稀释至4 mL,得到荧光待测液,此待测液中()-1的浓度为0.02 mmol/L。
5 实验结果与分析
5.1 激发波长的选择
为了选择合适的激发波长,应用荧光仪的3D模式,并设定激发波长和发射波长的扫描范围分别为317 ~ 417 nm和335~850 nm,对()-1 + 14 equiv L-Phe (in TBAH) + 2 equiv Zn(II)的混合反应液进行了测试,得到如图3所示的激发波长EX、发射波长EM、荧光强度的关系图。从图3可以看到,当激发波长在400~420 nm范围内时,位于510 nm左右的发射峰强度最强。因此在后面的荧光测试实验中,选择了处于该范围内的417 nm为激发波长。
进行图3测试的反应液为0.2 mmol/L ()-1(400 μL,in CH3CN,1 equiv)、12.8 mmol/L L-Phe(25 μL,in 32 mmol/L TBAH水溶液,4 equiv)和6.4 mmol/L Zn(OAc)2水溶液(25 μL,2 equiv)的混合液;反应液在室温静置2 h,并用乙腈稀释至4 mL后再进行荧光测试;EX= 317 ~ 517 nm,EM= 335 ~ 850 nm,Slit = 2/2 nm。
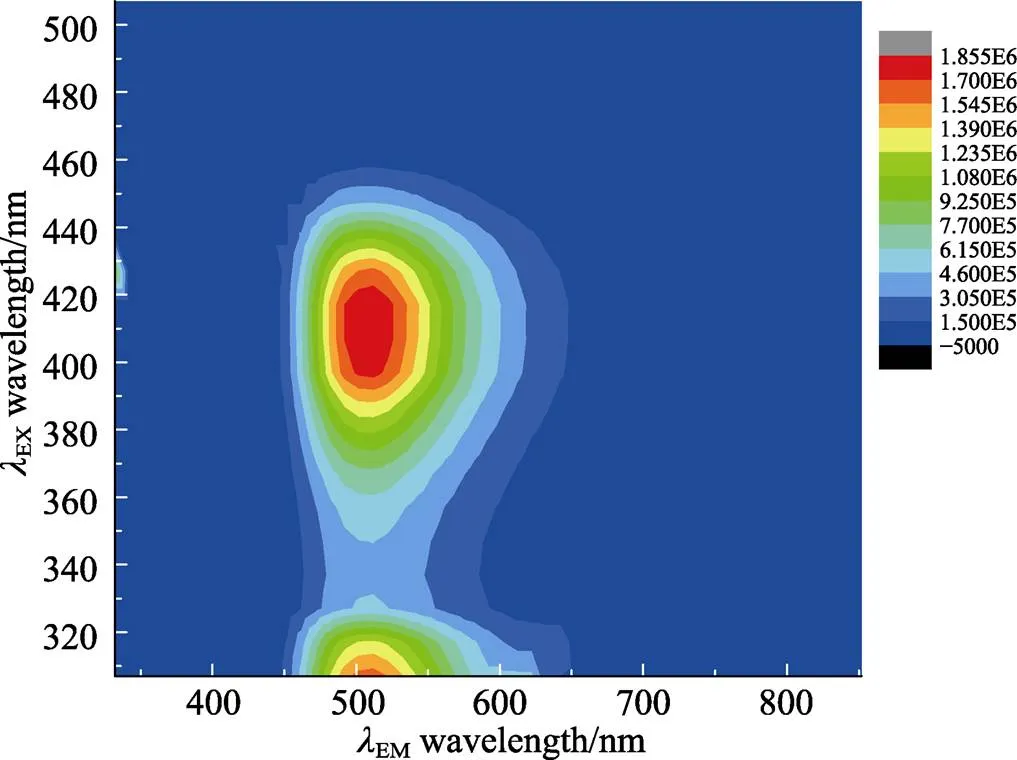
图3 激发波长-发射波长-荧光强度关系图
5.2 探针荧光强度与氨基酸当量的关系及其对氨基酸的手性选择性
在所选择的激发波长下,研究了在2 equiv Zn(II)存在条件下,该荧光探针对不同构型的Phe在不同当量下的荧光响应情况,如图4(a)和4(b)所示。可以看到,未加入氨基酸的sensor、sensor + Zn(II)以及sensor + Zn(II) + TBAH体系均没有荧光,虽然L和D构型Phe的加入均能打开该探针在>500 nm的荧光窗口,但是该探针对L-Phe的荧光响应明显强于对D-Phe的响应。图4(c)显示了510 nm处的荧光强度与不同构型的Phe的当量之间的关系,当该探针体系中加入L构型的Phe时,在1 ~ 4 equiv范围内,荧光强度随氨基酸当量的增加而显著增加,在4 equiv L-Phe的条件下达到最大,继续增加L-Phe的量反而导致荧光强度降低。这说明4 equiv L-Phe与()-1和Zn(II)反应可以达到平衡,继续增加氨基酸的浓度会导致体系荧光的淬灭。而当该探针体系加入D构型的Phe时,虽然荧光强度与氨基酸当量之间的关系与加入L-Phe的体系类似,但是在整个1~10 equiv范围内,荧光响应都明显弱于L构型。因此,()-1可以作为Phe手性识别的荧光探针。图4(d)显示了该探针体系对4 equiv D和L构型的Phe的对映选择性荧光增强结果,计算得到选择性荧光增强比为3.6。

图4 荧光探针在不同条件下的荧光响应
图4(a)为0.2 mmol/L ()-1(400 μL,in CH3CN,1 equiv、3.2~32 mmol/L L-Phe(25 μL,in 32 mmol/L TBAH水溶液,1~10 equiv)和6.4 mmol/L Zn(OAc)2水溶液(25 μL,2 equiv)混合液的荧光光谱;图4(b)为0.2 mmol/L ()-1(400 μL,in CH3CN,1 equiv、3.2~ 32 mmol/L D-Phe(25 μL,in 32 mmol/L TBAH水溶液,1~10 equiv)和6.4 mmol/L Zn(OAc)2水溶液(25 μL,2 equiv)混合液的荧光光谱;图4(c)为荧光探针在510 nm的荧光强度随D-/L-Phe当量的变化;图4(d)为荧光探针对4 equiv D-Phe和L-Phe的荧光响应。所有反应液均在室温密闭静置2 h后用乙腈稀释至4 mL,再进行荧光测试;EX= 417 nm,Slit = 2/2 nm。
5.3 测定氨基酸光学组成的标准曲线测定
为了实现该荧光探针在氨基酸光学组成测定中的应用,通过测试得到了荧光强度与氨基酸光学组成之间关系的标准曲线。在4 equiv的Phe的条件下,得到了如图5所示的关系图。结果显示,荧光强度与L-Phe的值呈线性关系,直线方程为= 5 349.62 + 1.10 × 10–6, 确定系数R-Square为0.977 69,其中为510 nm处的荧光强度,为L-Phe的光学纯度ee值。该结果说明荧光探针()-1可以用来进行氨基酸光学组成的测定。

图5 荧光强度与氨基酸光学组成之间关系的标准曲线
荧光探针在510 nm的荧光强度与L-Phe光学纯度ee之间的关系测试中,测试液为0.2 mmol/L ()-1(400 μL,in CH3CN,1 equiv)、不同光学纯度12.8 mmol/L Phe(25 μL,in 32 mmol/L TBAH水溶液,4 equiv)和6.4 mmol/L Zn(OAc)2水溶液(25 μL,2 equiv)的混合液,在室温下密闭静置2 h后用乙腈稀释至4 mL,再进行荧光测试。EX= 417 nm,Slit = 2/2 nm。
6 结语
该实验综合了手性化学、光物理、光化学、分析化学的内容,属于交叉学科的前沿性综合实验,本文从实验原理、实验流程、具体操作和实验结果分析等方面进行了详细阐述。在实验结果分析中,按“激发波长选择—氨基酸手性荧光识别—氨基酸光学组成测定”的思路来进行讨论,使学生对荧光探针的研究方法有一个全方位的认识,丰富了学生的研究思路。该实验还可拓展到对其他氨基酸或其他手性氨类的荧光识别上,可以让不同学生做不同的手性底物,激发研究兴趣,开拓研究思维,弥补传统实验的重复性、单一性问题。另外,针对部分综合能力较强的学生,可以将该实验拓展至通过核磁和质谱等表征手段对手性识别机理进行研究。
[1] 卢怡,刘金库.一个应用化学专业综合实验的设计及教学实践[J].化工高等教育,2013, 30(3): 36–39.
[2] 吴音,刘蓉翾,李亮亮.科研成果转化为综合性实验教学探索[J].实验技术与管理,2016, 33(8): 162–164.
[3] 陈伟,柏正武.超高脱乙酰度壳聚糖制备与表征综合实验设计[J].实验技术与管理,2018, 35(8): 42–45, 50.
[4] 吕占霞, 贺维军, 高珍, 等.综合化学实验教学体系改革与创新[J].大学化学,2011, 26(1): 14–15, 28.
[5] 付颖,叶非.基础化学系列实验课程体系优化[J].大学化学,2013, 28(2): 25–28.
[6] PU L. Simultaneous Determination of Concentration and Enantiomeric Composition in Fluorescent Sensing[J]. Accounts of Chemical Research. 2017, 50(4): 1032–1040.
[7] PU L. Enantioselective Fluorescent Sensors: A Tale of BINOL[J]. Accounts of Chemical Research. 2012, 45(2): 150–163.
[8] PU L. Fluorescence of Organic Molecules in Chiral Recognition[J]. Chemical Reviews, 2004, 104(3): 1687–1716.
[9] ACCETTA A, CORRADINI R, MARCHELI R. Enantioselective Sensing by Luminescence[J]. Topics in current chemistry, 2011, 300: 175−216.
[10] HUANG Z, YU S, WEN K, et al. Zn(II) Promoted Dramatic Enhancement in the Enantioselective Fluorescent Recognition of Functional Chiral Amines by a Chiral Aldehyde[J]. Chemical science, 2014, 5(9): 3457–3462.
[11] WANG C, ZENG C, ZHANG X, et al. Enantioselective Fluorescent Recognition of Amino Acids by Amide Formation: An Unusual Concentration Effect[J]. The Journal of Organic Chemistry, 2017, 82(23): 12669–12673.
[12] ZENG C, ZHANG X, PU L. Enantioselective Fluorescent Imaging of Free Amino Acids in Living Cells[J]. Chemistry – A European Journal, 2017, 23(10): 2432–2438.
[13] HERRERA B T, PILICER S L, ANSLYN E V, et al. Optical Analysis of Reaction Yield and Enantiomeric Excess: A New Paradigm Ready for Prime Time[J]. Journal of the American Chemical Society, 2018, 140(33): 10385–10401.
[14] ZHU Y Y, WU X D, GU S X, et al. Free Amino Acid Recognition: A Bisbinaphthyl-Based Fluorescent Probe with High Enantioselectivity[J]. Journal of the American Chemical Society, 2019, 141(1): 175–181.
Design on experiment of chiral fluorescence recognition and optical composition determination of amino acids
ZHU Yuanyuan1, WANG Zijun1, GU Shuangxi2, ZHANG Heng2
(1. School of Chemistry and Environmental Engineering, Wuhan Institute of Technology, Wuhan 430205, China; 2. School of Chemical Engineering and Pharmacy, Wuhan Institute of Technology, Wuhan 430205, China)
The frontier scientific research results are transformed into comprehensive experimental teaching contents. A comprehensive experiment of chiral recognition and optical composition determination of amino acids by fluorescent probes is designed. The principle of chiral recognition of fluorescent probes, the experimental process, the experimental operation and the analysis of experimental results are described. This experiment belongs to the frontier research field of chiral chemistry, photophysics, photochemistry and analytical chemistry, which can stimulate students’ interest in scientific research and cultivate their comprehensive scientific research ability. This experiment also has expansibility, which can make up for the repeatability and singularity of traditional comprehensive experiment.
comprehensive experiment; fluorescent probe; chiral recognition
G642.423;O6-339
A
1002-4956(2019)10-0175-04
10.16791/j.cnki.sjg.2019.10.042
2019-02-15
国家自然科学基金项目(201602164);湖北省教学研究项目(2017335);武汉工程大学教学研究项目(X2017034);武汉工程大学科学研究项目(K201716);武汉工程大学第十二期大学生校长基金(2017061)
朱园园(1982—),女,湖北潜江,博士,副教授,主要从事物理化学的教学和手性化学及荧光探针领域的研究。E-mail:yyzhu531@163.com

