妊娠期糖尿病患者脂肪组织ERα表达水平对胰岛素抵抗的影响
徐 宁 张 薇
胰岛素抵抗是妊娠期糖尿病的主要发病原因之一。目前认为妊娠期出现胰岛素抵抗与胎盘分泌的多种激素有关。其中与雌激素的关系尤为密切,雌激素可通过与受体结合降低脂肪与肌肉组织葡萄糖转运蛋白4(GLUT4)的表达,降低胰岛素敏感度。另外,雌激素受体本身也可调节细胞膜GLUT4的水平,从而参与妊娠引起的胰岛素抵抗以及妊娠期糖尿病[1]。脂肪组织是发生胰岛素抵抗的主要场所之一[2]。研究显示,脂肪组织的分布情况会对胰岛素抵抗产生影响,妊娠期间由于雌激素水平的改变以及能量的过多摄入,会改变体内脂肪组织的分布,笔者试图通过对晚期妊娠期糖尿病患者及正常妊娠者脂肪组织雌激素受体表达情况的研究,探究其与胰岛素抵抗的相关性以及可能的作用机制。
对象与方法
1.临床病例研究:病例选择:选择2016年1月~2017年3月在杭州市第一人民医院产检并行择期剖宫产的孕妇为研究对象,其中40例妊娠期糖尿病患者为GDM组,患者平均年龄32.05±2.13岁,平均分娩孕周38.88±1.20周,同期41例正常妊娠孕妇作为对照组,平均年龄31.25±3.12岁,平均分娩孕周39.26±1.02周。GDM诊断参照国际妊娠与糖尿病研究组织的标准,所有患者无产科合并症如妊娠期高血压、妊娠期肝内胆汁淤积症等,无内外科合并症如2型糖尿病、甲状腺功能减退或亢进、非药物依赖、无胎儿先天异常、无吸烟史、非借助辅助生殖技术以及非多胎妊娠。记录患者剖宫产分娩前身高、体重、宫高、腹围以及孕前体重。于手术前抽取空腹静脉血,电化学发光免疫法测定血清雌二醇水平,己糖激酶法测定空腹血糖水平、直接化学发光法测定空腹胰岛素水平。按胰岛素抵抗稳态模型 (HOMA模型) 计算胰岛素抵抗指数 (HOMA-IR) =空腹血浆胰岛素 (μU/ml)×空腹血浆葡萄糖 (mmol/L)/22.5评估胰岛素抵抗水平。于剖宫产手术时收集所有患者皮下、腹膜外及大网膜部位的脂肪组织各两小块,保存于-80℃冰箱。所有标本获取均得到患者的知情同意。
2.RT-PCR法检测GDM组及正常妊娠组不同部位脂肪组织ERαRNA的表达:将收集的脂肪组织分为用Trizol裂解细胞,提取细胞总RNA。然后测定RNA含量,并进行反转录成cDNA。使用primer 3进行引物设计,ERα上游引物为:5′-CTGCCACCCTATCTGTATCTTTTCCTATTCTCC-3′,下游引物:5′-TCTTTCTCTGCCACCCTGGCGTCGATTATCTGA-3′,β-actin上游引物:5′-CATGTACGTTGCTATCCAGGC-3′,下游引物:5′-CTCCTTAATGTCACGCACGAT-3′,然后进行RT-PCR,以actin为标准,将CT值进行比较之后得到的ERα表达。
3.Western blot法检测ERα蛋白的表达水平:将收集的脂肪组织用含蛋白酶抑制剂的裂解液裂解细胞,提取总蛋白[3]。BCA法测定蛋白含量,配制上样蛋白。进行蛋白电泳,250mA电流运行2.5h转膜转至PVDF膜,质量分数为5%脱脂牛奶封闭1h。洗膜3次后,加入一抗,4℃孵育过夜。洗膜3次后,加入二抗,室温继续孵育1h。最后加入化学发光辣根过氧化酶(HRP)底物,于化学发光成像仪进行分析。使用Quantity one (bio-rad)软件量化相关条带的发光强度。
4.3T3-L1前脂肪细胞培养和诱导分化[4]:3T3-L1前脂肪细胞购自中国科学院上海生命科学研究院细胞资源中心。取第4~6代的3T3-L1前脂肪细胞进行实验。将其接种于6孔板,完全培养基[高糖DMEM培养基(美国HyClone公司)中添加质量分数为10%的BSA、10U/L青霉素和10U/L链霉素]培养待细胞融合2天后,加含0.5mmol/L的异丁基甲基黄嘌呤(IBMX)、0.25μmol/L地塞米松和1mg/L胰岛素的完全培养基(诱导分化培养基Ⅰ)培养2天后,用只含1mg/L胰岛素的完全培养基(诱导分化培养基Ⅱ)继续培养,每隔2天更换1次培养液,约12天到14天后,90%以上细胞分化为成熟脂肪细胞,细胞体积增大,胞体变圆,胞质内脂滴明显。
5.RT-PCR法测定ERα和GLUT4在成熟脂肪细胞RNA的表达水平,Western blot法检测其在蛋白水平的表达:将分化成熟的脂肪细胞在含有20ml/L胎牛血清(美国Abcam公司)高糖DMEM中培养6h,在成熟脂肪细胞中加入不同浓度的17β-雌二醇(0、0.1、1、10、100nmol/L),培养12h后收集细胞,分别用RT-PCR法和Western blot法测定ERα(美国Abcam公司)和GLUT4的表达水平。
6.Western blot法检测MAPK通路JNK、ERK1/2、P38 活性:将10nmol/L浓度17β-雌二醇与成熟脂肪细胞共同孵育12h后,收集细胞,提取蛋白,用博士德BCA蛋白定量试剂盒测定蛋白浓度后各取蛋白50μg变性,SDS聚丙烯酰胺凝胶电泳后电转移至硝硝酸纤维素膜,含有5%牛奶的TTBS缓冲液封闭1h,PVDF膜与小鼠抗人p-JNK(美国CST公司),兔抗人p-ERK1/2(美国CST公司),p-p38单克隆抗体(美国CST公司,1∶1000)4℃下孵育过夜,TBST 15min漂洗3次,加入羊抗鼠(武汉博士德公司),羊抗兔二抗(武汉博士德公司,1∶1000)室温下孵育1h,TBST 15min漂洗3次,使用ImmobilonTM Western Chemiluminescent HRP Substrate显色剂显色,全自动凝胶成像分析仪器拍照。为校正总蛋白上样量一致,检测完上述磷酸化抗体后的膜以洗脱液(100mmol/L β-ME,2%SDS,62.5mmol/L Tris-HCL pH值6.7)于50℃洗脱30min,再用兔抗人JNK,ERK1/2、p38多克隆抗体(1∶1000)检测总JNK、ERK1/2、p38作为内对照,测定杂交信号的吸光度,每组实验重复3次,p-JNK、p-ERK1/2、p-p38代表被激活的MAPK[5]。同上方法检测PI3K/Akt信号通路PI3K、Akt活性。

结 果
1.GDM患者组与正常妊娠孕妇组一般资料比较:GDM患者组E2水平、HOME-IR明显高于正常妊娠组,差异有统计学意义(P=0.000),两组孕妇年龄、孕周、孕前体重指数(pre-BMI)、宫高比较,差异均无统计学意义(P>0.05),详见表1。

表1 一般资料
2.GDM患者组及正常妊娠组不同部位脂肪组织雌激素受体α的表达情况:GDM患者皮下、腹膜外及大网膜3处脂肪组织中,雌激素受体α在RNA和蛋白的表达水平均明显低于正常妊娠者,且差异有统计学意义(P<0.05),详见图1、图2。
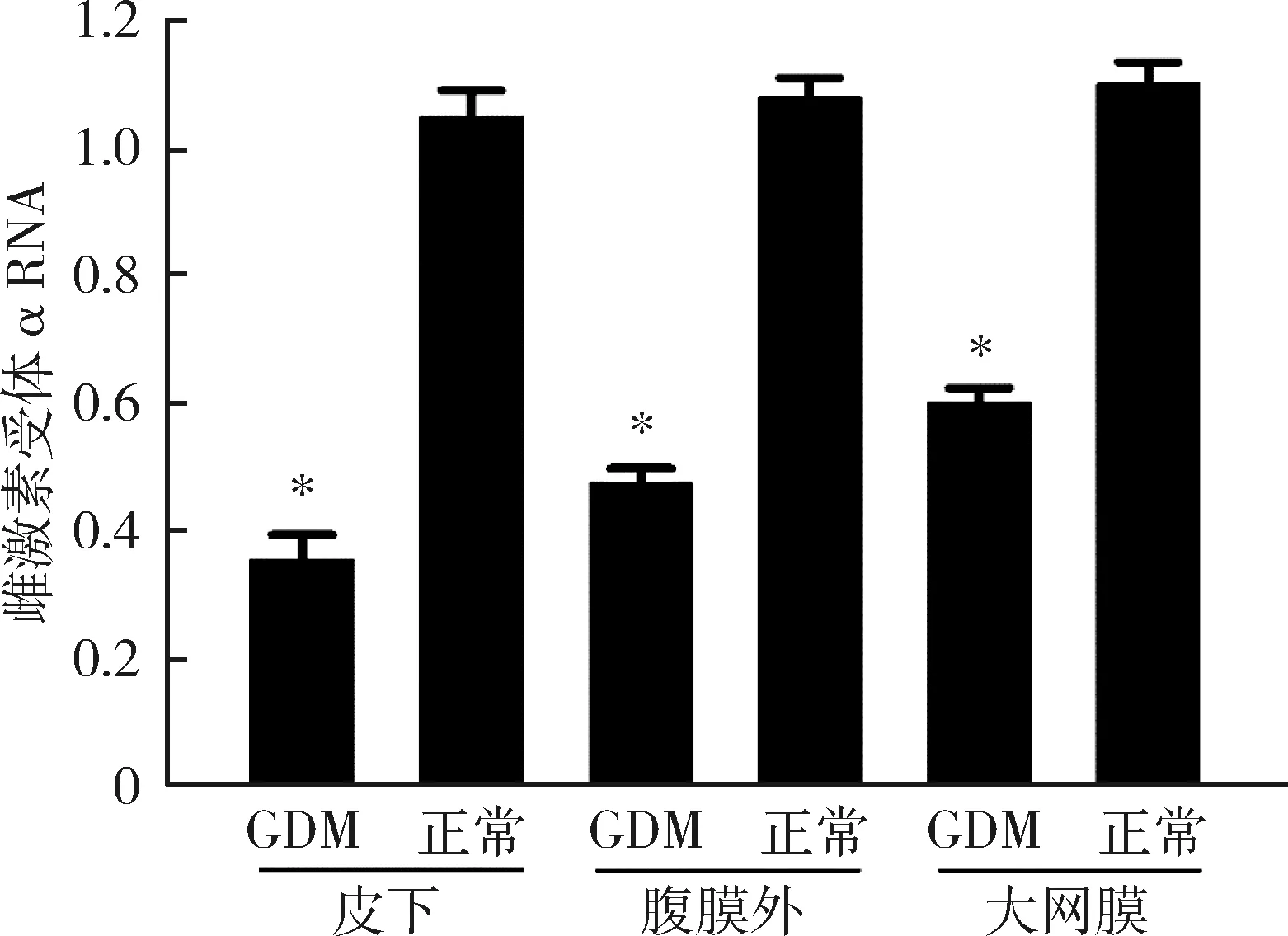
图1 雌激素受体α在RNA水平的表达与正常妊娠组比较,*P<0.05
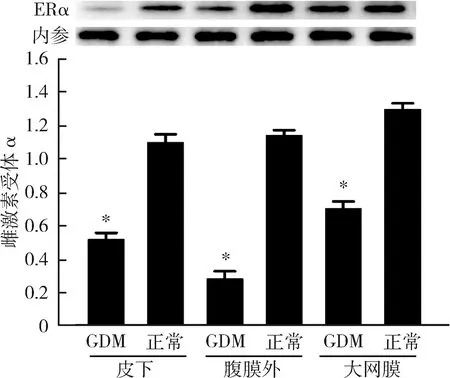
图2 雌激素受体α在蛋白水平的表达与正常妊娠组比较,*P<0.05
3.不同浓度17β-雌二醇处理后成熟脂肪细胞雌激素受体α及GLUT4的表达情况:随着17β-雌二醇浓度的升高,雌激素受体α不论在RNA水平还是在蛋白水平,其表达均逐步受到抑制,并且在10nmol/L浓度下,雌激素受体α表达水平达到最低,差异有统计学意义(P<0.05),详见图3、图4。GLUT4的表达情况与ERα相似,也在10nmol/L浓度时表达水平最低,差异有统计学意义(P<0.05),详见图5、图6。

图3 不同浓度17β-雌二醇刺激下雌激素受体α在RNA水平的表达与10nmol/L比较,*P<0.05

图4 不同浓度17β-雌二醇刺激下雌激素受体α在蛋白水平的表达与10nmol/L比较,*P<0.05
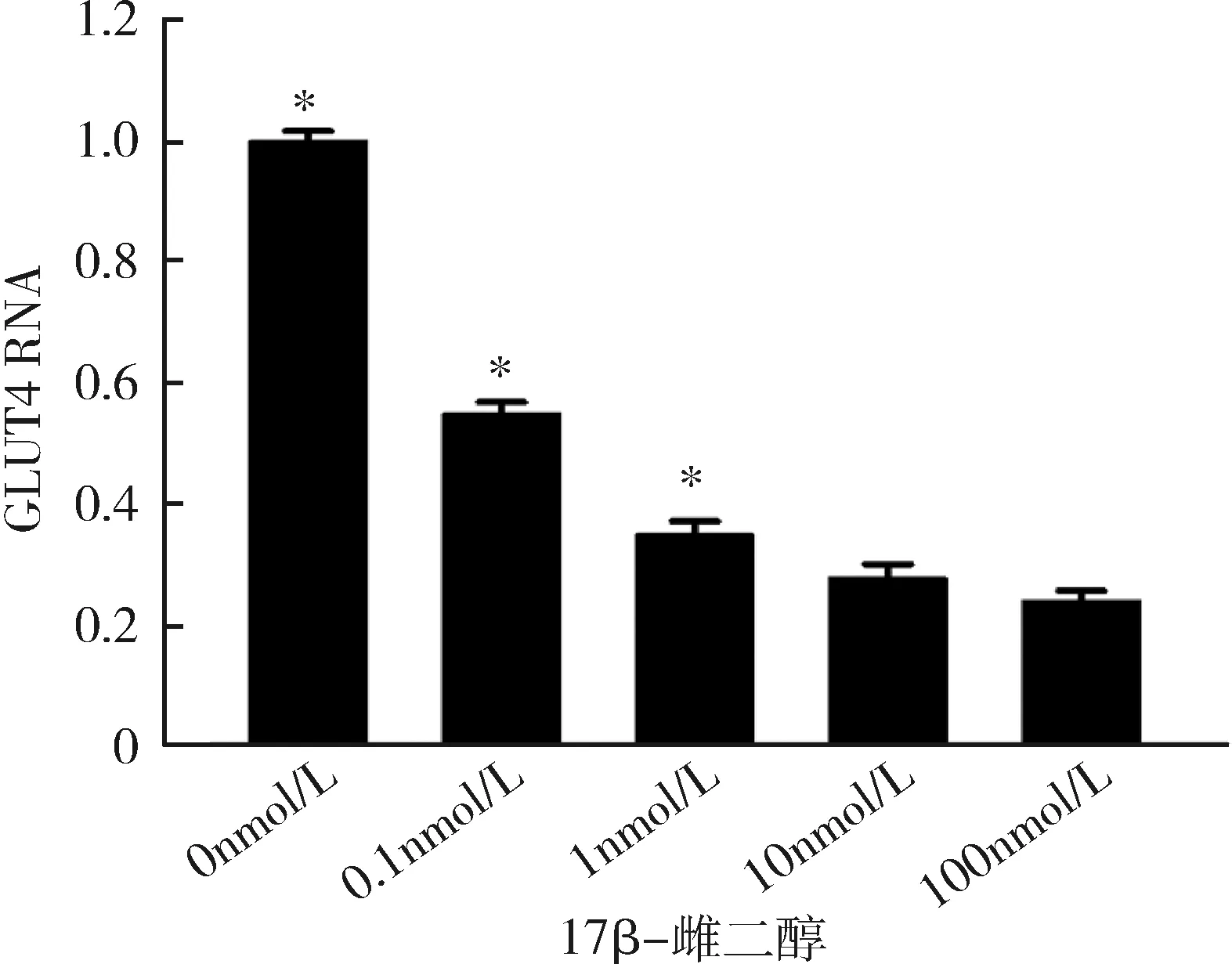
图5 不同浓度17β-雌二醇刺激下GLUT4在RNA水平的表达与10nmol/L比较,*P<0.05

图6 不同浓度17β-雌二醇刺激下GLUT4在蛋白水平的表达与10nmol/L比较,*P<0.05
4.高浓度17β-雌二醇刺激下胰岛素信号通路(PI3K/Akt和MAPK)的表达情况:在10nmol/L浓度的17β-雌二醇刺激下,脂肪细胞PI3K/Akt信号通路的PI3K和p-Akt的蛋白表达量均下调,MAPK通路的p-Erk、p-MAPK和p-p38的蛋白表达量下调,而p-JNK的蛋白表达量上调(图7)。
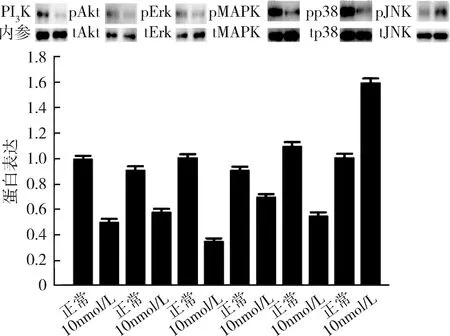
图7 高浓度17β-雌二醇刺激下PI3K/Akt和MAPK信号通路表达情况
讨 论
妊娠期糖尿病(gestational diabetes mellitus GDM)是指妊娠期间发生的糖代谢异常,与孕期胰岛素抵抗和分泌相对不足密切相关[6]。其发生率世界各国报道为1%~14%。我国GDM的发生率也呈逐年上升趋势。妊娠期是女性漫长的人生过程中的特殊时期。妊娠期间为了适应胎儿的生长,激素和代谢环境会发生明显的改变,胎盘分泌的多种激素在维持妊娠的同时,可增加胰岛素抵抗,使胰岛素的靶组织对胰岛素的敏感度降低,从而使无糖尿病者发生妊娠期糖尿病(GDM),隐性糖尿病呈显性或原有糖尿病的患者病情加重。除了肝脏和骨骼肌,胰岛素信号途径在脂肪组织葡萄糖代谢中同样起重要作用,并且有越来越多的研究证实,脂肪组织才是胰岛素抵抗产生的始发部位[7]。
雌激素是女性生殖系统中最重要的类固醇激素之一,在调节人体代谢中发挥了重要作用[8]。妊娠期间女性雌激素水平可显著升高,与受体(estrogen receptor,ER)结合后,可介导经典的信号转导途径,产生过度肥胖、胰岛素抵抗等多种雌激素效应[9]。本研究也显示GDM组不但雌激素水平显著高于正常妊娠组,胰岛素抵抗的严重程度也显著高于正常妊娠组,表明GDM患者胎盘会分泌更多的雌激素,也证实高雌激素水平与胰岛素抵抗之间密切相关。
雌激素核受体(ER)是核受体超家族的成员之一,ERα和ERβ是其中主要的两种亚型,两者由不同基因编码,从而在生物学特性上体现出许多差异[10]。ERα在调节脂质代谢中发挥重要作用,动物研究实验证实雌激素对葡萄糖代谢的调节作用主要由ERα介导,并且与妊娠期胰岛素敏感度改变和糖耐量异常相关[11]。ERα主要分布于雌二醇作用的经典靶组织,包括脂肪组织。妊娠期间充足的营养摄入,以及胎盘分泌多种激素的调控,使得孕妇体内脂肪组织的数量和分布产生明显的改变,不论是皮下脂肪还是内脏脂肪,含量均会明显升高,由此导致的ERα在脂肪组织的表达水平也会发生变化。本研究显示,GDM患者皮下、腹膜外及大网膜3处脂肪组织中,雌激素受体α在RNA和蛋白的表达水平均明显低于正常妊娠患者,表明高浓度的雌激素水平会抑制脂肪组织ERα的表达,并与胰岛素抵抗的发生密切相关,这与雌激素可导致GLUT4以雌激素受体依赖的方式转移到质膜上,从而降低组织中雌激素受体与GLUT4的表达有关[12]。
脂肪细胞占脂肪组织的1/3~1/2,笔者将3T3-L1前脂肪细胞株培养分化为成熟脂肪细胞,并给予不同浓度的17β-雌二醇,发现随着17β-雌二醇浓度的升高,雌激素受体α不论在RNA水平还是在蛋白水平,其表达均逐步受到抑制,并且在10nmol/L浓度下,雌激素受体α表达水平达到最低,而GLUT4的表达情况与ERα相似,进一步证实了高浓度的雌激素水平会抑制雌激素受体α在脂肪细胞的表达。研究表明葡萄糖转运体(GLUT)在胰岛素作用下可以运动到细胞膜上吸收血液中的葡萄糖,GLUT4是脂肪组织对葡萄糖摄取过程中一个重要的调节因子,GLUT4表达受抑制,表明脂肪组织对胰岛素的敏感度降低,胰岛素抵抗加重[13]。在成熟脂肪细胞中,高能浓度17β-雌二醇刺激下,GLUT4与雌激素受体α表达同步受抑制,也证明了雌激素受体α表达与胰岛素抵抗的发生密切相关。
目前已知的胰岛素信号通路主要有PI3K/Akt通路和ERK/MAPK通路[14]。二磷酸磷脂酰肌醇在PI3K催化下转化为三磷酸磷脂酰肌醇,激活的PI3K/Akt能够促使GLUT4从胞质转位至胞膜,同时细胞外的葡萄糖经由胞膜上的GLUT4转运至细胞内,因此这一通路的活化增加了细胞对葡萄糖的摄取,如果上述信号通路转导过程发生障碍,将导致脂肪组织发生胰岛素抵抗[15]。笔者进一步研究了高浓度17β-雌二醇作用下,对成熟脂肪细胞PI3K/Akt信号通路的影响,发现其在抑制ERα表达的同时,抑制PI3K/Akt信号通路,故而推测ERα可能通过抑制PI3K/Akt信号通路,加剧了胰岛素抵抗。笔者也观察到ERα对MAPK通路的影响表现为下游p-Erk、p-MAPK和p-p38的蛋白表达量下调,而p-JNK的蛋白表达量上调,表明ERα可能通过激活JNK通路而对胰岛素抵抗产生影响。
综上所述,脂肪组织ERα的表达水平与胰岛素抵抗密切相关,并且可能通过抑制PI3K/Akt信号通路和激活JNK通路从而对胰岛素抵抗产生影响。

