PD-L1表达与乳腺癌临床病理参数及预后的关系
李玉玲 毛 尊 巩玉森
乳腺癌(breast cancer ,BC)是女性最常见恶性肿瘤之一,长期以来被认为较黑色素瘤及肾恶性肿瘤具有较低的免疫原性[1]。实际上,乳腺癌是一种多基因参与的高度异质性肿瘤。同时,研究发现乳腺癌具有免疫作用,其中ER阴性、高度增殖性乳腺癌具有较高免疫原性[2,3]。近年来,癌症免疫治疗领域取得巨大进展,特别是免疫检查点抑制剂的开发,如ipilumumab、细胞毒性T 淋巴细胞相关抗原-4(cytotoxic lymphocyte- associated antigen-4 ,CTLA-4)和程序性死亡受体-1(programmed cell death 1,PD-1)/程序性死亡配体-1(programmed death ligand 1,PD-L1)轴抑制剂[4]。其中PD-1/PD-L1轴被认为是乳腺癌免疫治疗中最有希望的靶点。PD-1是由多种免疫细胞(如T淋巴细胞、B淋巴细胞、树突状细胞等)表达的细胞表面膜蛋白,与其配体PD-L1和(或)PD-L2结合后,抑制淋巴细胞激活,促进调节性T细胞的活化,从而抑制免疫应答[5~7]。在癌症中是肿瘤细胞免疫逃逸的共同机制。PD-L1 在多种肿瘤组织微环境内上调,能够使癌症相关免疫细胞发生凋亡,减弱其免疫原性,参与癌症的免疫逃逸过程。PD-1/PD-L1抑制剂的临床试验显示出非常有希望的效果和持久的反应性,特别是在黑色素瘤、肺癌和膀胱癌中[4,8]。此外,PD-L1表达与治疗客观反应之间具有相关性[8]。至于PD-L1作为免疫治疗预测标志物的研究在乳腺癌中仍然较少,因此探索PD-L1在乳腺癌组织的表达具有一定的必要性。本研究采用免疫组化SP法判断PD-L1在乳腺癌组织微阵列(TMA)上的表达,并分析PD-L1表达与患者临床病理参数及生存预后的关系。
资料与方法
1.临床资料:收集2010年4月~2016年5月徐州医科大学附属医院乳腺癌石蜡标本217例,选择肿瘤组织的核心区域构建TMA。217例患者的平均年龄为50.0±10.7岁,范围为26~80岁;肿瘤最大直径0.6~7.2cm,平均直径为2.79±1.40cm;腋窝淋巴结转移93例,无淋巴结转移124例;根据《WHO乳腺肿瘤分类》内改良Scarff-Bloom-Richardson分级系统,判断肿瘤组织分化程度,SBR 1级9例,2级148例,3级60例;根据ER、PR、HER-2和Ki67的表达比率,将乳腺癌分为4组分子亚型,Luminal A 型13例,Luminal B型 81例,HER-2过表达型60例,TNBC型63例;根据国际抗癌联盟(UICC)及美国癌症联合会(AJCC)乳腺癌TNM分期方法,Ⅰ+Ⅱ期183例, Ⅲ+Ⅳ期34例。
2.TMA的建立:TMA使用最具代表性的区域构建,其中单个病例具有一个重复。所有肿瘤组织核心区域的选择均由两位经验丰富的病理医生对组织切片进行评估后决定。两名病理医生在同一病例中核心区域选择的差异通过联合分析解决。从每个乳腺癌病例石蜡切片形态学上具有代表性的区域(肿瘤内核心)冲压出直径0.6mm的组织圆柱体,并使用半自动化组织块将其带入一个空白石蜡(2.5~3.0cm)中。
3.免疫组化:采用免疫组化SP法进行染色,4μm切片的TMA组织经柠檬酸钠溶液热诱导抗原修复后,过氧化氢阻止内源性过氧化物酶表达,超级封闭液减少一抗非特异性结合,滴加预稀释的PD-L1 (E1L3N)单克隆抗体(兔抗人,1∶400,美国CST公司)37℃温箱孵育1h。滴加酶标二抗聚合物37℃温箱孵育20min。使用标准DAB技术进行免疫染色。用苏木精溶液进行复染。PD-L1的结果判读:①部分或完整细胞膜染色(≥1+)的肿瘤细胞占全部肿瘤细胞<1%,为PD-L1阴性;②部分或完整细胞膜染色(≥1+)的肿瘤细胞占全部肿瘤细胞≥1%,为PD-L1阳性。Ki67以20%为截点,判断表达高低。
4.随访:217例乳腺癌患者中有209例具有完整临床随访信息,随访时间为1~100个月,中位随访时间63个月,其中死亡24例,转移或复发44例,生存(截尾数据)8例。总体存活(overall survival,OS):是第1次确诊开始到任何原因引起患者死亡的时间(失访为最后一次随访时间;仍然存活为随访结束时间)。无病存活(disease free survival,DFS):是第1次确诊到患者发生复发/转移的时间(失访为最后一次随访时间;仍然存活为随访结束时间)。
5.统计学方法:采用SPSS 20.0统计学软件对数据进行统计分析。使用χ2检验及Fisher精确检验分析PD-L1表达与临床病理参数之间的关系。使用Kaplan-Meier方法和对数秩检验来计算OS和DFS比率并比较存活曲线之间的差异。使用单因子COX比例风险模型识别与乳腺癌OS和DFS显著相关的因子,多变量COX模型评估了PD-L1表达与其他因子之间的双向相互作用,以P<0.05为差异有统计学意义。
结 果
1.乳腺癌临床病理特征:关于腋窝淋巴结转移、远处转移及血管侵犯的结果显示分别有42.9%(93/217)、17.1%(37/217)和21.2%(46/217)的阳性病例。SBR分类结果显示只有4.2%(9/217)为Ⅰ级,95.8%(208/217)为Ⅱ级及Ⅲ级[分别为68.2%(148/217)和27.6%(60/217)]。基于免疫组织化学染色,ER、PR和HER-2阳性率分别为30.4%(66/217)、37.3%(81/217)和42.9%(93/217)。同时评估了Ki67的表达情况,71.0%(154/217)患者Ki67高表达,29.0%(63/217)低表达。分子分型结果显示Luminal B型是最常见,占总体的37.3%(81/217),其次是TNBC型为29.0%(63/217,表1)。
2.PD-L1表达与乳腺癌临床病理参数的关系:PD-L1阳性表达主要定位于肿瘤细胞的细胞膜或细胞质(图1)。217例可评估原发性乳腺癌组织构成的TMA中,PD-L1阳性率为14.7%(32/217),PD-L1在乳腺癌分子亚型中阳性率,以TNBC型最高,为30.2%(19/63),其次HER-2过表达型13.3%(8/60),Luminal A型 7.7%(1/13)和Luminal B型4.9%(4/81),且PD-L1表达与分子分型比较,差异有统计学意义(P<0.01)。进一步分析发现,PD-L1表达与患者的年龄、腋窝淋巴结转移、远处转移、血管侵犯及TNM分期比较,差异无统计学意义(P>0.05);而与肿瘤的直径、组织分化程度、ER状态、PR状态、HER-2状态和Ki67高表达比较,差异有统计学意义(P<0.05,表1)。
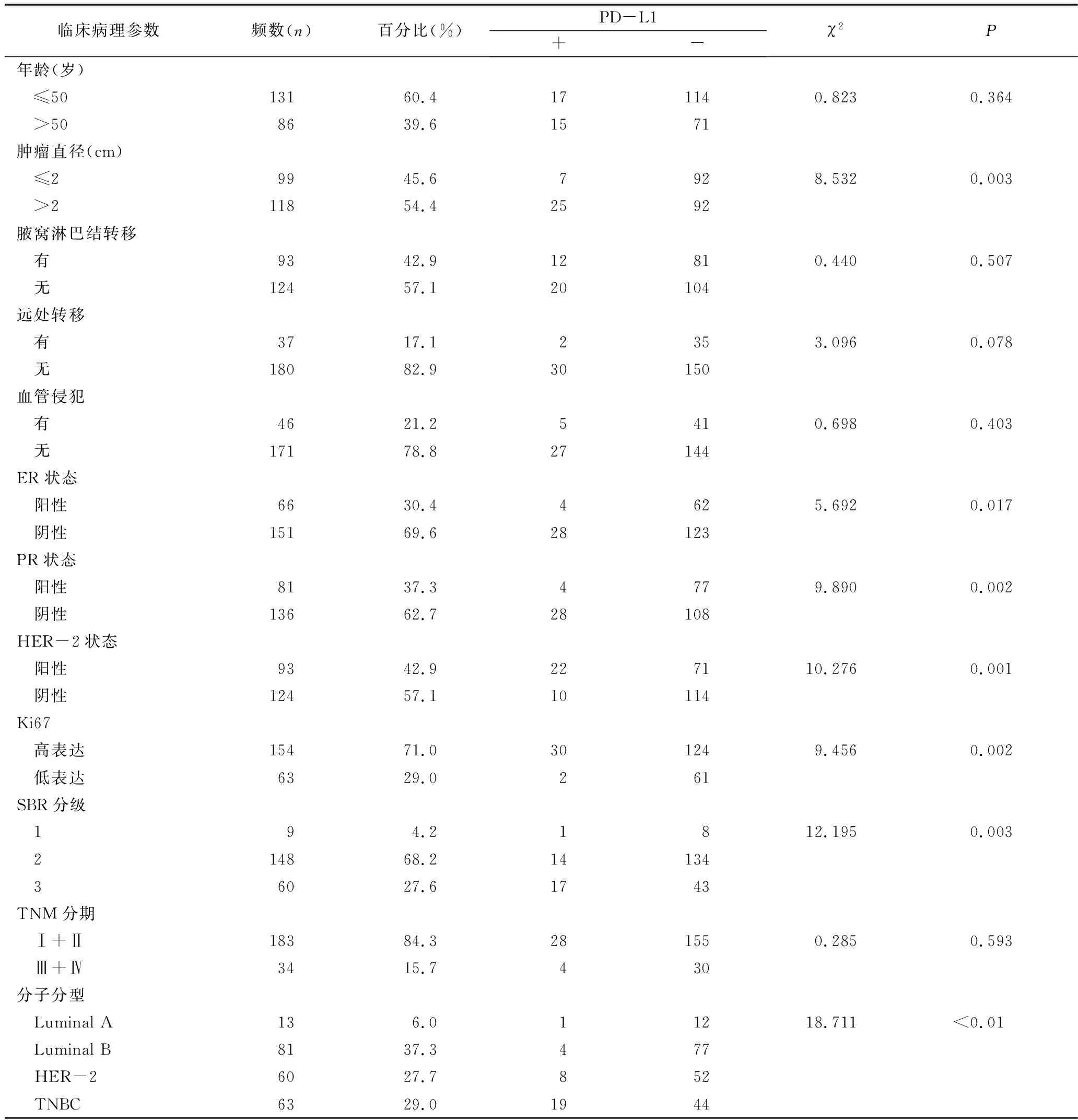
表1 PD-L1与217例乳腺癌临床病理参数的关系

图1 PD-L1在乳腺癌组织微阵列上的表达A.PD-L1在胎盘(阳性对照)中的表达(SP,×20);B.PD-L1在乳腺癌弱阳性表达(SP,×20);C.PD-L1在乳腺癌强阳性表达(SP,×40)
3.PD-L1表达与乳腺癌患者生存的关系:Kaplan-Meier结果显示,PD-L1阳性乳腺癌及TNBC患者的OS及DFS时间长于PD-L1阴性患者,但Log-Rank检验结果表明PD-L1表达与乳腺癌OS及DFS无关(OS:χ2=2.313,P=0.128;DFS:χ2=2.345,P=0.126,图2),而与TNBC患者更好的OS及DFS相关(OS:χ2=5.771,P=0.016;DFS:χ2=5.783,P=0.016,图3)。使用COX比例风险回归模型单变量分析结果显示,淋巴结转移与乳腺癌及TNBC患者的OS及DFS有关;ER、PR状态与乳腺癌患者OS及DFS有关,TNM分期与乳腺癌患者DFS有关,PD-L1与TNBC患者的OS及DFS有关(P<0.05),进一步进行COX比例风险回归模型多变量分析显示,PD-L1阳性仍然可作为判断TNBC患者预后的独立指标,PR状态是判断乳腺癌患者预后的独立指标,而淋巴结在乳腺癌及TNBC患者中均为独立的预后指标(表2~表5)。
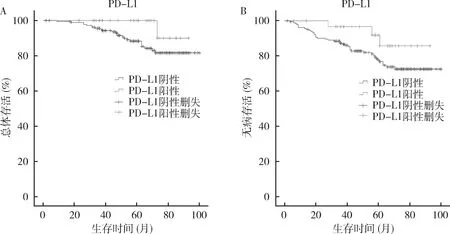
图2 乳腺癌患者预后的Kaplan-Meier曲线A.PD-L1阳性患者OS(P=0.128);B.PD-L1阳性患者的DFS(P=0.126)
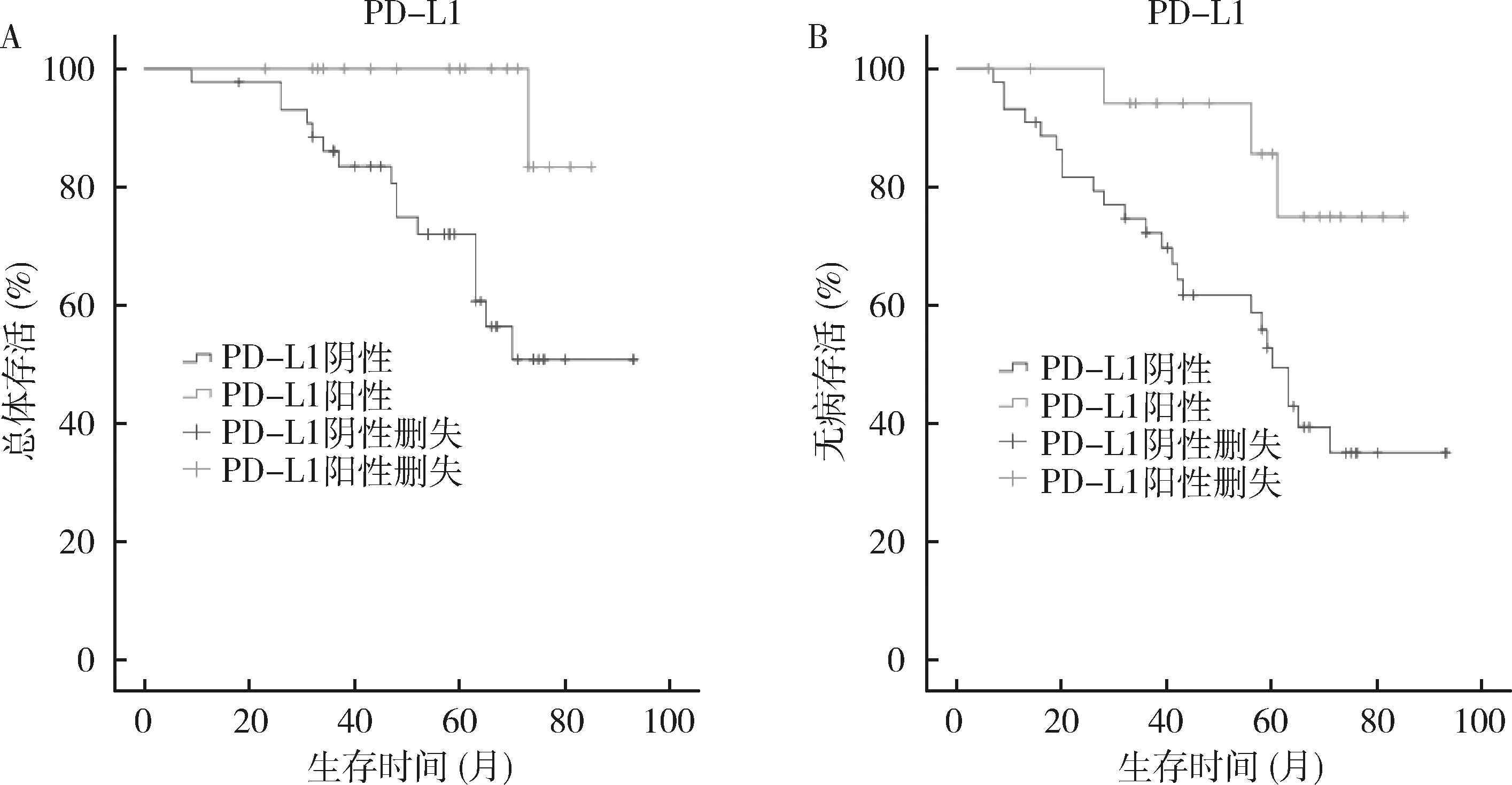
图3 TNBC患者预后的Kaplan-Meier曲线A.PD-L1阳性患者的OS(P=0.016);B.PD-L1阳性患者的DFS(P=0.016)
讨 论
PD-L1是I型跨膜蛋白,在小鼠和人抗原呈递细胞,非造血细胞和非淋巴器官如心脏、肺、胎盘和肝脏中组成型表达,并在多种恶性肿瘤微环境中上调,如结肠癌、卵巢癌、非小细胞肺癌和食管鳞状细胞癌[9~12]。PD-L1与PD-1相互作用,导致T细胞活化和增殖降低,抑制抗细胞凋亡分子Bcl-xl的表达和促进炎性细胞因子的产生,使癌症相关免疫细胞发生凋亡,减弱其免疫原性,从而抑制免疫应答,这种机制可以使癌细胞逃避宿主免疫系统监视,介导疾病进展[5,6]。
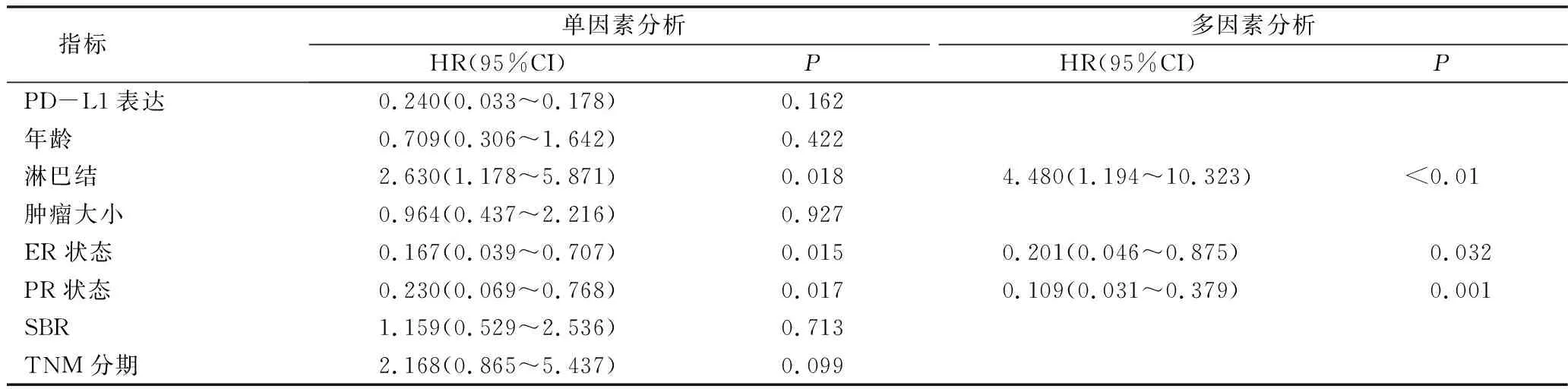
表2 乳腺癌OS单因素及多因素COX回归分析

表3 乳腺癌DFS单因素及多因素COX回归分析

表4 TNBC OS单因素及多因素COX回归分析
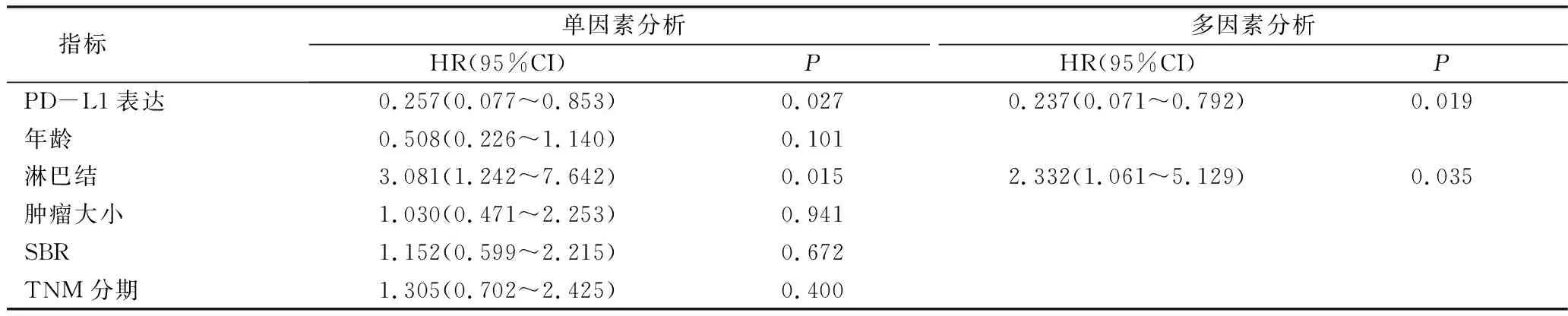
表5 TNBC DFS单因素及多因素COX回归分析
本研究中乳腺癌患者PD-L1的阳性率为14.7%,在TNBC中,PD-L1表达上调,阳性率为30.2%。与 Sabatier等[13]对乳腺癌患者的研究相似(PD-L1在乳腺癌中的阳性率为20.0%,TNBC亚型为38.0%)。同时,Meta分析表明,乳腺癌PD-L1阳性率在0%~83%,大多数研究结果显示PD-L1阳性率低于50%[13~16]。对于TNBC亚型PD-L1阳性率在5%~80%[16~18]。
本研究发现,PD-L1表达与肿瘤体积大、组织分化程度低、ER阴性、PR阴性、HER-2阳性、Ki67高表达及分子分型等预后不良病理特征相关,提示PD-L1是肿瘤侵袭性较高的指标。Bae等[14]研究发现乳腺癌PD-L1表达与组织分化程度低、无淋巴结转移、ER阴性、PR阴性、HER-2阳性及Ki67高表达相关。Qin等[15]发现PD-L1高表达与肿瘤体积大、血管侵犯、组织分化程度低、淋巴结转移以及ER阴性、PR阴性和HER-2阳性相关。此外,Chen等[12]在食管鳞状细胞癌的研究中发现,PD-L1表达并与肿瘤的部位、组织分化程度低、临床分期晚及淋巴结转移等相关,需要进一步研究其相关分子机制。与既往乳腺癌研究结果略有不同,笔者观察到PD-L1表达患者术后OS及DFS时间较无PD-L1表达的患者更长,但与患者OS及DFS无关。而在TNBC亚型,PD-L1表达与患者OS及DFS相关,且为其独立预后因素[14~17]。
此外,本研究发现,淋巴结转移为乳腺癌及TNBC亚型的独立预后指标,PR为乳腺癌的独立预后指标。鉴于PD-L1的免疫抑制功能,与本研究中PD-L1上调是独立的有利预后及预测因素似乎是矛盾的,生物学解释可能是PD-L1表达是强细胞毒性局部免疫反应的标志物,本身是一种有利的预后和预测特征,在其他肿瘤内也发现相似结果[10~12]。Chen等[12]研究发现,食管鳞状细胞癌PD-L1表达患者OS及DFS长于PD-L1阴性患者。PD-L1表达也与高级别浆液性癌及肺鳞癌更好的生存预后相关[10,11]。
在乳腺癌研究中,Tsang等[16]研究发现PD-L1表达既不与整体OS相关,也不与DFS相关;在TNBC亚型,PD-L1表达与患者OS和DFS相关。Qin等[15]研究发现PD-L1高表达与乳腺癌患者较差的DFS和OS有关,且PD-L1是其独立预后因素。Botti等[17]研究发现在TNBC亚型中PD-L1表达与DFS密切相关,但与OS无关。Sabatier等[13]发现PD-L1表达与TNBC患者OS及DFS相关。Bae等[14]研究发现乳腺癌PD-L1的表达与DFS和OS相关,但不是其独立的预后指标。这些研究结果的差异,通常是由于PD-L1 免疫组织化学染色结果的判断缺乏共识(如细胞膜与细胞质、染色强度、仅计数阳性肿瘤细胞或者还包括其他阳性细胞类型),以及个人对最佳阳性截点的定义和解释的主观性造成。另外,肿瘤组织分析方法的差异(研究采用全组织切片、TMA或活检标本)也会引起结果不同。Wimberly等[19]研究发现,同一乳腺癌患者的活检标本,PD-L1的表达在视野之间变化可达4倍。其他器官肿瘤也表现出肿瘤内异质性,例如肺癌之间的不一致性高达48%。在该领域的进一步研究,将有可能更好地理解PD-L1的表达及其对治疗易感性和预后的影响。
综上所述,PD-L1与乳腺癌的发生、发展及预后具有一定相关性,在TNBC亚型中,PD-L1表达是其独立的有利预后因素。根据PD-L1在肿瘤组织内的表达特征,笔者推测其可能与患者临床治疗疗效相关,并有可能指导未来的免疫治疗策略。然而,由于目前PD-L1结果判断尚无统一标准,故在PD-L1表达作为TNBC亚型可靠的生物学标志物之前仍有许多问题需要解决。

