ANCA相关性血管炎并发气胸患者的临床特点
王晓娜,张上珠,张国华,李 菁,李梦涛,田新平,曾小峰,彭琳一
ANCA 相关性血管炎(anti-neutrophil cytoplas-mic antibody associated vasculitis, AAV)常可累及呼吸系统,如:肉芽肿性多血管炎(granulomatosis with polyangiitis, GPA)表现为上下呼吸道的坏死性肉芽肿性炎症;显微镜下多血管炎(microscopic polyangiitis, MPA)表现为肺毛细血管炎;嗜酸性肉芽肿性多血管炎(eosinophilic granulomatosis with polyangiitis, EGPA)以哮喘为特征,可出现嗜酸性粒细胞性肺炎[1]。AAV继发气胸较罕见,曾有GPA并发气胸的报道,该类患者死亡率高,但危险因素及发病机制尚不清楚,缺乏改善预后的有效方法[2]。本研究对北京协和医院AAV并发气胸患者的临床特点进行回顾性分析,以期提高对该病的认识,做到早期发现及预防,改善该类患者的临床预后。
1 资料和方法
1.1 研究对象
检索北京协和医院2007年1月1日至2017年12月31日明确诊断为“ANCA相关性血管炎、韦格纳肉芽肿、肉芽肿性多血管炎、显微镜下血管炎、嗜酸性肉芽肿性多血管炎或Churg-Strauss综合征”并发“气胸、液气胸或脓气胸”的住院患者。AAV的诊断依据1990年版的美国风湿病协会分类标准和Chapel Hill共识会议标准。排除原发性气胸、创伤性气胸和其他因素所致的继发性自发性气胸(如慢性阻塞性肺疾病、肺部恶性肿瘤和矽肺等)。本研究通过北京协和医院伦理审查委员会批准(S-K607)。
1.2 研究方法
资料收集:回顾性采集AAV合并气胸患者的临床资料,包括一般信息、病史,红细胞沉降率(erythrocyte sedimentation rate,ESR)、超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)和抗中性粒细胞抗体谱等检验结果、影像学资料(胸部X线、胸部CT和胸部高分辨CT)、诊治情况和预后。
分组:AAV合并气胸的患者纳入气胸组,对照组随机选择北京协和医院同期住院的未并发气胸的AAV患者33例(GPA 15例,MPA 15例,AAV 3例),性别、年龄配比为1∶3。根据临床转归不同,将气胸组分为死亡组及存活组。
1.3 统计学方法
统计学分析采用SPSS 21.0软件 (version 21.0, Chicago, IL, USA)。定量资料进行正态性检验后发现不符合正态分布,故本研究定量资料用中位数(X25%, X75%)表示,定性资料用比例(百分比)表示。两组定量资料比较采用Mann-WhitneyU检验,两组定性资料比较采用Fisher精确检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
AAV并发气胸患者共11例,男6例,女5例;5例诊断为GPA,5例诊断为MPA,1例诊断为AAV。发病年龄为59(22, 70)岁,与对照组比较差异无统计学意义(表1,表2)。
2.2 临床表现
11例患者中9例为单纯气胸,1例表现为单侧包裹性液气胸,1例为脓气胸。11例患者发生气胸时AAV中位病程7(3,39)月,气胸中位病程12(6,24)d。
11例患者AAV的临床表现包括:发热(10例),鼻和鼻窦受累(4例),咳嗽、咳痰(6例),气短(4例),咯血(8例),关节肿痛(4例),皮疹(4例),眼部受累(2例),7例患者原发病累及肾脏,其中3例患者出现急性肾功能不全,与对照组比较均无统计学差异(表2)。
2.3 肺部影像学
11例气胸患者肺部影像的表现有空洞病变(5例),发生率明显高于对照组(P<0.05);多发结节、肿块(5例),肺间质病变(4例),与对照组相比均无统计学差异(表2)。其他肺部影像学表现有弥漫性支气管扩张(1例),胸腔积液(1例),双肺弥漫斑片影(1例)。
AAV:ANCA 相关性血管炎;GPA:肉芽肿性多血管炎;MPA:显微镜下多血管炎;MP:甲泼尼龙; Pred:泼尼松;CTX:环磷酰胺;IVIG:静脉注射人免疫球蛋白; po:口服;iv:静脉注射
续表1

患者ESR(mm/h)hs-CRP(mg/L)IF-ANCAPR3滴度MPO滴度气胸类型 气胸治疗 气胸转归 临床转归160>10C 1∶640>2000双侧气胸胸腔闭式引流无好转死亡2NDNDND036左侧气胸 胸腔闭式引流好转死亡316NDP 1∶20028右侧气胸胸腔闭式引流无好转死亡49066C 1∶40>2000右侧包裹性液气胸无好转好转51079.07C 1∶40>2000右侧气胸胸腔闭式引流无好转死亡65NDP 1∶1600>200左侧气胸胸腔闭式引流好转死亡71399.95C 1∶40>2000先为右侧气胸,18 d后出现左侧气胸胸腔闭式引流气胸反复发生死亡8ND132P 1∶40NDND 脓气胸胸腔闭式引流好转,遗留少量脓胸好转95110.54C 1∶10260右侧气胸胸腔闭式引流好转,局部多发包裹性气胸好转10NDNDC 1∶10270右侧气胸胸腔闭式引流好转好转113048.71P 1∶20057左侧气胸胸腔闭式引流,胸腔内注射50%葡萄糖200 ml无好转死亡
ESR:红细胞沉降率;hs-CRP:超敏C反应蛋白;IF-ANCA:抗中性粒细胞胞浆抗体(IgG型); PR3:抗蛋白酶3抗体(IgG型);MPO:抗髓过氧化物酶抗体(IgG型);ND:无记录或未查
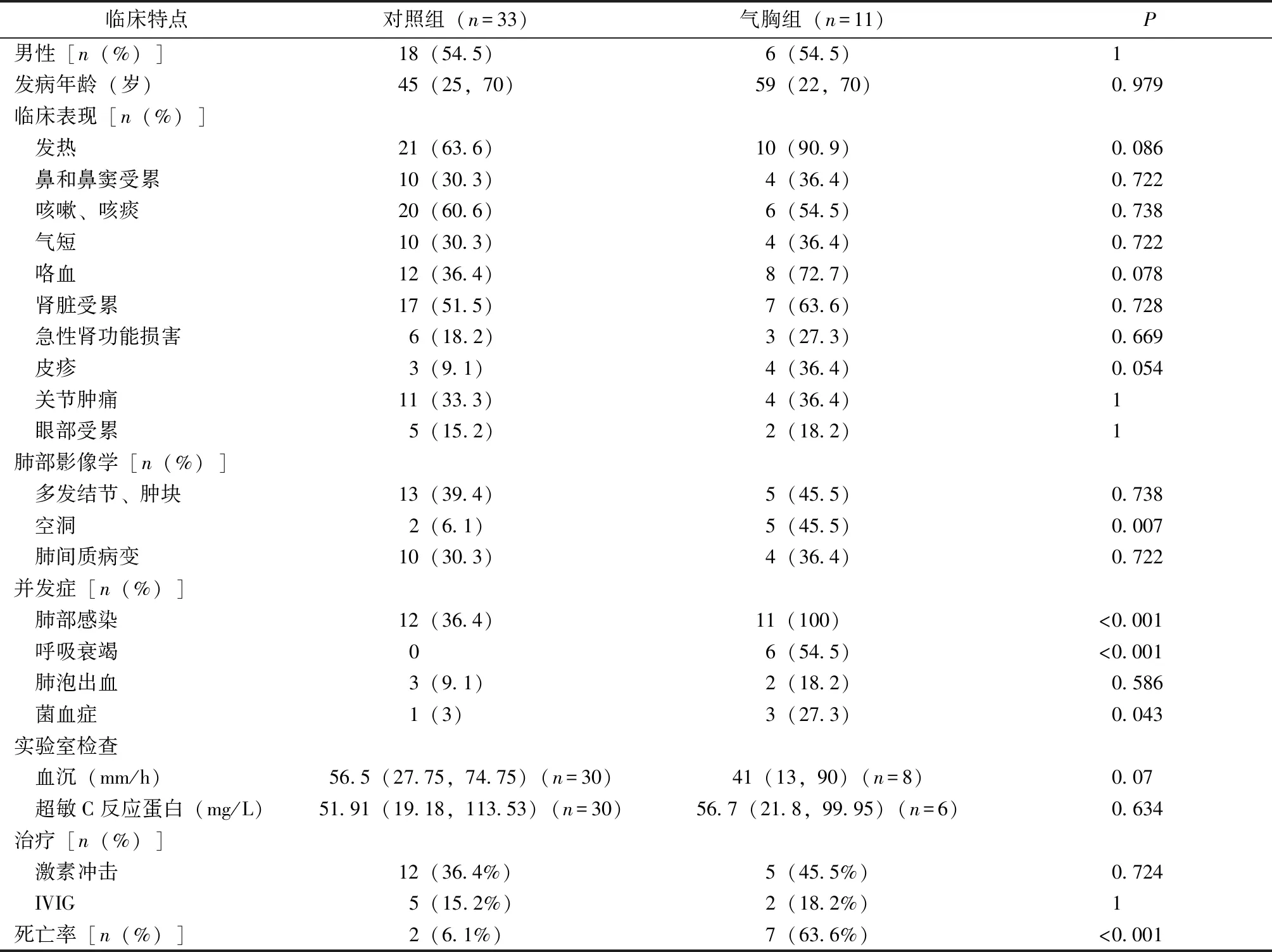
表2 气胸组与对照组临床表现、辅助检查与治疗情况比较Table 2 Comparison of clinical features, auxiliary examination and treatment of pneumothorax group and control group
IVIG:静脉注射人免疫球蛋白
2.4 实验室检查
气胸组患者发生气胸前ESR为41(13,90)mm/h, hs-CRP为56.7(21.8, 99.95)mg/L,与对照组比较均无统计学差异。
2.5 并发症
11例患者在气胸前均并发肺部感染,肺部感染的发生率明显高于对照组(P<0.05)。气胸组患者呼吸道病原学回报有念珠菌4例,曲霉菌2例,鲍曼不动杆菌3例,嗜肺军团菌、阴沟肠杆菌、铜绿假单胞菌、耐甲氧西林金黄色葡萄球菌、肠球菌、人肺孢子菌各1例。
气胸组3例并发菌血症,发生率明显高于对照组(P<0.05),3例血培养均回报鲍曼不动杆菌感染、其中1例血培养回报屎肠球菌。
气胸组6例患者在气胸前并发呼吸衰竭并行机械通气治疗,气胸组呼吸衰竭的发生率明显高于对照组(P<0.05)。
气胸组2例患者并发肺泡出血,与对照组比较差异无统计学意义。
2.6 治疗及预后
气胸治疗方面,10例患者进行了胸腔闭式引流,其中5例气胸没有得到控制;1例患者在胸腔闭式引流的基础上胸腔内注射50%葡萄糖,但气胸仍未得到控制。1例患者因气胸量少未行胸腔闭式引流,仅予鼻导管吸氧治疗,该患者的气胸自行好转。
原发病方面,气胸发生前有7例患者出现了原发病活动,予糖皮质激素冲击(5例)、激素加量(3例)和人血免疫球蛋白(2例)等治疗,与对照组相比无统计学差异,1例患者加用了环磷酰胺冲击治疗。其他4例患者无原发病活动证据,继续维持中小剂量激素和/或免疫抑制剂治疗。
气胸患者死亡率显著高于对照组(P<0.05)。11例患者中7例死亡,3例因肺部感染、感染性休克死亡,2例因突发气胸导致呼吸衰竭加重死亡,1例并发肺内空洞并因大咯血死亡,1例因血小板下降后颅内出血死亡。
11例气胸患者中,死亡组与存活组患者的性别比例无明显差异,死亡组患者的发病年龄较大,AAV和气胸病程较短,MPA患者较多,气胸类型以单纯气胸为主,并未发现与存活组存在统计学差异。死亡组患者菌血症、呼吸衰竭、肺泡出血的发生率较高,呼吸衰竭的发生率与存活组存在明显的统计学差异(P<0.05)。死亡组71.4%的患者出现原发病的活动,且原发病、气胸和肺部感染的控制情况较存活组差(表3)。
3 讨论
AAV肺部受累较常见,但AAV患者出现气胸却较罕见,目前仅有GPA并发气胸的个案报道[2],但并无MPA和/或EGPA并发气胸的病例报道,这类患者的临床特点及预后也尚不清楚。本研究收集了近10年在北京协和医院住院的AAV患者,其中主要是GPA和MPA患者,而且发现MPA并发气胸者的病情较GPA并发气胸者更加严重、预后也较差。
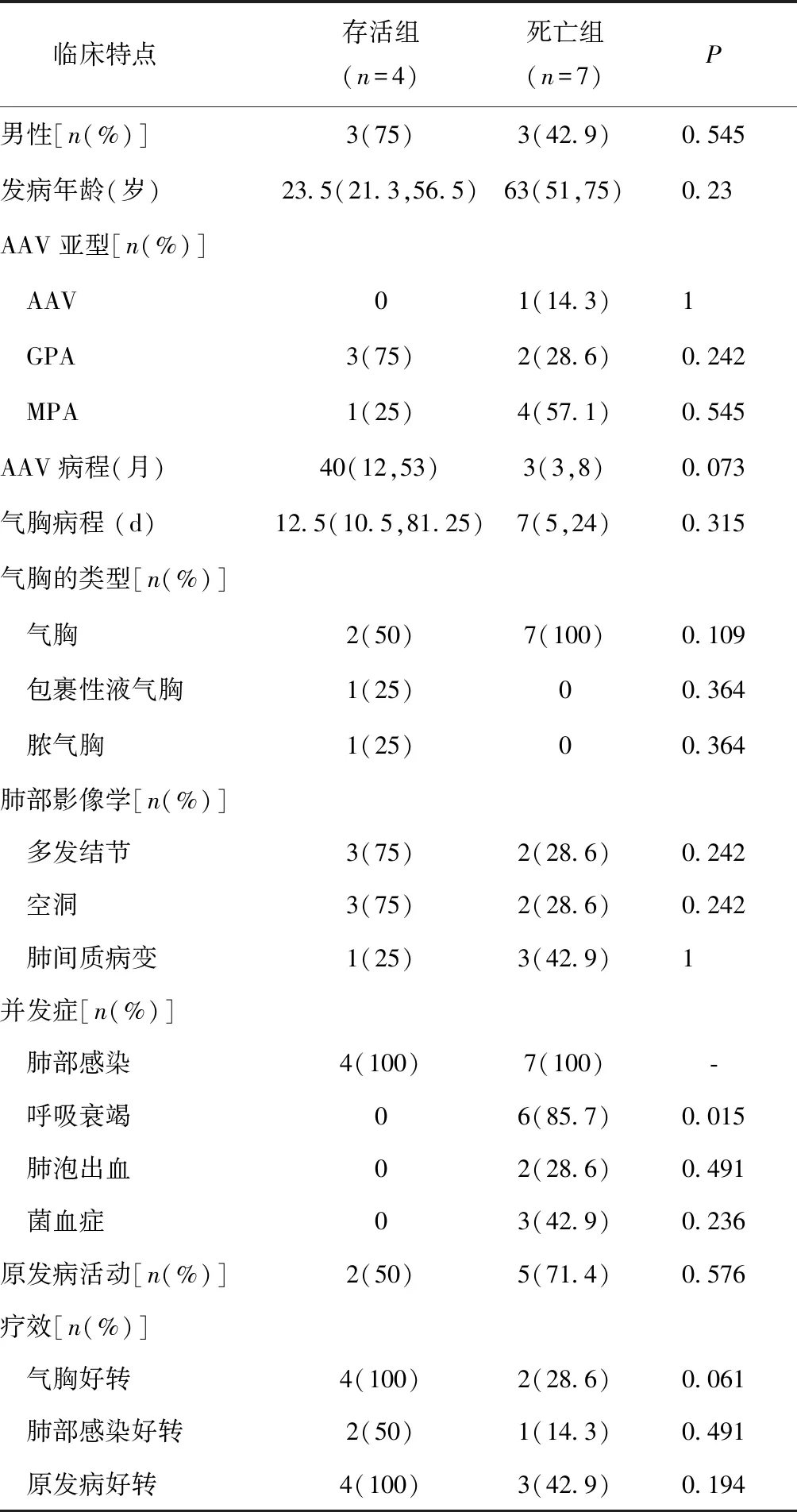
表3 死亡组和存活组临床表现、辅助检查与治疗情况比较Table 3 Comparison of clinical features, auxiliary examina-tion and treatment of death group and survival group
AAV:ANCA相关性血管炎; GPA:肉芽肿性多血管炎; MPA:显微镜下多血管炎
AAV患者发生气胸的原因较多,文献报道邻近胸膜的肺结节或空洞破裂是GPA患者出现气胸的主要原因[3-4],本研究也发现气胸组患者肺空洞发生率明显高于对照组。本研究3例GPA患者的气胸侧与肺空洞病变侧一致,1例GPA患者存在双肺结节和右侧空洞病变,先出现右侧气胸,后出现左侧气胸;1例GPA患者存在双肺结节、左上肺空洞、右上肺邻近胸膜团块影,患者出现了右侧气胸,故推测邻近胸膜的结节和空洞破裂很可能是GPA患者出现气胸的原因。Jaspan等[5]发现GPA患者呼吸道及胸腔内病原学是一致的,提出空洞继发感染者更容易出现气胸,本研究中1例脓气胸MPA患者的痰病原学和胸腔病原学是一致的,且本研究11例AAV患者肺部感染的发生率明显高于对照组(P<0.05),这也证明肺部感染会增加AAV患者气胸的风险。也有文献提出支气管胸膜瘘可能是GPA患者出现气胸的原因[6-7],本研究中1例MPA患者也曾怀疑支气管胸膜瘘相关的气胸,但未进一步检查验证。原发病累及胸膜也可能是GPA患者出现气胸的原因[8-9],本研究中1例MPA患者在病程初期表现为左侧胸腔积液,后出现了左侧气胸,但因该患者同时并发肺间质病变和肺部感染,故无法进一步证实该患者的气胸是否为胸膜受累的表现。本研究气胸组患者气胸发生时ESR、hs-CRP和PR3(或MPO)的水平均较高,提示存在病情的活动,但与对照组比较并无统计学差异,故尚不能证实原发病活动、机体炎症状态与气胸发生的直接关系。
AAV患者的气胸较难控制。首先本研究发现死亡组胸腔闭式引流+置管术对气胸的控制率较存活组低(28.6%vs. 100%,P=0.061);高渗葡萄糖是一种高效的硬化剂,可有效刺激胸膜脏层与壁层胸膜黏连继而闭合,既往文献报道对于继发性自发性气胸的效果较好[10],本研究中有1例患者在胸腔闭室引流置管术疗效不佳的基础上胸腔内灌注高渗葡萄糖,但疗效并不显著。由此可见,AAV患者的气胸有时很难控制,这必然会对患者的心肺功能产生影响,进而影响预后。
本研究AAV并发气胸患者的死亡率为63.9%,明显高于对照组(P<0.05)。本研究报道的首位死亡原因是肺部感染、感染性休克,突发气胸导致呼吸衰竭加重是死亡的第二位原因。本研究发现并发呼吸衰竭的AAV患者如出现气胸,死亡率会明显升高,这与气胸患者的机械通气治疗困难有关。通过对比死亡组和存活组的其他临床信息,虽因样本量过少未发现具有统计学意义的危险因素,但发现死亡组患者以中老年为主,出现肺间质病变的MPA患者结局较GPA患者差,尤其是并发呼吸衰竭、肺部感染及菌血症时。本研究还发现存活组的气胸病程较长,这也提示AAV患者并发气胸较难控制,完全吸收需较长的时间。
GPA并发气胸和肺部感染时激素免疫抑制剂的方案调整存在争论[11-12],本研究11例气胸AAV患者在气胸前7例出现了原发病的活动,死亡组患者中气胸前原发病活动(或加重)较非死亡组更常见,原发病的控制情况也不佳,故针对AAV并发气胸及感染,建议在抗感染、胸腔闭式引流+置管等的支持治疗下,积极治疗原发病。
EGPA患者肺部CT表现以磨玻璃影、微结节、结节、肿块为主,但很少伴空洞形成[13-14],肺间质病变也较少见[15]。EGPA可累及胸膜,常表现为嗜酸性粒细胞性胸腔积液[14]。尚无EGPA并发气胸的报道,本研究也未发现EGPA并发气胸的患者。

