多发性肌炎/皮肌炎患者外周血Ⅰ型干扰素诱导趋化因子的临床意义
郑小蔚,陈小青,李秋兰,黄小兰,苏慧华,林 玲
多发性肌炎/皮肌炎(polymyositis/dermatomyositis,PM/DM)是一组异质性皮肤/肌肉炎症为主的自身免疫性疾病,病因及发病机制目前尚不清楚。研究显示:Ⅰ型干扰素通路异常激活对其可能起到关键作用[1-3]。本研究采用实时定量PCR检测PM/DM患者PBMCs中5个经典的Ⅰ型干扰素诱导趋化因子基因(MCP-1、IP-10、 I-TAC、MCP-2、 MIP-1α)的mRNA表达量,将其整合后分别计算趋化因子积分,探讨Ⅰ型干扰素通路活化与PM/DM临床表型的关系。
1 资料与方法
1.1 临床资料
PM/DM组52例(PM24例,DM28例),来自福建医科大学附属第二医院免疫内科2011年1月至2014年1月的门诊和住院患者,其中女性36例,男性16例,年龄20~74岁,平均(47±15)岁,其中有45例随访半年以上,6例收集了治疗前后的标本,所有患者均符合2004年国际肌病协作组建议的PM/DM分类诊断标准。本研究根据临床表现、肺功能及胸部高分辨率CT明确肺间质病变的存在,并排除其他可能引起类似肺间质病变表现的病因,包括感染等。肺间质病变的诊断依据影像学表现分型[4]。健康对照组(health donors,HD)20名,其中女性14名,男性6名,年龄29~78岁,平均(45±14)岁,来自本院健康体检人群。PM/DM组与HD组性别﹑年龄构成上差异无统计学意义,并取得受试对象的知情同意。
1.2 主要仪器和试剂
NanoVue核酸定量仪(GE Healthcare公司),实时定量PCR仪ABI PRISM 7500型(美国ABI公司),低温高速离心机Allegra 64R Centrifuge(美国Beckman Coulter公司), Trizol试剂(美国Invitrogen公司),淋巴细胞分离液(法国biowest公司),SuperscriptⅡ反转录试剂盒(日本Takara公司),SYBR green PCR试剂盒(日本Takara公司)。
1.3 实验方法
1.3.1 分离PBMCs:安静状态下抽取静脉血8 ml入肝素抗凝管中,采用密度梯度分离法,分离PBMCs。
1.3.2 总RNA抽提和反转录:收集分离后的PBMCs,加1 ml Trizol试剂,振荡混匀,室温放置5 min;加入200 μl氯仿,剧烈振荡15 s;室温孵育2~3 min;4 ℃ 12 000 g离心15 min,将上清液移至焦磷酸二乙酯(DEPC)处理的Eppendorf管;加500 μl异丙醇,混匀,室温静置10 min;4 ℃ 12 000 g离心15 min,弃上清;加75%乙醇1 ml洗涤RNA,旋涡混匀;4 ℃ 7 500 g离心5 min,真空干燥5~10 min;以含1‰DEPC处理的无菌双蒸水溶解RNA,DU 800核酸定量仪检测RNA纯度和浓度,A260/A280>1.8。所得RNA -80 ℃保存。抽提总RNA并鉴定RNA的质量和完整性,定量后以1 μg RNA为模板进行反转录。反应体系总体积20 μl,42 ℃ 2 min, 37 ℃ 15 min 85 ℃ 5 sec,4 ℃ 7 min合成第一链cDNA。RNA和cDNA均置于-70 ℃冰箱保存备用。
1.3.3 扩增引物设计:以核糖体蛋白L13a(RPL13A)为内参照基因,检索NCBI数据库获得目的基因MCP-1、IP-10, I-TAC、MCP-2、MIP-1α的cDNA全长序列,Oligo 6设计相应引物,由上海生工生物工程有限公司合成。具体引物序列见表1。

表1 目的基因引物序列Table 1 Target gene primer sequence
1.3.4 SYBR green dye I 实时定量PCR反应:SPSS13.0统计软件包软件分析结果。各样本以RPL13A基因进行标化,计算目的基因的△ct值。以HD组标本为参照,计算各组样本中各目的基因的相对表达量。
1.3.5 趋化因子积分的计算: 参考文献[5]的计算方法。简要如下:计算HD组每一目的基因表达水平的平均值(Mean HD)及标准差(SD HD),根据以下公式计算PM/DM组相应目的基因的标准化表达水平(S),其中GenePM/DM 表示一个PM/DM患者某一特定基因的相对表达水平。将每个样本6个目的基因的S值相加,则得到该样本的趋化因子积分。采用上述方法分别计算PM/DM组和HD组各样本的趋化因子积分。
S=GenePM/DM - GeneMean HD /SD (GeneHD)
1.4 统计学处理
采用SPSS22.0统计软件进行分析。实验数据呈非正态分布,采用中位数(第25百分位数,第75百分位数)[M(P25,P75)]表示,组间比较采用Mann-Whitney检验;相关性分析采用Spearman相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 Ⅰ型干扰素诱导趋化因子基因在各组表达水平的比较
PM/DM组PBMCs中MCP-1、IP-10、I-TAC、MCP-2及MIP-1α的表达均较HD组显著增高,差异有统计学意义(P<0.01)(表2)。
2.2 趋化因子积分在各组水平的比较
将MCP-1、IP-10、 I-TAC、MCP-2、MIP-1α的表达量整合后计算出趋化因子积分。结果显示PM/DM组趋化因子积分[48.4(25.4,144.7)]较HD组[2.2(0.6,4.0)]显著增高,差异有统计学意义(Z=-5.630,P< 0.01)。
2.3 不同肌炎组干扰素诱导趋化因子基因的表达
PM/DM组分为PM组与DM组,其中PM组24例,DM组28例。与HD组比较,PM组与DM组MCP-1、IP-10、 I-TAC、MCP-2及MIP-1α的表达水平显著增高(P< 0.01)(表2)。而DM组上述6个干扰素诱导趋化因子基因表达水平与PM组相比,差异无统计学意义(P>0.05)(表2)。趋化因子积分在PM组[67.6(27.4,447.7)]与DM组[54.7(36.7,180.2)]均较HD组[2.2(0.6,4.0)]显著增高(Z=3.308和Z=-5.152,P<0.01)。
2.4 趋化因子积分与PM/DM疾病活动度相关性
采用肌炎活动性评价工具(myositisdisease activity assessmenttool,MDAAT),以其中的肌炎疾病活动性评估视觉模拟量表评分(myositis disease activity assessment visual analogue scale,MYOACT)-总活动度评分评价患者疾病活动性。同一患者,与稳定期[15.2(5.5,70.6)]相比,处于疾病活动期的趋化因子积分显著升高[181.5(108.8,417.9)],差异有统计学意义(Z=-1.851,P<0.05)(图1)。MDAAT疾病总活动度:MDAAT[治疗前(8.3±1.5);治疗后(1.3±1.2),P<0.05](图2),与此同时,趋化因子积分与MDAAT疾病总活动度也呈正相关(r=0.915,P<0.05)(图3)。
2.5 ANA抗体阳性组患者趋化因子积分显著升高
在PM/DM患者组中,ANA抗体阳性组30例,ANA抗体阴性组22例, ANA抗体阳性组趋化因子积分[181.4(33.3,964.8)]较ANA抗体阴性组[46.2(25.7,70.4)]显著升高,差异有统计学意义(Z=-2.523,P<0.05)。

表2 干扰素趋化因子诱导基因在PM/DM、PM﹑DM及HD组的相对表达水平[M(P25,P7)]Table 2 Relative expression levels of interferon chemokine inducible genes in PM/DM, PM, DM and HD groups [M(P25,P7)]
aPM/DM与HD组比较;bPM与HD组比较;cDM与HD组比较;dDM组与PM组比较;*P<0.0 1

图 1 活动期与稳定期趋化因子积分比较Fig 1 Comparison of chemokine integrals between active phase and stationary phase
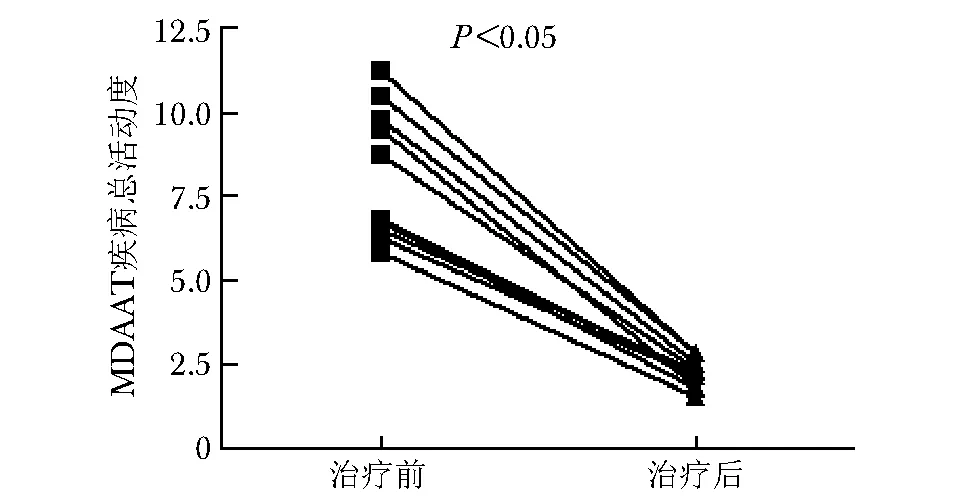
图 2 治疗前与治疗后MDAAT疾病总活动度比较Fig 2 Comparison of total disease activity of MDAAT before and after treatment
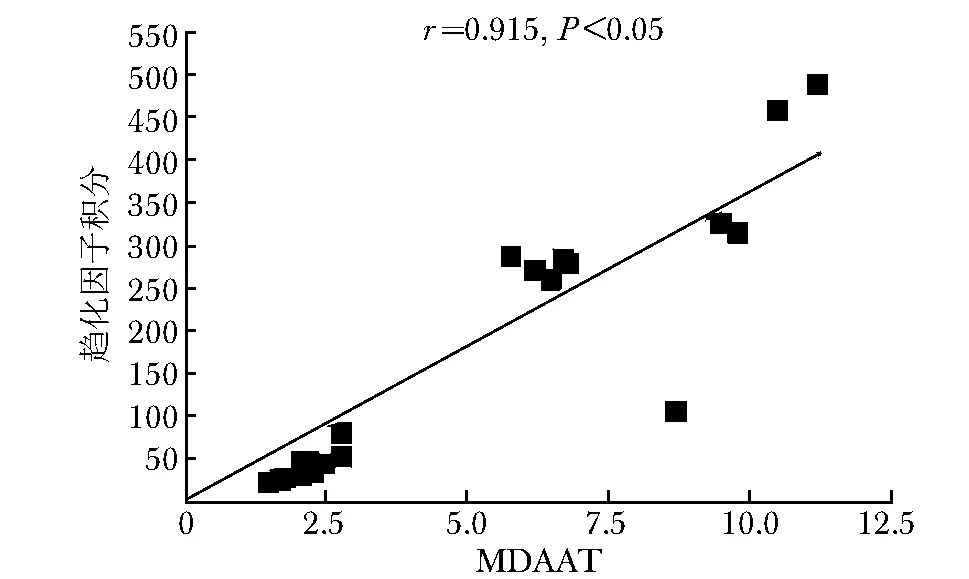
图 3 MDAAT与趋化因子积分的相关性Fig 3 Integral correlation of MDAAT and chemokines
2.6 抗Jo-1阳性患者趋化因子积分显著升高
抗Jo-1阳性组11例,抗Jo-1阴性组41例,与抗Jo-1阴性组[51.3(25.4,151.1)]相比,抗Jo-1阳性组趋化因子积分[153.6(67.3,218.3])显著升高,差异有统计学意义(Z=-0.236,P<0.05)。
2.7 肺间质病变组与非肺间质病变组趋化因子积分无明显差异
在PM/DM患者中,肺间质病变组18例,非肺间质病变组34例,肺间质病变组趋化因子积分[62.3(28.3,161.3)]与非肺间质病变组[51.3(26.4,151.5)]比较差异无统计学意义(Z=-0.761,P=0.447)。
2.8 趋化因子积分与PM/DM其他临床特征的关系
在PM/DM患者组中,趋化因子积分与CK(P>0.05,r=-0.189)、LDH(P>0.05,r=-0.214)、AST(P>0.05,r=-0.517)、ALT(P>0.05,r=-0.211)均无明显相关性。
3 讨论
近年来,针对自身免疫性疾病致病机制研究中,特别是在特发性炎性肌病(Idiopathic inflammatory myopathy,IIM)发病机制中,Ⅰ型干扰素通路的研究为目前研究热点[6-8]。干扰素通路包括Ⅰ型干扰素诱导物、Ⅰ型干扰素、Ⅰ型干扰素信号通路、调控Ⅰ型干扰素表达的分子、Ⅰ型干扰素诱导的基因及蛋白、以及受Ⅰ型干扰素调节的细胞因子和趋化因子等。本课题组先前研究显示PM/DM组患者Ⅰ型干扰素诱导基因OAS-1﹑IFIT1﹑IFIT4﹑IFI44﹑RSAD2及MX-1的mRNA水平均明显高于健康对照组,提示Ⅰ型干扰素通路参与炎症性肌病的发病[9]。在此基础上,本研究进一步探索Ⅰ型干扰素调节的趋化因子是否参与了PM/DM的发病。
有报道 IIM 患者的血清MCP-1和MIP-1α表达升高[10-11]。Sanner等[12]对54例少年皮肌炎(junior dermatomyositis,JDM)患者确诊后随访治疗平均16.8年,并与54例性别和年龄相匹配的健康对照组相比较,血清嗜酸性粒细胞趋化因子(eotaxin)﹑MCP-1及IP-10水平在JDM患者显著升高(31.5%,37.2%,43.2%,P<0.05), eotaxin及MCP-1表达水平与患者年龄及疾病病程有正相关(r=0.47及r=0.64,P<0.001),且可能作为提示疾病早期的重要参数,随访发现MCP-1高表达与患者器官损伤程度显着相关。多篇报道研究显示IL- 6、 IL-10、IL-15、IL-17、MCP-1、MCP-2、MCP-4、I-TAC/CXCR1-3、 MIP-1α和MIP-1β参与T细胞调控[13-17]。有研究显示Th1细胞经由干扰素诱导蛋白10(IP-10)和CXCR3相互作用能使DM发生皮肤病变[18]。趋化因子和细胞因子在DM患者局部组织表达上调,与MHC-I类上调是平行的,与募集特定的T细胞至靶组织有关[19]。DM患者受累皮肤[20-22]或肌肉[2,18,22]检测到Ⅰ型干扰素趋化因子及其配体:包括MIG/CXCL9﹑IP10/CXCL10﹑I-TAC/CXCL11,这可能与Ⅰ型干扰素募集淋巴细胞至炎性病灶有关。上述研究提示PM/DM患者可能存在Ⅰ型干扰素通路异常活化,Ⅰ型干扰素诱导的趋化因子参与了疾病的发生及进展。
目前国内尚缺乏这方面的研究,为较全面反映该通路的活化状态,在高通量基因芯片等国外最新研究结果的基础上,本研究选择5个具有代表性的干扰素诱导趋化因子基因,采用实时定量PCR的方法分别检测其表达水平,并将其整合后计算出趋化因子积分,探讨趋化因子积分与PM/DM疾病活动度及临床特征的相关性。结果发现:与HD组相比,干扰素诱导趋化因子及趋化因子积分在PM/DM患者中显著增高,这与近年来国外研究发现PM/DM患者外周血与肌肉活检标本中出现高表达IFN诱导趋化因子基因的结果[23-24]相符。Bilgic等[24]对56例DM患者检测外周血计算基于I-TAC、IP-10、MCP-1及MCP-2计算得出干扰素趋化因子积分和血清IL-6的高表达,研究发现DM患者中IL-6与干扰素趋化因子积分和疾病的活动度有很强相关性,提示IL-6介导的Ⅰ型干扰素通路可能参与DM致病,监测这些通路中的失调将有助于指导诊断和治疗。
Reed等[23]研究发现在JDM及DM患者中Ⅰ型干扰素积分(基于IFIT1、GIP-2及IRF7计算得出)显著增加,且与疾病的活动性正相关(r=0.33,P=0.023),治疗前后对比,研究结果显示JDM及DM患者在受累肌肉组织及外周血细胞同时存在多种趋化因子(I-TAC、IP-10及MCP-1)表达上调,且干扰素趋化因子积分与疾病活动性相关(r=0.53,P<0.001)[12,24-25]。近年来,除血清肌酶水平外,MDAAT可用于评价疾病的活动性[2,26-27],但实际上MDAAT测定较为繁琐,临床实践中缺乏可行性。本研究显示同一患者,与稳定期相比,疾病活动期的趋化因子积分显著升高(P<0.05)。且趋化因子积分与MDAAT疾病总活动度相关,提示Ⅰ型干扰素通路的激活与PM/DM的疾病活动密切相关,趋化因子积分较好地反映PM/DM患者疾病的活动度。
本研究未发现趋化因子积分与肌酶相关性,可能与以下原因相关:(1)该研究纳入的样本例数不足;(2)当血清中存在肌肉严重萎缩或肌酶抑制物时,也可能出现肌病患者肌酶水平增高不明显的情况。(3)研究表明CK在反映慢性炎症性肌病的疾病活动性方面敏感性不如病程短的急性起病者。
Gono等[26]对38例PM/DM患者外周血清研究发现IL-6、IL-8、TNF-α及IP-10表达显著增加,且在肺间质病变组表达明显高于非肺间质病变组,并在治疗后降低。本研究肺间质病变组趋化因子积分[62.3(28.3,161.3)]较非肺间质病变组[51.3(26.4,151.5)]无显著升高,差异无统计学意义(Z=-0.761,P=0.447),可能与选择的指标及病例不同肺间质病变类型不同有关。
本研究显示ANA抗体阳性组以及抗Jo-1抗体阳性组患者均较抗体阴性者趋化因子积分明显升高,提示干扰素通路活化可能与某些自身抗体的出现有关。Ⅰ型干扰素可诱导正常的单核细胞向活化的树突状细胞(DC)分化[24],活化的DC可将自身抗原向T细胞提呈,能够诱导自身反应性T、B细胞活化,最终导致自身免疫。Ⅰ型干扰素还可促进CD8+效应性T细胞的分化和存活;增强B细胞向浆细胞的分化,从而增加自身抗体的产生[14],这些环节都在PM/DM的发病机制中起到关键作用。另外我院除了抗Jo-1抗体以外,其他肌炎特异性自身抗体检测需外送进行。因此本研究纳入的患者,仅部分能够完成肌炎16项自身抗体谱检查,尚不足以进行统计学分析其他肌炎抗体与趋化因子积分的相关性,此为本研究的局限性。
西法木单抗(sifalimumab)是anti-IFN-α单克隆抗体。Guo等[28]纳入48例DM和PM患者进行了西法木单抗Ⅰb期临床试验,该研究为多中心、随机、双盲、安慰剂对照研究。在治疗前后通过免疫组化、实时定量PCR以及血清蛋白多重检测法观察肌肉和外周血的13种IFIG水平的变化,结果显示在治疗98天后的血清MCP-1和MCP-2水平分别被抑制74.9%和81.2%,血清IL - 2ra,IL- 18,TNFR2和BAFF水平均有不同程度的降低降低,肌肉组织中发现其有显著性T细胞浸润的减少,该研究为IIM患者Ⅰ型干扰素通路的干预治疗预示了良好前景。
综上,本研究测定了5个Ⅰ型干扰素诱导趋化因子基因的相对表达量,得到了趋化因子积分,能够较好反映Ⅰ型干扰素活性,对趋化因子积分和临床表型进行相关性分析,发现与PM/DM活动及自身抗体的产生密切相关,有助于了解PM/DM患者Ⅰ型干扰素通路活化状态,为临床医师评估其疾病活动性和预后提供了较好的指标,也为将来Ⅰ型干扰素通路干预治疗提供了新的证据。

