病理大切片结合人工智能在胰腺肿瘤诊疗中的应用前景
蒋慧 边云 郑建明
1海军军医大学附属长海医院病理科,上海 200433;2海军军医大学附属长海医院医学影像科,上海 200433
【提要】 病理大切片能够整体、全面地将肿瘤及肿瘤周围组织完整地呈现在一张切片上,有利于对肿瘤及其周围微环境进行全面观察和评估,提高对疾病的全面认识。随着数字化病理的逐步实现及计算病理的进步,利用人工智能将病理大切片中不同肿瘤细胞的形态和周围微环境的病理组织形态与各种不同类型的数据包括影像组学、基因蛋白组学、临床诊疗数据等联系起来,更好地实现胰腺肿瘤的精准及个体化诊疗,这对我国科研工作者来说既是机遇也是挑战。
病理学是胰腺肿瘤诊疗中的一门重要学科。病理图像上呈现的肿瘤真实世界不仅包括肿瘤细胞本身,也包括肿瘤间质、免疫微环境及其周围背景病理等[1-2],所有这些因素对肿瘤的诊断、治疗及预后判断都至关重要。在过去的10年间,包括基因高通量测序、转录组学、蛋白质组学和临床信息在内的大量跨组学数据的聚合,使得研究人员能够识别与肿瘤发展相关的基因突变和基因表达特征[3-6]。但肿瘤的异质性特征使人们忽视了从肿瘤局部取样得出的基因组学数据[7],且通过组织研磨进行分析的结果可能会失去对肿瘤间质反应和肿瘤免疫微环境的理解[8-9]。随着全载玻片成像扫描(whole slide imaging,WSI)技术的出现,病理图像正逐步实现数字化,在此基础上产生的计算病理(computational pathology,CP)和大量拥有分子和组织病理学数据的肿瘤样本的积累,使研究人员可以研究肿瘤的形态学特征与各种组学数据间的关系,从而弥补由于肿瘤异质性导致的对肿瘤局部活检样本作出的基因组学信息评估不足的缺陷,为实现肿瘤的精准医疗奠定基础[10-11]。
目前计算病理的研究主要集中于组织芯片及传统小切片上,它的缺点在于无法对肿瘤及其周围背景病理进行全面的认识和剖析。而病理大切片技术的应用可以解决这一问题,其最大优势是能够整体、全面地将肿瘤及其周围组织完整展现在一张切片上,有利于对肿瘤及周围微环境的全面观察与评估,并可与影像图像进行比对,提高对疾病的全面认识。近年来笔者所在长海医院胰腺疾病MDT诊疗团队在全国率先开展胰腺肿瘤的大组织取材并实现大组织切片的数字化。这一技术的开展有助于全面地观察胰腺肿瘤的全貌及其毗邻关系、肿瘤的分布、生长方式等,从而加深对肿瘤及其背景病理的认识。同时病理大切片有利于与影像图像进行比对,提高了对疾病的全面及本质认识。目前最大的机遇也是挑战的是利用人工智能(artificial intelligence,AI)将大切片中不同肿瘤细胞的形态和周围微环境的病理组织形态与各种不同类型的数据包括影像组学、基因蛋白组学、临床诊疗数据等联系起来,对肿瘤作出精准的诊断、治疗和预后判断。
一、人工智能在胰腺肿瘤苏木精-伊红染色图像分析中的应用前景
病理医师的诊断工作主要依赖于肿瘤组织的苏木精-伊红(hematoxylin-eosin, HE)染色图像,其显示的肿瘤形态学特征被广泛应用于诊断和预后评估。胰腺恶性肿瘤中约90%为导管腺癌及其亚型,除了普通的导管腺癌(not otherwise specified, NOS),还可根据组织形态分出7个亚型:腺鳞癌、胶样癌、印戒细胞癌、未分化癌、伴破骨样巨细胞的未分化癌、髓样癌、肝样癌;而最新2019年第5版WHO消化系统肿瘤分类[12]中又增加了侵袭性微乳头状癌亚型;另外还有很多尚未单列出却已被认识的亚型(图1)。近几年备受关注的胰腺无功能性神经内分泌肿瘤在2019年第5版WHO消化系统肿瘤分类中[12]也根据组织和细胞形态的不同在分级的基础上提出不同形态学亚型,分为嗜酸细胞型、多形性型、透明细胞型及囊状亚型。这些更新说明胰腺肿瘤的细胞及形态学特征越来越为大家所重视,并与临床的诊疗密切相关。笔者在开展病理大切片研究的过程中发现,同一个肿瘤可同时存在超过一种组织学亚型,并且不同的区域形态学、肿瘤间质比及免疫微环境都有差异。因此借助AI,准确地识别出这些组织学亚型及所占百分比,全面评估肿瘤间质比及免疫微环境对实现精准诊疗具有重要意义。另一方面,除了关注肿瘤本身,肿瘤背景病理的认识也越来越受到重视。有研究发现背景病理中无胰腺上皮内瘤变的胰腺癌患者术后存活率低于有胰腺上皮内瘤变者[13]。2019年胰腺癌及神经内分泌肿瘤(NET)的NCCN指南[14-15]中也提出需要在诊断报告中标注出背景病理,说明胰腺背景病理(图2)对判断胰腺肿瘤生物学行为及其预后意义重大。如果能利用AI建立以上这些形态学特征的细分亚型的量化指标,对于精准判定肿瘤预后具有重要意义。同时通过AI还可以识别源自HE染色图像中包含关于肿瘤及周围微环境中共存的不同类型的细胞形态学(如核的区域,核的形状)和空间背景(例如细胞密度)信息[16-18]。而且已有很多研究者的工作[19-26]已成功证明了细胞和组织形态与肿瘤临床结果之间的联系。但这些都是基于传统的小切片及组织芯片所呈现的病理学图像。肿瘤的真实世界远超出我们从小切片或组织芯片上看到的,肿瘤的异质性非常明显,即便是同样分期分化的肿瘤在病理图像上都有各自不同的特点。
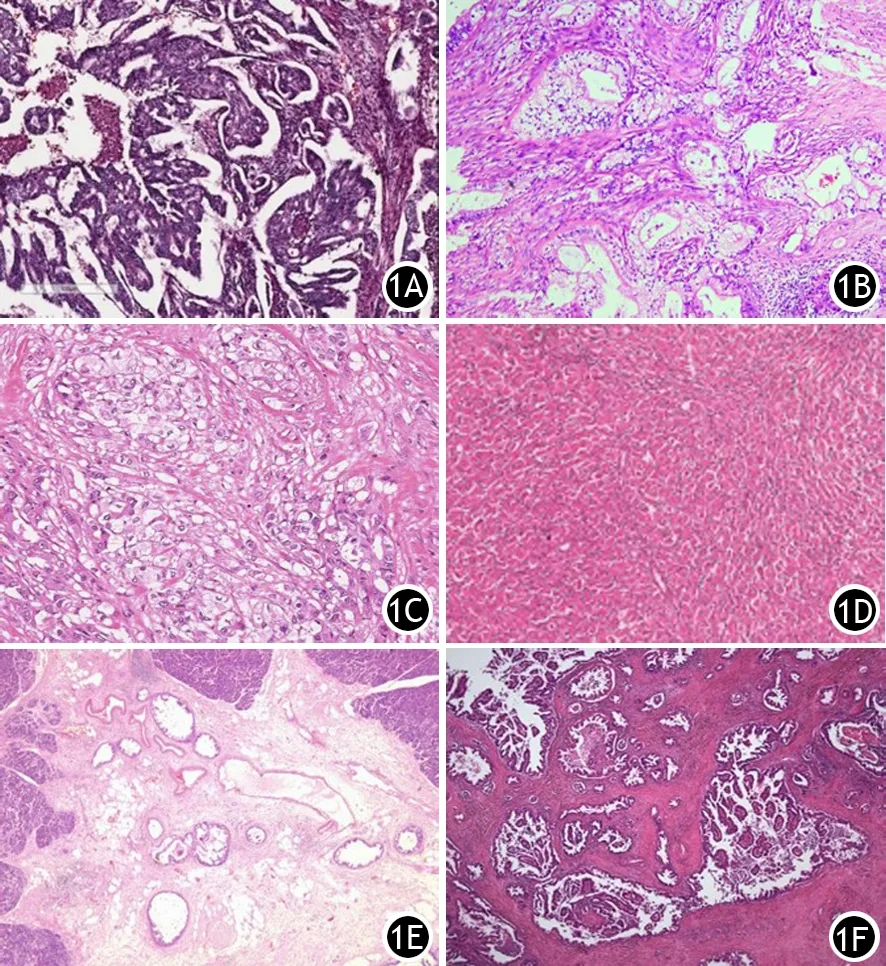
图1 胰腺导管腺癌的各种组织学亚型(1A:肠型;1B:泡沫细胞型;1C:透明细胞型;1D:横纹肌样特征;1E:大导管型;1F:囊状乳头状型)
目前笔者团队已实现胰腺肿瘤的大组织取材,并实现病理大切片的数字化。在此基础上,笔者希望结合AI,通过计算病理对病理大切片所展示的图像进行全面计算,从而实现高通量空间分析细胞类型及其在肿瘤组织样本中的位置。图3、4为笔者团队制作的胰腺NET的组织大切片,对肿瘤、背景病理及周围组织(包括脂肪、血管、正常胰腺、淋巴细胞)进行勾画供计算机学习,目前已建立了很好的上皮间质及不同组分的分割模型。下一步笔者希望利用计算机提取肿瘤和肿瘤周边的良性区域细胞核的特征,观察是否比仅仅使用肿瘤信息更加有效地去预测胰腺肿瘤患者的预后;良性区域中的信息是否能提高预测肿瘤复发的准确率。同时通过计算机对病理图像上这些形态特征进行分层并计算百分比,深度挖掘这些信息,促进对肿瘤细胞及其微环境间相互作用的理解。另外隐藏在这些形态特征背后的潜在的分子基础,尤其是与关键的生物过程相关的分子基础值得进一步深度挖掘。因此,利用AI将肿瘤及其周围背景形态学等各种信息融合多种原始数据(如影像、临床数据、分子数据等),可以对其精准诊断、分析其发展方向及可能的生物学行为,从而为患者制定最优的临床决策。

图2 胰腺的背景病理(2A:慢性胰腺炎;2B:IPMN;2C:PanIN;2D:腺泡导管化生;2E:MCN;2F:小叶中心性萎缩)
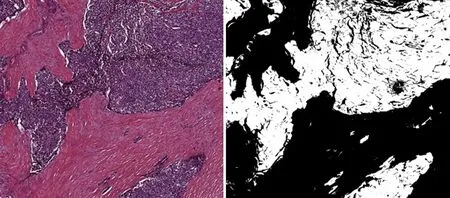
图3 胰腺肿瘤上皮间质分割模型
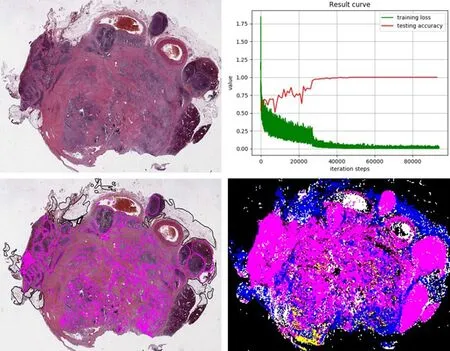
图4 胰腺肿瘤全片成像扫描多组织区域分割模型
二、人工智能在胰腺肿瘤IHC定量评估中的应用前景
AI在病理图像定量分析中的应用,最常见的是通过对免疫组织化学(immunohistochemistry,IHC)染色图像所反应的蛋白质表达情况进行定量评估,它可以使分析结果标准化,减少人工评估时由于视觉限制和认知陷阱引入的偏差。目前已有相应的研究,如在浸润性乳腺癌的诊断中,病理医师需要报告雌激素受体和孕激素受体阳性染色细胞的百分比和强度,指导对乳腺癌患者的内分泌治疗[27-28],这一过程可以通过对IHC图像的定量分析得到精确结果,并且在实践中已被证明优于病理医师的评估[29-31]。在胰腺NET的诊疗中,评估肿瘤组织Ki-67热点区的增殖活性是诊疗关键所在,直接决定肿瘤的分级与治疗[12]。但由于NET的异质性较大,不同区域肿瘤的Ki-67增殖指数可以相差很大,而传统小切片取材因取材局限可能会低估这一值,从而延误治疗。笔者所在团队通过对胰腺NET病理大切片中Ki-67 IHC图像重新评估,发现与传统小切片相比,约10%的患者被低估(结果未发表)。因此在前期工作基础上,笔者希望借助于AI更精准地对Ki-67的热点区进行定量评估,进一步明确病理大切片在NET的诊断中的重要性和必要性。另一方面也希望通过计算病理找出提示Ki-67高增殖活性的组织学特征及提示肿瘤生物学行为的新的诊断指标,这样既解决了精准定量评估的问题,也解决了大切片IHC因抗体消耗量大带来的患者经济负担重而难以在临床推广的问题,同时还可以在已有的诊断标准下提出新的诊断指标,更好地去实现个体化诊疗。
另外随着肿瘤免疫治疗越来越受关注,对相应肿瘤的免疫评分及肿瘤PD-L1伴随诊断的评判标准也越来越受关注。那么胰腺各类肿瘤的免疫微环境状态究竟如何?如何对各类肿瘤进行科学的免疫评分?这对于病理科医师来说也是亟待解决的问题。目前已有研究利用AI定量检测发现CD8+淋巴细胞的数量和位置对于评估PD-L1阳性和PD-L1阴性的非小细胞肺癌的免疫应答是至关重要的[32]。同时该研究发现胰腺癌标本中肿瘤侵袭性边缘与肿瘤中心浸润的CD8+淋巴细胞的密度显著升高。因此笔者希望后续在本单位开展胰腺肿瘤大切片的基础上,通过对肿瘤PD-L1、PD-1及各类免疫相关细胞的IHC染色,利用AI对各类细胞进行定量及空间分布的计算,建立对各类胰腺肿瘤进行免疫评分及评估免疫治疗疗效的模型,从而更好地实现个体化诊疗。
三、胰腺肿瘤病理组学特征与多组学信息的关联
目前胰腺肿瘤的诊疗中依然存在很多瓶颈,如早期胰腺癌和小胰癌的诊断、胰腺炎和胰腺癌术前的准确评判、胰腺癌胰周淋巴结和神经浸润的术前评估、胰腺癌对新辅助治疗的反应评估等。笔者希望在AI的帮助下,将胰腺肿瘤的病理形态学信息与基因分子信息、解剖和功能影像信息相互对比融合,从而发现人眼不易察觉的细节和主观经验难以总结的规律,以此推动多组学交叉研究的产生,充分发挥各自的优势和综合效应。病理组学作为疾病诊断的金标准,可清晰描述肿瘤的形态及微环境状态;影像组学的无创性使它应用更加广泛;基因组学可用于肿瘤的分子分型等。这样的交叉研究不仅能提高疾病诊断的准确性,还能充分利用现有医疗资源,节省研究成本,推动医学不断发展。此时病理大切片的优势就会更加凸显,因为大切片可以将肿瘤不同形态学及微环境特征与解剖及分子影像信息更好地匹配,有助于在影像上预测肿瘤的生物学行为及对治疗的反应。病理科医师更趋向于充当肿瘤的“心理医生”,通过各种信息的融合对其进行精准诊断,分析其发展方向及可能的生物学行为,并以此为依据提供个体化及精准化治疗(图5)。
四、结语与展望
AI时代的病理组学不再是传统意义上的仅局限于病理切片的定量分析,基于AI的病理组学包含多种病理分析任务,如提取细胞形态学特征、背景病理、不同成分的定量、IHC指标量化等,并与肿瘤预后有机地结合在一起,实现肿瘤诊疗、预后以及病理报告的一体化。病理大切片在胰腺肿瘤病理诊断中优势明显,能够整体而全面地将病变组织呈现。病理大切片技术联合数字病理图像分析可以帮助解决精准医学中的一系列问题,特别是预后及预测患者对治疗方案的反应等。因此,未来结合大切片基础上的病理组学、影像组学及分子结构特征并融合临床诊疗数据去构建预测模型将会有很大潜力。

图5 整合多组学构建预测模型
利益冲突所有作者均声明不存在利益冲突

