Hedgehog信号通路在肾纤维化中的研究进展
李 庆综述,李 均审校
0 引 言
肾纤维化是导致终末期肾病的重要病理变化。多种信号通路参与肾纤维化的发展,如JNK/SAPK信号通路、TGF-β/Smad 信号通路、Wnt/β-catenin 信号通路、Notch/Jagged 信号通路、Hedgehog(Hh)信号通路、TLR4 及其信号通路等[1]。本文主要就Hh 信号通路和肾纤维化之间的关系作一综述。
1 肾纤维化
肾纤维化是大多数慢性肾脏病(chronic kidney disease,CKD)的共同病理表现,也是导致终末期肾脏病的主要病理变化。CKD 的进展受持续炎症刺激,离子紊乱以及高糖环境等诸多因素影响[2-3],有50%的70 岁以上成年人以及10%的世界人口受CKD 和肾纤维化的影响[4]。肾纤维化是因肾在受到慢性且持续性损伤后,原组织细胞不能得到完全修复所致,而肾纤维化的进展速度决定了肾功能丧失的速度,延缓肾纤维化进展是保护肾功能的关键。肾纤维化在CKD 进展中的机制与蛋白尿,氧自由基,血管活性物质,肾小管纤维化,内皮功能障碍,基质大量沉积有关[5]。
2 Hh信号通路
2.1 Hh 信号通路的结构Hh 信号通路是一种较为复杂的信号通路,在胚胎发育和组织再生中起重要作用,其主要由Hh 配体、Patched 受体(Ptch 受体)、共受体(Cdon/Ihog,Boc/Boi,Gas1)、换能器Smoothened(Smo)及下游转录因子Gli 组成。1980年Nusslein 等[6]首次发现Hh 基因,后来研究发现,Hh 在脊椎动物中有SHH、DHH、IHH 等3 种同源基因,分别编码相对应蛋白,即Shh、Dhh、Ihh,在脊椎动物中研究较多的为SHH。Hh 蛋白是目前已知的唯一一个同时具有棕榈酰和胆固醇基部共价修饰,且此种共价修饰可自发进行的蛋白,这种特性在功能的表达上起到重要作用。Ptch 蛋白由Patched 基因编码,具有12 个跨膜结构域并且为RND 转运蛋白家族的成员,是Hh 信号通路的负调节因子,其有2 种亚型,分别为Ptch1 与Ptch2,其中Ptch1 是主要受体类型,而Pach2 在信号传导中起到次要的补充作用。Smo 蛋白由Smoothened 基因编码,是Hh 信号通路中的重要激活因子,为七次跨膜蛋白且属于G蛋白偶联家族,其特征在于氨基末端具有富含半胱氨酸的结构域,这可能与Ptch 相互作用的过程中起到关键作用。Gli 蛋白由GLI 基因编码且具有锌指结构,是Hh 信号通路的主要效应因子,在脊椎动物中有Gli1,Gli2,Gli3 等3 种亚型,其中Gli2 是主要的激活因子,Gli1可能是Gli2的信号放大器,两者在功能上可能有相似之处,Gli3为抑制因子。
2.2 Hh 信号通路的调节肾损伤及高糖环境均可激活Hh信号通路[7],该通路激活可分为经典模式与非经典模式。经典激活途径依赖于Hh 配体。在缺乏Hh 信号情况下,Ptch 抑制Smo 从而抑制Gli 以全长形式入核进行相应靶基因的转录,同时β-TrCP 也可介导蛋白激酶A、糖原合成酶激酶3β 和酪蛋白激酶1 磷酸化Gli 蛋白,导致Gli1 降解或使Gli2 和Gli3水解成其对应的阻遏形式(Gli2R 和Gli3R)而产生相同效应。当存在Hh 时,Hh 在共受体辅助下与Ptch 结合后下调Ptch 的膜表达,从而使Smo 在膜表面富集。Smo 进行信号转导使Gli 与其抑制蛋白sufu 及Cos2 分离,从而开始活化与核转位,最终激活靶基因,如细胞周期蛋白D、E 和N-Myc。而非经典模式Hh 信号通路激活则不依赖于Hh,甚至不依赖于Smo,通过TGF-β、Wnt、EGF等多信号的调节直接激活Gli使其转录。
3 Hh信号通路与肾纤维化
Hh 信号通路可通过促进肾肌成纤维细胞的活化、增殖与转化,串话多条参与纤维化形成的通路,参与细胞凋亡调控等作用于肾纤维化,见图1。
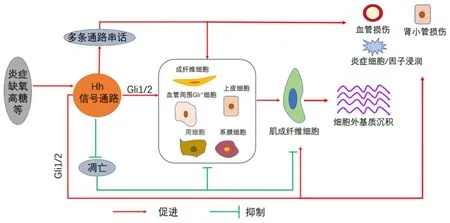
图1 Hh信号通路在肾纤维化中的作用Figure 1 The role of Hh signaling pathway in renal fibrosis
3.1 Hh 信号通路促进肾肌成纤维细胞的活化、增殖与转化肾纤维化发展的特征在于肌成纤维细胞的活化,其过度激活可造成细胞外基质过量产生及沉积,最终导致肾间质纤维化[8]。上皮-间充质转换(epithelial-mesenchymal transition,EMT)在肾肌成纤维细胞增殖过程中发挥重要作用。在大鼠单侧输尿管梗阻(unilateral ureteral obstruction,UUO)模型中发现Shh 表达的明显升高,解除输尿管梗阻后Shh 浓度降低,EMT 现象明显减弱[9],同时在HIV 相关肾病的EMT 研究中也发现Hh 通路的激活,在用Hh 信号通路特异性阻断剂阻断此通路后EMT 得以缓解[10]。Gli1 可还诱导EMT 关键因子Snail1 以及Twist1 上调,参与EMT 的发生[11]。而最近也有研究表明大部分肌成纤维细胞可能来源于肾间充质干细胞样细胞和血管周围Gli+细胞以及周细胞,这些细胞均表达Hh 信号通路转录因子Gli[12-15],这暗示了Hh 信号通路与肌成纤维细胞活化之间具有相关性。当肾受到刺激,如损伤及高糖环境,肾小管上皮细胞可分泌Hh 信号,经过旁分泌方式作用于肾间质成纤维细胞并激活Gli,使之活化为肌成纤维细胞[8,16]。抑制Hh 通路可使Gli+细胞向肌成纤维细胞的转化显著减少,并且还会抑制Gli+细胞的增殖[17]。此外,Hh 信号可直接调控肾间质成纤维细胞中α-SMA,纤连蛋白,胶原蛋白Ⅰ和结蛋白的表达,促进成纤维细胞的活化[18]。在对大鼠肝肺肾纤维化的研究中发现,Hh信号可通过调节ITGA 11(一种胶原蛋白Ⅰ结合受体),诱导肾肌成纤维细胞的转化,加重纤维化的发生,而且在此实验中检测到Gli 和α-SMA 共定位于肌成纤维细胞[19],同时,另一项研究表明,Gli2在肌成纤维细胞祖细胞中表达,并在间充质干细胞样祖细胞中加快细胞周期进展,在肾纤维化发生后,特异性敲除肌成纤维细胞中Gli2 或过表达Gli3 可减轻纤维化程度[16],以此可知,Hh 信号通路不同于TGF-β 等其他通路,其可直接作用于肌成纤维细胞,但具体作用机制尚未清楚,需要进一步研究。基于Hh 通路可直接作用于肾肌成纤维细胞,与其他通路如TGF-β,Wnt 信号通路等不同之处以及优势点,推测深入对Hh 信号通路的研究可能在肾纤维化治疗中更加有效。
3.2 Hh 信号通路的串话Hh 信号通路与Wnt/βcatenin 信号通路、TGF-β/Smad 信号通路相互串话,共同影响肾纤维化进展,现分别将Hh 信号通路与此两通路之间串话进行概括,见图2。
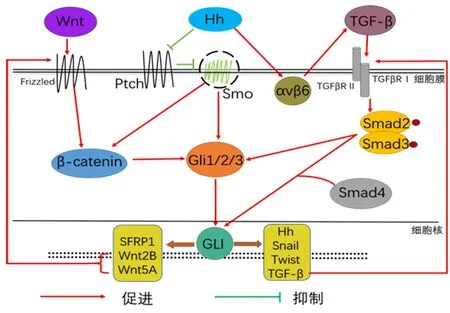
图2 Hh、Wnt、TGF-β信号通路间简要关系Figure 2 Brief relationship between Hh,Wnt,and TGFβ signaling pathways
3.2.1 Hh 与Wnt/β-catenin 信号通路Wnt 通路对肾纤维化起到诱导作用已广受认可。Hh 可直接诱导β-catenin 上调[20],并且Gli 可直接激活Wnt2B 和Wnt5A[21],而β-catenin 和Wnt2B 均为Wnt 信号通路激活的重要因子,因此Hh信号通路可直接激活Wnt信号通路。此外,糖原合成酶激酶3β和酪蛋白激酶1α 可同时磷酸化β-catenin 与全长Gli3,使β-catenin被β-TrCP识别降解,而Gli3的C-末端肽被降解产生Gli3R,抑制Gli1活性[22]。Gli3R和Gli1相互拮抗,过表达Gli1 可降低Gli3R 的mRNA 水平,且其与βcatenin 的C 末端反式激活结构域相互作用抑制βcatenin 活性,因此,Gli3R 在两种途径间起桥梁作用,Hh 可通过上调Gli1 抑制Gli3R 活性,降低Gli3R对β-catenin 的抑制作用,增强Wnt 通路传导。但值得注意的是,Wnt和Hh之间的通路串扰还通过内源性分泌卷曲蛋白相关蛋白1 介导,内源性分泌卷曲蛋白相关蛋白1 可被Gli1 诱导,是Wnt 信号传导途径的负调节因子。此外,Gli1 还可诱导Snail 表达,然后与β-catenin 相互作用并刺激其转录。在对囊性纤维病的研究中发现,β-catenin可调节Hh信号通路,β-catenin的体外和体内激活实验中,Gli1均可被上调[23]。Wnt 与Hh 信号通路之间通过直接与间接的方式相互作用,通过各种因子的相互交流存在密切联系,共同作用于肾纤维化的发生与发展。
3.2.2 Hh 与TGF-β/Smad 信号通路肾纤维化过程中,TGF-β/Smad 作为其核心通路,通过调控TGFβ 与分泌物的产生、激活潜在的TGF-β、调控下游信号Smad以促进纤维化的发生[24]。Hh可诱导整合素αvβ6 上调,激活潜在TGF-β 信号,而TGF-β 信号通路进一步激活成纤维细胞,同时整合素αvβ6也可直接激活成纤维细胞[25-26],并且Shh 还可直接诱导TGF-β1 上调[9]。TGF-β 也可在不依赖Smo 和Hh 信号的情况下通过Smad3 和β-catenin 诱导Gli2 表达。已有研究表明,Gli2 和Gli1 可在PKA 被TGF-β 抑制的情况下被诱导[27],并且Gli2 基因是多种细胞类型中TGF-β 通路的直接转录靶标,其中包括成纤维细胞。在缺乏Gli2 的成纤维细胞中,TGF-β 诱导的成纤维细胞活化敏感性下降,肌成纤维细胞的增殖减少。此外,Gli2 也可通过直接结合TGF-β 的靶基因Ctgf和Pai-1促进TGF-β通路靶基因的转录[28]。
4 Hh信号通路在细胞凋亡中的作用
Hh信号通路在组织受到损伤时可被重新激活,参与组织修复。而其主要的靶向细胞为间质细胞,如成纤维细胞,肌成纤维细胞,周细胞等。通常情况下,肾在损伤修复后,成纤维细胞及肌成纤维细胞会逐渐凋亡减少,而在肾纤维化的发展中并非如此,一方面是由于肾的慢性损伤迁延不愈,另一方面,可能是由于Hh 信号通路的抗细胞凋亡作用。Hh 信号通路可通过上调Trail 凋亡信号途径抑制剂XIAP[29]、抗凋亡因子Caspase8 抑制剂cFlip[30]、PDGFR-α 和Bcl-2[31]以及下调Fas 受体、TRAIL 同源受体死亡受体4、死亡受体5、Caspase3 和PARP[31]来抑制间质细胞凋亡。但值得注意的是,在药物实验中可观察到抑制Hh 信号通路后肾小管上皮细胞凋亡增加,而成纤维细胞与肌成纤维细胞减少[20]。
5 Hh信号通路抑制剂
Smo抑制剂Vismodegib 和Sonidegib 先后被FAD批准用于临床。除此之外,还有Gli 抑制剂,如GLI间接抑制剂,包括CMAPs、JQ1和I-BET151、HDACi、Pyrvinium。GLI直接抑制剂有GANT61、三氧化二砷(ATO)、MEKK2/3 以及大环肽抑制剂(HL2-m5)等,而以上抑制剂在肾纤维化中的作用有待证明。另外,一些植物提取物也可抑制Hh 通路,如卧茎景天提取物[32]、白藜芦醇以及第一个被发现的Hh 抑制剂天然生物碱环巴胺[33]等。
6 结 语
Hh 信号通路在肾的发育与损伤中均发挥显著作用,是一条重要的通路,其异常活动可引发多种疾病,包括癌症,先天性疾病以及纤维化疾病等。近年来Hh 信号通路在肾纤维化中的作用受到越来越多学者的关注,但是此通路在肾纤维化中的具体作用机制至今尚未明确,需要更多研究进行解释。而此条通路在肾纤维化中不同于其他通路之处在于其更主要的是直接作用于肾纤维化发生的中心事件——肌成纤维细胞的活化、增殖与转化,且在肌成纤维细胞生成后抑制此通路仍可减轻肾纤维化。以往研究较多的信号通路如TGF-β 通路、Wnt通路等其主要作用靶点在于肾小管上皮细胞,即EMT,与之相比,Hh 通路对肾纤维化的作用更为重要,这说明深入对Hh 通路的研究在防治肾纤维化时更为有效。