血清淀粉样蛋白A对胃癌细胞生物学行为的影响及其在胃癌早期诊断中的应用
谌秋华,陈燕玲,郭 健
0 引 言
胃癌是一种常见的消化系统恶性肿瘤,具有高发病率和病死率的特点,严重威胁人类的健康[1]。据统计,2012年我国胃癌发病率为31.28/10万,病死率为22.04/10 万,分别占全球第5 和第6 位[2-3]。胃癌多无明显的特异性临床表现,且预后效果差。因此,寻找胃癌血清特异性标志物具有重要的意义。
血清淀粉样蛋白A1(serum amyloid A protein 1,SAA1)是一种主要的急性期蛋白,在炎症反应、组织损伤和慢性炎性疾病中存在高表达。研究发现,SAA1 在胃癌、肺癌等其他恶性肿瘤中表达升高,可能是肿瘤的潜在标志物[4-6]。本研究采用ELISA 方法检测胃癌患者及健康体检者血清中SAA1 的表达水平,分析其与临床病理因素的相关性。通过人工干扰胃癌细胞中SAA1 表达,检测胃癌细胞侵袭能力变化,探讨胃癌患者SAA1 的表达及在胃癌诊断和预后评价中的应用价值。
1 资料与方法
1.1 研究对象人胃癌SGC-7901 细胞购自中国科学院细胞库。收集2017 年9 月至2018 年12 月于我院就诊并确诊的82 例胃癌患者,其中男59 例、女性23 例,年龄31~68 岁,平均(49.75±11.47)岁。以国际抗癌联盟及美国肿瘤联合会颁布的第7 版胃癌TNM 分期系统进行临床分期,其中Ⅰ期15 例、Ⅱ期21 例、Ⅲ期26 例、Ⅳ期20 例。本组患者术前均未接受任何手术、放疗、化疗治疗。另选择30 例同时期于我院健康体检,并排除其他消化系统疾病的健康人血清作为对照组。其中男18 例、女12 例,年龄25~78 岁,平均(49.23±12.23)岁。2 组研究对象性别、年龄等基线资料差异均无统计学意义(P>0.05)。
1.2 主要仪器及试剂胎牛血清、胰蛋白酶、DMEM培养基购自美国Gibco公司,GAPDH、SAA1抗体购自英国ABCam,BCA蛋白定量试剂盒、细胞增殖与活性检测试剂盒购自江苏碧云天,Transwell小室购自美国millipore公司,Lipofectamine 2000转染试剂盒购自美国ThermoFisher,人SAA1 ELISA 检测试剂盒(货号KHA0011)购自美国Invitrogen 公司,iMark 酶标仪购自美国Bio-Rad 公司,高速冷冻离心机购自美国Eppendorf公司。
1.3 细胞培养及转染将人胃癌SGC-7901 细胞接种于含有10%胎牛血清DMEM 培养基中,37℃、5%CO2培养箱中进行培养,待细胞长满培养瓶约80%后按1∶4传代,取对数生长期细胞进行下一步实验。
转染前24 h,将细胞培养基更换为不含血清的DMEM 培养基,37 ℃、5%CO2培养箱中进行培养,培养至细胞融合度约80%后进行转染。实验分为空白对照组、阴性对照组和实验组。空白对照组仅添加转染试剂;实验组和阴性对照组分别转染SAA1-siRNA 和NC-siRNA。转染步骤参考Invitrogen 公司提供的脂质体Lipofectamine 2000 方法进行操作。转染完成6 h 后更换为完全培养基,常规培养48 h后收集细胞进行后续实验。Western blot 检测SAA蛋白表达情况,以GAPDH为参照。
1.4 CCK8 法检测细胞活力将转染后细胞接种到96孔板,每孔接种1×106个;另取未转染细胞作为正常对照组,每组重复6 次,37 ℃、5%CO2培养箱中进行培养,48 h 后每孔加入CCK8 10µL,37 ℃反应2 h,酶标检测450 nm 吸收度。细胞活力=(各组A450/正常细胞A450)×100%。
1.5 Transwell 法检测细胞侵袭Transwell 侵袭小室铺Matrigel 胶,取转染后的各组细胞收集对数期细胞,计数1×106个/ml 细胞,用无血清DMEM 培养基重悬,取100µL(1×105个)细胞悬液,加入Transwell 小室上室,在下室加入600µL 完全培养基。37 ℃、5%CO2的培养箱中进行培养48 h,取出小室,用棉签擦去上室的细胞,4%多聚甲醛固定15 min,PBS 洗涤1 次,结晶紫染色10 min,PBS 再次洗涤1次,检测细胞是否穿过小孔,如有穿过终止其他实验组,并拍照统计。
1.6 ELISA 法检测血清SAA1 含量抽取患者清晨空腹静脉血5 mL,室温放置30 min,4 ℃下以3000 r/min 转速离心20 min(离心半径15 cm),分离血清,分装保存于-80℃冰箱。采用双抗体夹心ELISA 法检测SAA1 表达含量。所有操作均严格按照试剂盒说明书进行,并根据试剂盒标准曲线对SAA1 进行定量。
1.7 统计学分析采用SPSS 19.0 软件进行分析。血清SAA1 浓度以均数±标准差()表示。多组变量间比较采用单因素方差分析法,组间多重比较采用LSD-t检验;采用Spearman 法分析SAA1与临床病理参数之间的相关性;绘制ROC 曲线评价SAA1 的敏感性和特异性。以P≤0.05表示有统计学意义。
2 结 果
2.1 Western Blot 法检测转染后SAA1 表达量单因素方差分析结果显示,转染SAA1-siRNA 组SAA1 表达量显著低于其他处理组,差异有统计学意义(F=37.069,P<0.01),表明转染成功,显著抑制SAA1 基因表达。NC-siRNA 组与空白对照组间差异无统计学意义(P=0.345),见图1。
2.2 CCK8 法检测转染后细胞活力CCK8 检测细胞活力结果发现,SAA-siRNA 转染组细胞活力显著低于其他处理组,差异有统计学意义(F=15.290,P<0.01),表明降低SAA1 表达量显著影响细胞活力。NC-siRNA组与空白对照组相比,差异无统计学意义(P=0.093)。见图2。
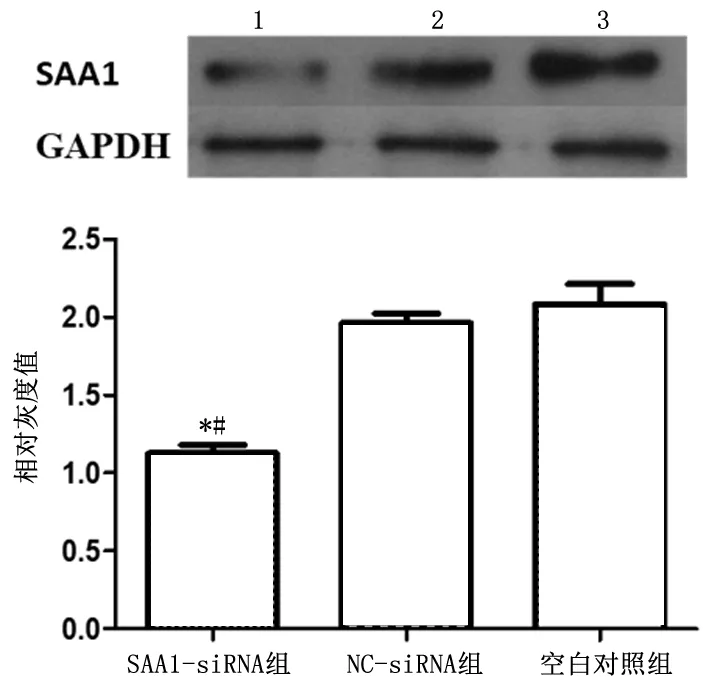
图1 转染后各组SAA1蛋白表达情况Figure 1 The expression of SAA1 in different groups
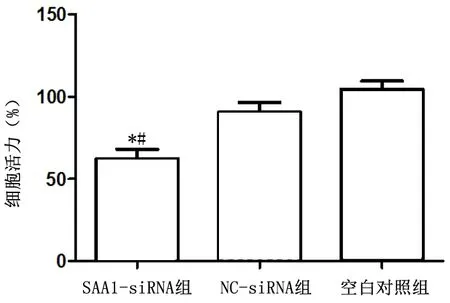
图2 SAA1对各组细胞活力的影响Figure 2 Effect of SAA1 on cell viability of each group
2.3 Transwell 检测细胞侵袭能力Transwell 小室侵袭检测结果表明,靶向下调SAA-siRNA 后细胞侵袭能力较其他处理组显著下降(F=45.946,P<0.01)。NC-siRNA组与空白对照组相比,差异无统计学意义(P=0.22)。见图3。

图3 SAA1对各组细胞侵袭能力的影响Figure 3 Effect of SAA1 on the invasive ability of cells in each group of cells
2.4 血清中SAA1 表达水平比较ELISA 结果显示,实验组胃癌患者血清中SAA1 水平[(50.03±20.89)µg/mL]显著高于对照组[(24.06±10.72)µg/mL],差异有统计学意义(P<0.05)。ROC 曲线显示,SAA1 诊 断 胃 癌 的AUC 为0.791(95%CI:0.701~0.880),检测阈值为31.97µg/mL,其诊断敏感性和特异性分别为0.659和0.833。见图4。
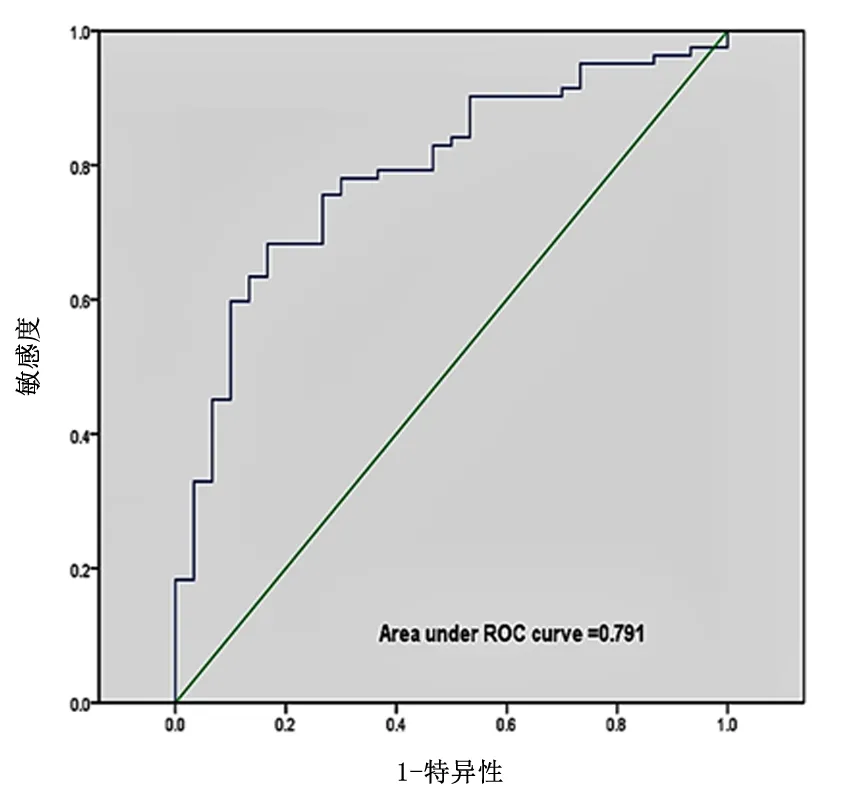
图4 SAA1表达水平诊断胃癌的ROC曲线Figure 4 ROC curve of SAA1 expression level in diagonosis of gastric cancer
2.5 SAA1表达水平与临床病理因数的相关性血清SAA1 的表达水平与胃癌患者性别、年龄、肿瘤的转移情况无显著相关性(P>0.05);与肿瘤最大径和侵袭程度具有相关性,且随着肿瘤侵袭程度的增加而增加(P<0.05),见图5,表1。
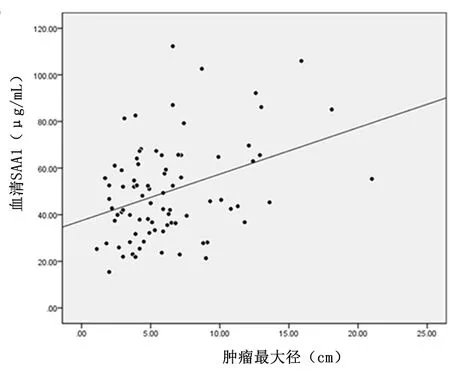
图5 血清SAA1与肿瘤最大径相关性分析散点图Figure 5 Correlation analysis between serum SAA1 and tumor maximum diameter
表1 胃癌患者血清SAA1表达水平与临床病理因数相关性分析结果()Table 1 Correlation between SAA1 expression level and clinicopathological factors in patients with gastric cancer()
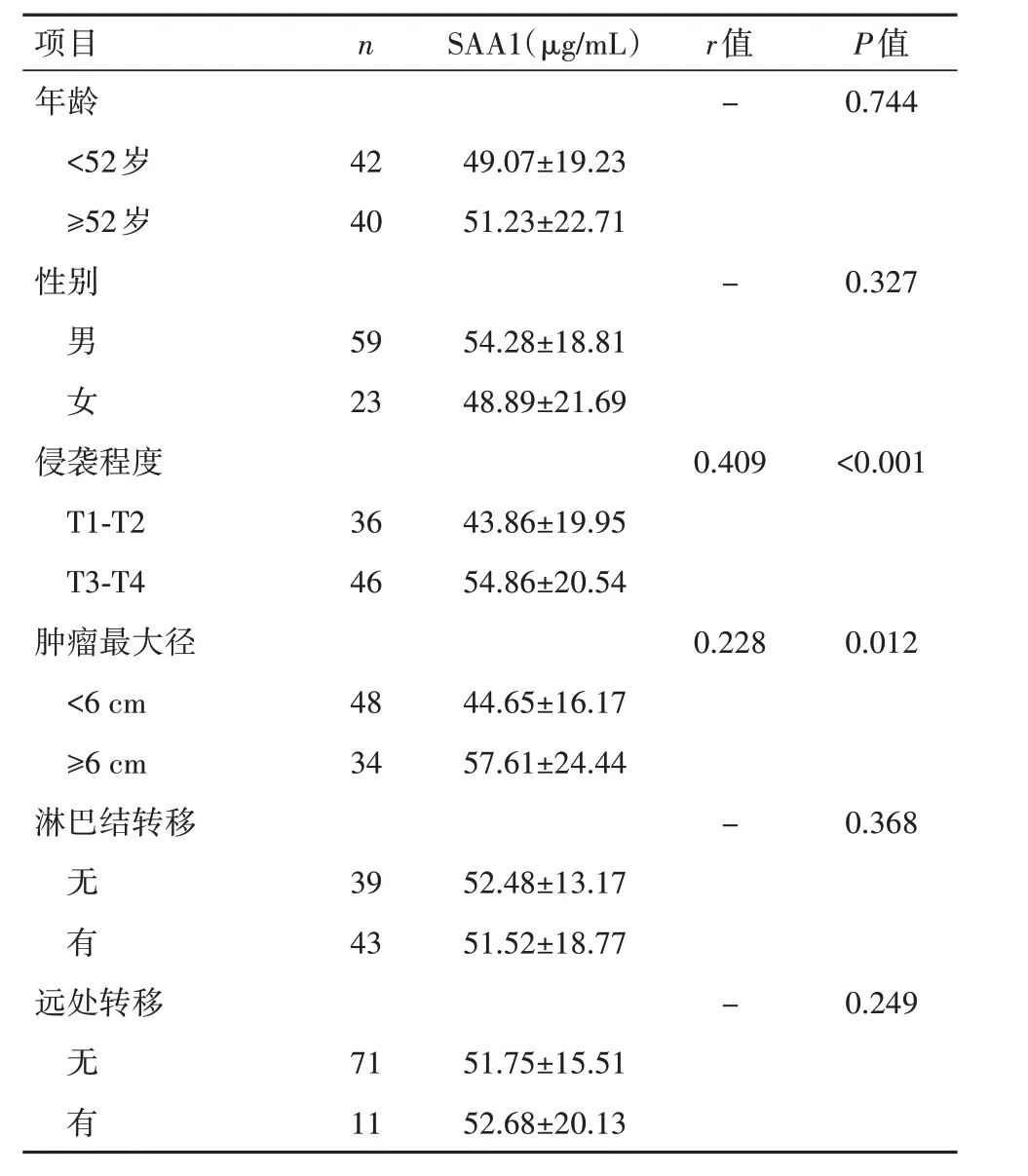
表1 胃癌患者血清SAA1表达水平与临床病理因数相关性分析结果()Table 1 Correlation between SAA1 expression level and clinicopathological factors in patients with gastric cancer()
项目n SAA1(µg/mL)r值P值年龄-0.744<52岁4249.07±19.23≥52岁4051.23±22.71性别-0.327男 5954.28±18.81女2348.89±21.69侵袭程度0.409<0.001 T1-T23643.86±19.95 T3-T44654.86±20.54肿瘤最大径0.2280.012<6 cm4844.65±16.17≥6 cm3457.61±24.44淋巴结转移-0.368无 3952.48±13.17有4351.52±18.77远处转移-0.249无 7151.75±15.51有1152.68±20.13
3 讨 论
我国胃癌患者5 年生存率远低于韩国、日本等国家,其主要原因与胃癌早期筛查检出率不足有关,多数患者一经查出即为癌症晚期,进行有效筛查对延长癌症患者生存期,提高生活质量显得尤为重要[7]。目前胃癌早期筛查以胃镜病理检测为主,肿瘤标志物为辅(如CEA、CA199、CA724 等),对于胃癌早期诊断相对价值偏低[8-9]。
SAA 是一类由多基因编码的多形态蛋白家族,组织淀粉样蛋白A 的前体物质,属于急性时相反应蛋白,其含量在疾病急性期会迅速升高,疾病恢复期迅速下降。大量研究表明,SAA 表达与肿瘤的发生与发展显著相关,在肺癌[10]、食管癌[11]、卵巢癌[12]等患者血清中均发现过表达的SAA。SAA根据表达情况不同可分为急性型和组成型,其中人类基因组中编码急性期的基因有Saa1和Saa2。SAA1是人类中由Saa1 基因编码的蛋白质[13-14]。SAA1 是一种主要的急性期蛋白,主要由肝细胞产生,以应对感染,组织损伤和恶性肿瘤[15]。当释放到血液循环中时,SAA1 作为与高密度脂蛋白相关的载脂蛋白存在[16]。SAA1 是淀粉样蛋白A(AA)的主要前体,其沉积物导致炎性淀粉样变性[17-18]。SAA1 参与了机体炎症反应的发生与发展。当炎症、损伤等激发时,IL-1、IL-6 等促炎因子调控肝脏分泌大量SAA1[18]。有研究通过高效液相色谱检测发现胃癌患者SAA1 表达水平显著升高,且与肿瘤的侵袭程度相关,提示SAA1 可能是胃癌的潜在生物标志物[19]。Chan 等[4]研究发现胃癌患者中SAA 的表达含量与肿瘤分期、位置、淋巴结转移相关,且高浓度SAA 患者死亡风险增加近4 倍,提示SAA 对胃癌患者预后密切相关,可作为有价值的术后随访工具。
本研究通过转染SAA1-siRNA 至胃癌细胞中,经Western blot 检测转染后SAA1 表达。结果表明,转染SAA1-siRNA 组细胞SAA1 表达量显著低于转染NC-siRNA 组以及空白对照组,证明转染效果较好,可有效降低SAA1 表达量;细胞活力检测以及细胞侵袭能力检测结果表明,下调SAA1 表达可有效降低胃癌细胞的活力,降低细胞侵袭能力。此外,临床标本检测表明胃癌患者血清SAA1 表达水平显著高于健康体检者,研究结果与Subbannayya 等[21]一致。与此同时,本研究采用ROC 特征曲线分析SAA1 诊 断 胃 癌 的AUC 为0.791(95%CI:0.701~0.880),检测阈值为31.97µg/mL,其诊断敏感性和特异性分别为65.9%和83.3%。通过进一步对SAA1 与胃癌临床病理因素相关性分析发现,SAA1表达含量与胃癌大小和临床分析呈正相关,提示血清SAA1 可作为监测胃癌病情进展的指标之一,同过表达SAA1 可能促进胃癌的增殖和侵袭。由此推断,SAA1 可能作为新潜在的胃癌血清标志物之一,而且检测血清SAA1 具有操作简捷、价格低廉、动态检测、非侵入性等特点,是临床检测的高价值血清标志物之一。本研究中,SAA1 的灵敏度仅为65.9%,其原因可能是临床样本量较小,血清SAA1水平差异较大,需要在后续的实验调查中增加大的样本数量,以减少差异。SAA1 并非是胃癌特异性标志物,在临床早期诊断、诊治中仍需结合其他的肿瘤标志物和临床病理资料以提高胃癌诊断的灵敏度和特异性。
综上所述,SAA1 可有效影响胃癌细胞活力及侵袭能力,抑制SAA1 的表达可能会抑制胃癌病程。SAA1 与临床病症分析表明,在胃癌患者中高表达的SAA1 可作为新型胃癌标志物,但仍需更多的血清样本进一步验证,以确定SAA1 在胃癌诊断中的价值以及其与胃癌的预后关系和其对胃癌的作用机制。