聚氧乙烯(23)月桂醚低温降解菌的筛选及降解动力学研究
施 炎,李 新,陈杨武,王 臣,谭周亮
(1.绵阳师范学院资源环境工程学院,四川 绵阳 621006;2.中国科学院环境与应用微生物重点实验室,成都 610041; 3.中国科学院成都生物研究所 环境微生物四川省重点实验室,成都 610041)
1 前 言
表面活性剂作为洗涤剂中的主要活性成分,由最初的洗衣剂延伸运用至乳化剂、润滑剂、防腐剂等各行业,其中非离子表面活性剂是其最主要的组成部分[1~5]。非离子表面活性剂(R-O-(CH2CH2O)n-H)具有乳化、起泡、润湿、渗透等特性[6-7],主要分为聚氧乙烯醚类、多元醇酯类、酰胺类以及嵌段聚醚类4种类型[8],聚氧乙烯(23)月桂醚(Brij-35)属于聚氧乙烯醚类非离子表面活性剂。该类废水直接进入水体,即使在低浓度(1 mg/L)下也会产生大量持久性泡沫,这些大量不易消失的泡沫在水面形成隔离层,减弱了水体与大气之间的气体交换,致使水体发臭,且具有生物毒性并直接威胁到水生动植物的生存[9-10]。
生物降解法因成本低且无二次污染而广泛运用于非离子表面活性剂污染的治理[11-12]。目前,国内外已筛选出多株非离子表面活性剂降解菌株,主要包括假单胞菌(Pseudomonas)[13~15]、红球菌(Rhodococcus)[16]、产碱杆菌(Alcaligenes)和肠杆菌(Enterobacter)[17]等。这些菌株在25~30℃下表现出了较高的底物降解活性。然而,温度是影响微生物生长与降解效果的关键因素之一[18-19]。研究表明,在35℃以内,温度每下降10℃微生物的降解活性与生长速率均减少一半[20-21]。Danie[22]等人的研究发现,温度的降低对微生物的活性产生抑制作用,进而导致脂肪醇表面活性降解效果的下降。李亚选[23]等从东北地区活性污泥中筛选出混合菌株,通过与常温菌株进行低温处理效果比较,结果发现其所筛选的菌株在低温环境下其降解效率比常温菌高。由此可知,低温高效降解菌株的获得是解决此类污染物低温处理的有效途径之一。
本研究中,经过长期低温(10℃)驯化培养与纯化分离,获得一株Brij-35降解菌株,并对其进行了16S rDNA鉴定。在此基础上,研究了该菌株在不同pH、底物浓度下的降解特(性与反应动力学,并考察了该菌株对聚氧乙烯(4)月桂醚(Brij-30)的降解情况,以期为聚氧乙烯醚类非离子表面活性剂废水低温生物处理的实际应用提供菌种资源。
2 材料与方法
2.1 药品与培养基
Brij-35与Brij-30均购于上海麦克林生化科技有限公司;细菌基因组DNA提取试剂盒购于天根生化科技(北京)有限公司;其余所用药品试剂均为国产分析纯。
无机盐培养基:KH2PO41.0 g/L,Na2HPO4·12H2O 1.0 g/L,MgSO4·7H2O 0.3g/L,(NH4)2SO40.3g/L,微量元素5 mL/L[24](pH 8.0);筛选培养基由无机盐培养基与Brij-35(0.25 ~1.0 g/L)构成;固体培养基则是在培养基中加入20 g/L的琼脂粉;LB培养基[25]:蛋白胨 10 g/L、酵母提取物 5 g/L、NaCl 10 g/L,pH 7.0。
2.2 Brij-35低温降解菌株的分离与形态观察
用于菌株筛选的活性污泥取自四川省绵阳市某市政污水处理厂曝气处理单元。接种活性污泥样品20 mL于含500 mg/L Brij-35的三角瓶中,置于10℃、160 rpm恒温振荡器中长期驯化培养。当Brij-35的去除率在24 h时超过90%时,接种活性污泥样品1 mL进行梯度稀释与平板涂布,并置于恒温培养箱(10℃)培养48~72 h。待平板上长出菌落后,挑取单菌落进行再次划线分离,如此反复4~5次后挑取单菌落接至LB液体培养基中10℃培养。将LB培养基中的培养物按5%(v/v)的接种量转接至Brij-35液体培养基中继续培养,筛选Brij-35降解速率最快的菌株用于后续实验,进行革兰氏染色,并利用电镜扫描观察细胞形态结构。
2.3 Brij-35低温降解菌株的鉴定
挑取单菌落接种于LB培养基中,10℃条件下培养至对数中期后,5 000 rpm离心后收集菌体。按照细菌基因组DNA提取试剂盒的步骤进行DNA提取。采用通用引物27F(5′-AGAGTTTGATCATGGCTCAG-3′)与1492R(5′-GGTTACCTTGTTACGACTT-3′)对提取到的DNA样品做PCR扩增。PCR扩增体系:ddH2O 22μL ,PCR Maste Mix 25μL,27F和1942R各1μL,DNA样品1μL。PCR反应条件:预变性95℃ 5min;变性95℃ 30s,退火56℃ 30s,延伸72℃ 2min,30个循环;72℃ 5min。PCR产物经1%琼脂糖凝胶电泳检测、纯化后送至成都擎科梓熙生物技术有限公司进行测序分析。将测序结果在NCBI基因文库进行BLAST比较,并采用软件MEGA 6构建系统进化树。
2.4 Brij-35低温降解菌株的降解性能研究
按20%(v/v)的接种量将上述筛选到的Brij-35低温降解菌株接入200 mL培养基(Brij-35浓度0.25 g/L)中,置于恒温振荡器(10℃、160 rpm)中培养24 h,制成种子液备用。考察10℃条件下菌株在不同pH(6~10)、底物浓度(100~1 000 mg/L)下的生长状况、降解效果与反应动力学研究,从而获得菌株的最适生长条件,并考察适条件下Brij-35低温降解菌株的生长与降解效果。检测指标包括OD600、Brij-35与化学需氧量(COD)去除率。
2.5 Brij-35低温降解菌株对Brij-30的降解效果考察
进一步考察Brij-35低温降解菌株对同类非离子表面活性剂聚氧乙烯醚Brij-30的降解效果。温度设置为10℃,Brij-30的初始浓度设置为250 mg/L,其余条件同1.4。
2.6 分析方法与数据处理
化学需氧量(COD)采用微波消解法,菌体生长状况采用600nm处的分光光度法。Brij-35测定参考KI-I2分光光度法[26-27]并稍作修改,简言之:向样品中加入200 μL 1∶5 HCl溶液,使用纯水定容至10mL,加入250 μL KI-I2显色剂,摇匀并静置反应120 min,于500 nm 处测定吸光度。
Brij-35降解按一级动力学方程进行线性拟合[28-29],公式如下:
lnc=-Kdt+lnC0
COD,Brij-35的去除率计算公式如下:
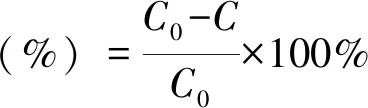
式中:c为基质浓度,mg/L ;Kd为一级动力学常数,h-1;t为降解时间,h;C0为初始基质浓度,mg/L。
3 结果与讨论
3.1 降解菌株的形态观察与鉴定
通过反复分离、纯化,筛选到一株Brij-35降解低温菌株,命名为YX3。10℃下培养2~3 d,在固体培养基上可形成半透白色、圆形、边缘光滑,中间凸起且表面湿润的菌落;在液体培养基中则为白色浑浊液体。革兰氏染色实验证实菌株YX3为革兰氏阴性菌(图1A)。由扫描电镜照片(图1B)可知,菌株YX3菌体为短杆状,尺寸为2.66 μm(957~621 nm)。
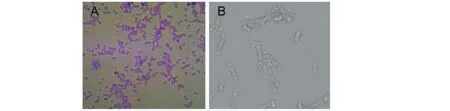
图1 YX3菌的革兰氏染色显微镜图(A)与电镜扫描照片(B)Fig.1 Gram staining microscopic image (A) of strain YX3 and scanning electron micrograph(B)
经16S rDNA测序,获得片段长度为1 403 bp。如图2所示,该菌与Acinetobacter sp.有99%相似性,因此鉴定为不动杆菌属(Acinetobactersp.),GenBank登录号为MK138620。Acinetobacter可降解多种有机污染物,包括苯酚[30]、邻苯二甲酸酯[31-32]、石油烃[33-34]、雌二醇[35]等物质,而针对Acinetobacter降解非离子表面活性剂的菌株报道较少。

图2 基于16S rDNA基因序列关系的菌株YX3的系统发育树Fig.2 Phylogenetic tree of strain YX3 based on 16S rDNA gene sequences relationship
3.2 菌株YX3对Brij-35的降解
不同pH下菌株YX3的生长与Brij-35降解效果如图3所示。由图3A可知,在pH 7~10时,15 h后菌株YX3生长量(OD600)良好且在pH 9生长最佳,而pH 6时生长情况不佳。由图3B可知,菌株在pH 8~9的条件下均有较好的Brij-35降解效果,15 h去除率分别为79.23%、76.64%;pH为7、10时,Brij-35的15 h去除率低于65%,pH 6降低至48%。由图3C可知,在pH 8时15 h COD去除率比其他pH条件下的COD去除率高23.53%~39.67%。由图3A、B可知,菌株YX3的生长与Brij-35降解趋势一致,表明菌株YX3在中性偏碱性条件下生长代谢活性更高,且在pH 8时最佳。
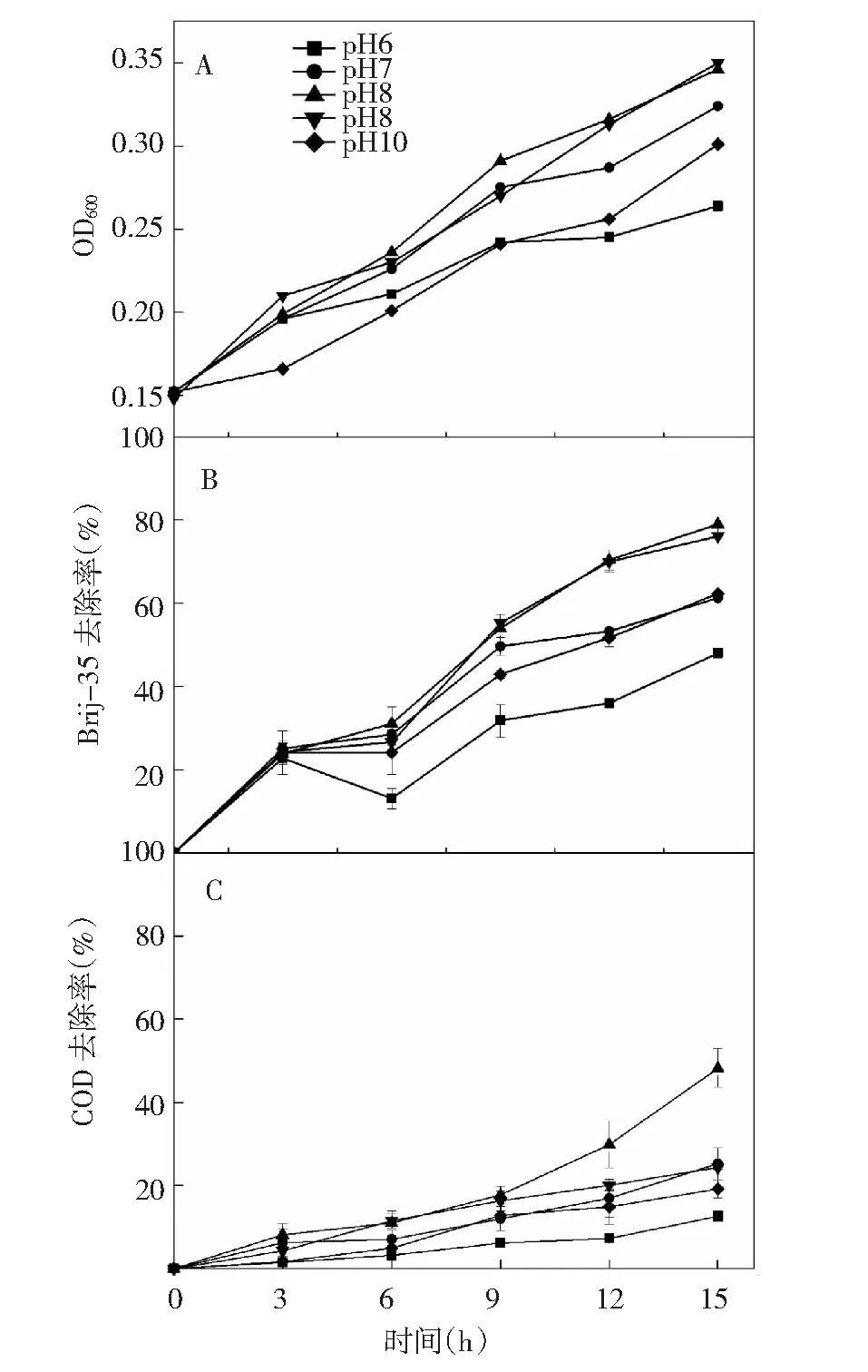
图3 不同pH下YX3的生长曲线、 Brij-35及COD去除率变化研究Fig.3 The growth curve, Brij-35 and COD removal efficiency of strain YX3 under different pH conditions
不同底物浓度下菌株YX3的生长与Brij-35的降解效果如图4所示。由图4A可知,当底物浓度为250~750 mg/L时,15 h内的菌株YX3的生长状况良好,当底物浓度分别为100、1 000 mg/L时,菌体生长受到抑制。由图5B可知,当Brij-35浓度分别为100、250、500、750、1 000 mg/L时,其在15 h内的Brij-35去除率分别为42.65%、72.46%、30.61%、27.31%、24.75%。由图4C可知,当底物浓度为250 mg/L时,COD去除率达到最高50.41%;同时,随着底物浓度的增加,COD的去除率越低,这与Brij-35的降解趋势基本吻合(图4B)。由图4可知,本研究中菌株YX3的最适生长底物浓度为250 mg/L。并且COD的去除率小于Brij-35的去除率,这就说明COD的去除相比Brij-35的降解具有滞后性。其原因可能是,脂肪醇聚氧乙烯醚的初级生物降解主要通过末端烷基链,形成与聚乙基链具有相同长度的聚乙二醇(PEG)与脂肪醇以及由烷基部分产生的脂肪酸三者[36~38],菌株完成初级降解形成的PEG为主要中间代谢产物[37, 39],低温会降低PEG和脂肪醇代谢过程的速度,延长进一步降解的的时间[22],因此COD去除率要低于Brij-35去除率。

图4 不同底物浓度下YX3的生长曲线、 Brij-35及COD去除率变化研究Fig.4 The growth curve, Brij-35 and COD removal efficiency of strain YX3 under different substrate concentrations
3.3 不同pH、底物浓度下菌株YX3的降解动力学
对菌株YX3在不同pH和底物浓度下的Brij-35降解情况进行拟合,结果见表1、表2。不同pH、底物浓度下,菌株YX3对Brij-35的降解情况均符合一级动力学方程,拟合方程相关系数(R2)分别大于等于0.95、0.81,能较好地反映菌株YX3对Brij-35的降解性能。当pH在6.0~8.0时,随着pH的升高,Brij-35降解半衰期(t1/2)由15.25h缩短至7.46 h,并且随着pH值的继续升高,半衰期(t1/2)延长至11.13 h;在底物浓度为100~250 mg/L时,随着底物浓度的增加,Brij-35降解半衰期(t1/2)由19.02 h缩短至8.27 h,并且随着底物浓度的继续增加,半衰期(t1/2)延长至45.55 h。
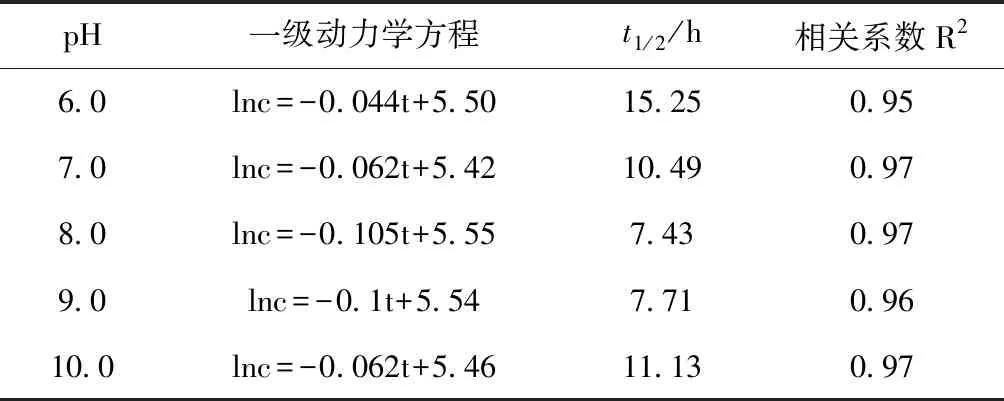
表1 不同不同pH条件下菌株YX3对 Brij-35降解的拟合结果Tab.1 Degradation kinetics of Brij-35 at different pH conditions by strain YX3

表2 不同底物浓度时菌株YX3对Brij-35降解的拟合结果Tab.2 Degradation kinetic of Brij-35 at different substrate concentrations by strain YX3
不同pH和底物浓度均对菌株YX3的降解特性产生影响。一级动力学拟合结果表明,以Brij-35为唯一碳源时,YX3菌株在低温(10℃)下的最适降解条件为:pH 8.0,初始Brij-35浓度为250 mg/L。有研究表明,表面活性剂浓度的增加还会降低生物降解过程的速率和生物降解性[27, 40]。

图5 YX3在最适生长条件下的生长 曲线与Brij-35浓度变化情况Fig.5 The growth curve of strain YX3 under the optimal growth conditions
由图5可知,在菌株最适生长条件(pH 8、Brij-35浓度250mg/L)下,YX3菌经2 h适应期后进入对数生长期,并在18 h达到最大OD600值,随后菌株经过短暂稳定期(18~20 h)后迅速进入衰亡期。整个降解过程中,Brij-35浓度在菌株进入对数期后呈指数下降,后期随着底物浓度的减少降解速率显著减慢。Jurado[40]等人也发现,脂肪醇聚氧乙烯醚浓度在菌株完成适应期后呈指数下降。15 h时Brij-35的去除率达到85.43%,24 h时达到95.80%。拟合降解动力学方程:lnc=-0.148t+5.61,相关系数(R2)为0.98,半衰期(t1/2)为6.1 h。
3.4 菌株YX3对Brij-30的降解效果考察
由图6可知,YX3菌株对Brij-30同样具有降解作用,具有降解广泛性。培养15 h,Brij-30的去除率达94.32%。YX3菌对Brij-30的降解符合一级动力学方程特征,通过拟合得到方程:lnc=-0.189t+5.78,拟合相关系数(R2)为0.93,半衰期(t1/2)为5.04 h。YX3菌株对Brij-30的降解要比Brij-35容易。乙氧基化物长度和烷基链的线性度是影响非离子表面活性剂生物降解性能的基本因素[41]。Brij-30与Brij-35属于具有同类烷基链不同长度乙氧基化合物的非离子表面活性剂。乙氧基化物的长度与环氧乙烷单元(EO)的数量相关,单元数量越多,乙氧基化合物越长,Brij-35具有23个环氧乙烷单元(EO),Brij-30具有4个EO单元。Jurad等[40]对一系列具有不同数量EO单元(3、4、6、11)脂肪醇乙氧基化物进行生物降解特性研究发现乙氧基化物链上环氧乙烷单元EO单元数目越大,达到同样生物降解值所需时间与对应生物降解率的差值似乎越大,即EO单元的数量与降解时间呈正相关,与降解率呈反向关。通过本实验也同样验证了EO数的增加,会使初级生物降解度下降。
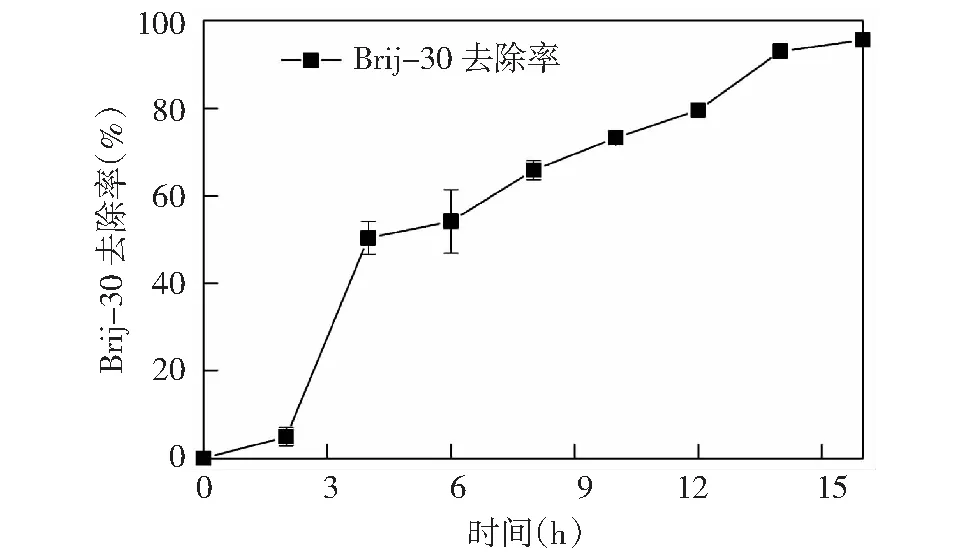
图6 YX3菌对Brij-30生物降解的时程曲线Fig.6 The time history curve of biodegradation processes of Brij-30 by strain YX3
4 结 论
4.1 本文筛选出一株在低温下能高效降解Brij-35的菌株Acinetobactersp.YX3,其GenBank登录号为MK138620。
4.2 菌株YX3的最适pH值8、底物浓度为250 mg/L,24 h的Brij-35去除率最高可以达到95.80%,且随着pH的升高或降低,降解作用均减弱。初始Brij-35浓度的升高有利于YX3菌的生长代谢,但在高浓度(500 ~1 000 mg/L)下菌株降解速度出现明显减慢,菌株生长缓慢。
4.3 菌株YX3对Brij-35的降解在不同pH和初始浓度下均符合一级动力学方程,半衰期(t1/2)最短为7.46 h;其最适生长条件为pH 8,初始Brij-35浓度250 mg/L,此时半衰期(t1/2)缩短至7.46 h。
4.4 菌株YX3对脂肪醇聚氧乙烯醚Brij-30同样具有降解作用,证明该菌株具有降解广泛性。
综上所述,温度是影响微生物活性和降解性能关键因素,而低温对污染物的处理效果有明显抑制作用。本文通过长期低温驯化筛选出一株Brij-35低温高效降解菌,并研究了该菌株在不同pH及底物浓度下的降解性能、降解动力学及底物降解广泛性,为低温下同类型非离子表面活性剂污染物有效处理提供了优质的菌种资源。

