胃癌患者术前氨基转移酶和胆红素及白蛋白水平对预测生存预后的临床意义
王莉杰,王晓军,曹冲,许梦情,马苗苗,岳汶,张丹丹,陶林,张文杰*
(1 石河子大学医学院病理系/新疆地方与民族高发病教育部重点实验室,新疆 石河子 832002; 2 石河子大学医学院第一附属医院,新疆 石河子 832002; 3 中国医学科学院肿瘤医院病理科,北京 100021;4 西安航空发动机公司职工医院内科,陕西 西安 710021)
胃癌已成为全球范围内第五大常见的恶性肿瘤,且排在恶性肿瘤死因的第三位[1],因此胃癌患者预后不佳依旧是个临床难题。胃癌患者术后五年生存率不仅可以评价患者的生存预后,也可以在某种程度上评价手术及术后放化疗的质量。2018年发布的最新五年生存率显示:2010年至2014年,我国胃癌的五年生存率为35.9%,虽然比上一个五年生存率33.2%有所升高,但距离韩国的68.9%和日本的60.3%生存率仍有很大差距[2]。尽管胃癌诊疗技术的提高显著延长了早期胃癌患者的生存率,但大多数胃癌患者诊断时已是中晚期.,导致胃癌总体生存率不理想[3]。胃癌患者术后的病理特征,如:TNM临床分期、细胞分化程度及肿瘤浸润深度等,可直接影响患者的预后[4],但是这些指标无法在术前获得。因此,寻找一种或多种在术前就可以检测并对胃癌患者生存预后有显著影响的指标,可能对医生选择手术方式和术后治疗策略有指导意义,并可提高患者的五年生存率。本研究探讨了胃癌患者术前血液中氨基转移酶、胆红素和白蛋白的水平与临床及病理特征的相关性,并分析它们对胃癌患者生存预后的影响。
1 资料与方法
1.1 病例资料与纳入标准
本研究回顾性收集了310例从2004年1月~2013年6月在本院完成胃癌手术的所有汉族患者(排除患肝脏、心血管等重大疾病的患者)。所有患者都有齐全的个人信息及病理资料,其中男性228例,女性82例;年龄27~86岁,平均年龄(61.57±11.34)岁。所有患者根据美国癌症委员会(AJCC)2010年修订第七版分期指南进行分期,TNM分期(Ⅰ+Ⅱ)期患者174例,(Ⅲ+Ⅳ)期患者136例。
1.2 测量标准和检测项目
要求测量肝功能相关的血液指标前12 h禁水禁食,入院时采集患者空腹静脉血,收集3 mL静脉血加入肝素钠抗凝管,通过离心分离出血浆,运用罗氏自动生化分析仪检测。运用重氮法检测血浆中胆红素的水平。检测指标包括:血清碱性磷酸酶(ALP),血清丙氨酸氨基转移酶(ALT),血清天门冬氨酸氨基转移酶(AST),血清γ-谷氨酰基转移酶(GGT),总胆红素(TBIL),间接胆红素(IBIL),直接胆红素(DBIL),白蛋白(ALB),球蛋白(GLB),白球蛋白比(A/G)。
1.3 诊断标准和参考值范围
体质指数(BMI)按照以下公式计算:BMI=身体质量(kg)/身高(m2),根据《中国成人超重和肥胖症预防控制指南》制订的新的BMI分组,将胃癌患者分为四组:低体重组23人(BMI<18.5 kg/m2);正常体重组128人(18.5 kg/m2≤BMI≤23.9 kg/m2);超重组52人(24 kg/m2≤BMI≤27.9 kg/m2)和肥胖组19人(BMI≥28 kg/m2)。以《中华人民共和国卫生行业标准》制定的参考值范围为标准进行分组。
1.4 随访
随访方式包括电话回访、门诊复查及入户随访。随访截止2016年10月,最长随访时间为151个月,平均生存时间为45.3个月。生存时间从手术当日至患者死亡日,在310例患者中,110例存活,195例死亡,删失数据5例。
1.5 统计分析
将所有数据导入到Excel软件,建立310例胃癌患者术后随访人群的数据库,采用SPSS 22.0软件进行统计学分析。用Spearman等级相关分析胃癌患者术前肝功能指标的血液水平与临床及病理特征之间的相关性;生存风险的单因素及多因素分析采用Cox比例风险回归模型,将单因素分析有意义的指标(年龄、细胞分化、TNM分期、DBIL、ALB、A/G、ALT和AST)纳入多因素分析;应用Kaplan-Meier法绘制生存曲线和描述生存期。P<0.05认为差异有统计学意义。
2 结果
2.1 胃癌患者的生存趋势
自手术之日至随访截止日期,有195例明确死于胃癌。全组患者中位生存时间为42个月,95%的CI为41.17~49.50。1、3、5年生存率分别为76.1%、52.9%和41.6%(图1)。

图1 胃癌患者的生存趋势Fig.1 Survival trend of patients with gastric cancer
2.2 胃癌患者基本情况
310例胃癌患者中:肿瘤浸润深度T1有36(11.5%)例,T2有60(19.4%)例,T3有206(66.5%)例,T4有8(2.6%)例;无淋巴结转移129(41.6%)例,有淋巴结转移181(58.4%)例;无远处转移280(90.3%)例,发生远处转移30(9.7%)例。
临床分期Ⅰ期有70(22.6%)例,Ⅱ期有104(33.5%)例,Ⅲ期有105(33.9%)例,ⅣIV期有31(10.0%)例。
所有肝功能相关指标中ALB和DBIL的异常率最高,分别为54.88%和51.94%;ALP和GLB的异常率最低,分别为6.21%和6.77%(表1)。

表1 310例胃癌患者的术前及术后指标Tab.1 Preoperative and postoperative indexes of 310 patients with gastric cancer
注:标*代表该指标为术后指标,其余则为术前指标。
2.3 TNM分期、DBIL、ALB和ALT是影响胃癌患者生存预后的独立危险因素
将COX单因素回归有统计学意义的变量进行COX多因素回归分析,结果显示(表2):TNM分期Ⅲ+Ⅳ(P<0.001)、高水平的DBIL(P=0.026)、低水平的ALB(P=0.033)、高水平的ALT(P=0.035)和低水平的ALT(P=0.024)均是影响胃癌患者生存预后的独立危险因素。
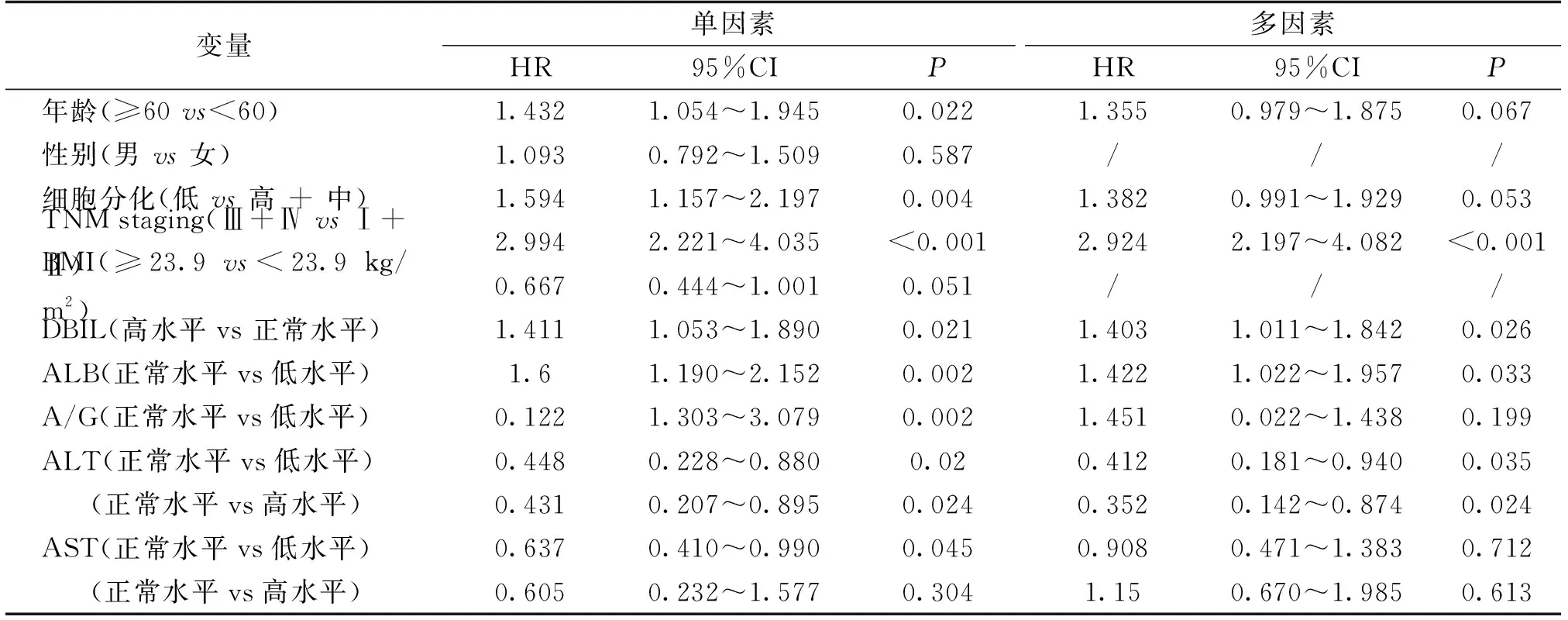
表2 TNM分期、DBIL、ALB和ALT是影响胃癌患者生存预后的独立危险因素Tab.2 TNM staging,DBIL,ALB and ALT are independent risk factors for survival prognosis in patients with gastric cancer
2.4 胃癌患者术前及术后指标对其生存的影响
图2显示,297例胃癌患者中,不同级别的T、N、M及TMN分期与其预后有显著差异,即越高级别的T、N、M及TMN分期患者预后越差(P<0.001)。图3显示,215例胃癌患者中,BMI水平较低是预后不良的因素(P=0.022)。297例胃癌患者中,ALT 水平较高的胃癌患者生存预后较差(P=0.048),AST水平较高的患者生存预后较差(P=0.045),DBIL水平在正常范围内时患者预后较好(P=0.020),ALB水平低于正常范围的患者生存预后较差(P=0.002);296例胃癌患者中,A/G的水平在正常值范围内的患者生存预后与低水平相比较好(P<0.001)。
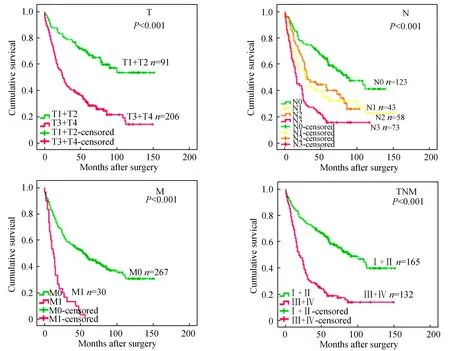
图2 胃癌患者T、N、M及TNM分期对其生存的影响Fig.2 Effects of T,N,M and TNM staging on survival in patients with gastric cancer
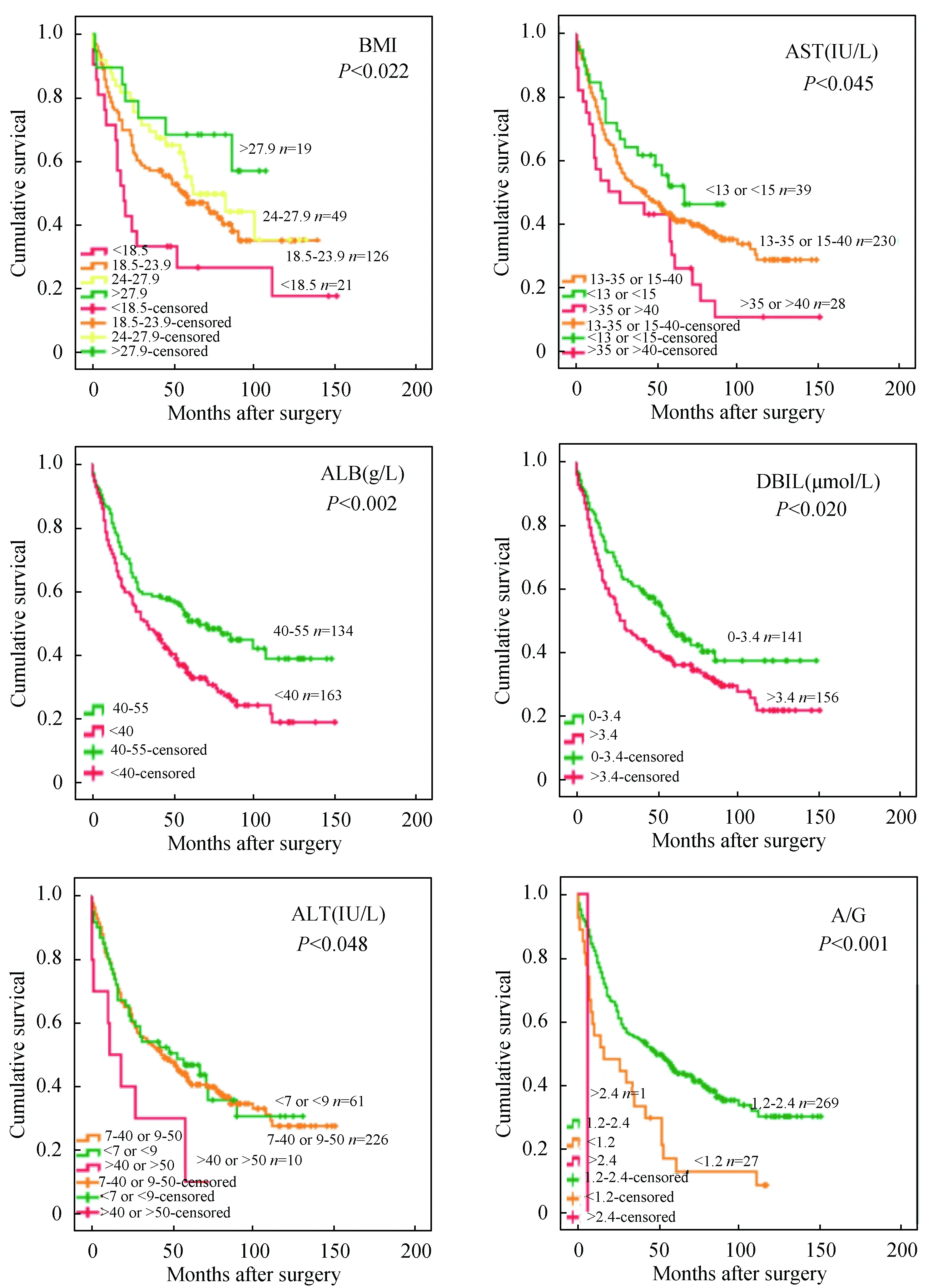
图3 胃癌患者BMI、DBIL、ALB、A/G、ALT及AST水平对其生存的影响Fig.3 Effects of BMI,DBIL,ALB,A/G,ALT and AST levels on survival in patients with gastric cancer
3 讨论
流行病学资料显示,全球每年大约有90多万新发胃癌患者,其中70万以上死于胃癌相关疾病,是严重威胁人类生命主要的恶性肿瘤[5]。
ALT和AST是肝功能检查时最常用的敏感指标,生理状态下主要存在于肝细胞中,当肝细胞受损或死亡时释放入血,从而导致血液中ALT和AST含量增高[6],因此主要用于肝脏疾病的辅助诊断[7]。AST水平能够明显影响胃癌患者的生存预后已有报道[8],但ALT与胃癌患者生存预后的关系却未见报道。本研究表明,高水平ALT的胃癌患者生存预后较差(图3),并发现ALT是影响患者生存预后的独立危险因素(表2)。
胆红素是体内铁卟啉化合物的主要代谢产物,主要以DBIL和IBIL两种形式存在于血液中。胆红素具有抗炎、抗增殖、抗氧化和清除自由基等生理功能,因此胆红素在一定程度上可以抵御肿瘤的发生[9]。一项回顾性研究发现,在II、III期结直肠癌患者中,较高DBIL水平的患者预后较差[10],后续研究进一步证实[11]此结论。我们也发现较高水平的DBIL患者预后较差(图3)。
白蛋白具有多种重要的生理作用,包括维持血液胶体渗透压,运输血浆白蛋白,代谢产物解毒和再加工,还可能具有抗氧化及清除自由基的功能[12]。STENMAN M等[13]的研究结果表明,血清白蛋白可以作为转移性肾细胞癌患者的独立预后因素。LIU等[14]报道,在1320名接受根治性切除术的胃癌患者中,血浆白蛋白水平是独立的预后因素。此外,一项对320名胃癌患者的研究发现,术前白蛋白水平、体重指数、甘油三酯水平与TNM 分期对患者的生存预后具有相当的价值[15]。图3显示,较低的血浆白蛋白水平的胃癌患者其预后较差,且ALB是影响胃癌患者预后的独立危险因素(表2),与先前的研究结果一致。
体质指数(BMI)通常用来衡量肥胖及健康状态。本研究显示,BMI越高,患者生存预后越好。研究[16]发现,高BMI患者术后5年生存率好于低BMI患者,并首次提出BMI是影响胃癌患者预后的独立因素。也有学者研究结果显示:BMI超重组的患者预后最好,正常体重患者与体重较低患者预后比,正常体重患者预后更好[17]。以上两项研究与我们的结论一致。晚期胃癌患者一般BMI较低,因此,BMI可以用来了解患者的总体健康状况以及对手术和放化疗的承受能力。
综上所述,BMI、ALT、AST、DBIL、ALB及A/G的异常对胃癌的生存预后具有明显影响(图3),我们对其机制进行以下探讨:因为肝脏是胃癌最常见的转移部位,发现胃癌患者肝功能指标的异常时,可能在一定程度上提示了与肿瘤相关的分子已经在分子水平转移到肝细胞,从而影响与肝细胞功能相关的指标,进而影响肝细胞的状态并影响胃癌患者的预后,因此,这一现象应引起临床医生警惕。更值得一提的是,上述“分子水平异常”可以在术前常规血液生化检测中发现,是一种简便的术前预警指标。但以上“分子水平异常”仅是我们的猜想,仍需依靠完整的实验进一步寻找其中的证据,以提供理论支持。尽管上述分子参与胃癌患者生存预后的具体机制尚不清楚,但这并不影响我们对这些重要的临床现象进行深入研究。因此,我们推荐:在术前对患者进行保肝治疗,当患者肝功能相关指标恢复到参考值范围内或附近时,再进行手术,可能会提高胃癌患者的术后生存率,由于胃癌手术方案及术后放化疗策略选择的复杂多样,而正确的策略决定治疗的质量和生存时间。我们再次建议,临床上应该充分利用术前获得的检验数据,结合临床及影像诊断(如CT/PET-CT),在术前对胃癌患者进行手术利弊以及生存预后评估,为制定最佳个体化手术方案及术后最佳放化疗方式提供指导,为尽可能提高手术和放化疗质量,提高患者术后生活质量及延长生存时间创造有利条件。

