c-SKI对冠脉内皮细胞增殖及内皮-间充质转化的影响*
王 娟, 幸世峰, 吕忠英, 李 鹏, 李红建, 罗 梅
(新疆医科大学第五附属医院心血管内科, 新疆 乌鲁木齐 830011)
内皮细胞在特定的病理状态下可以向间充质细胞转化,其表型及功能也随之改变,即内皮-间充质转化(endothelial-mesenchymal transition,End-MT)。研究表明End-MT异常活化导致胞外基质(extracellular matrix,ECM)合成增加进而促进心肌纤维化发生,而抑制End-MT则能抑制心肌纤维化进展[1-3]。End-MT涉及很多因素,其调控机制尚有待于研究。c-SKI(cellular Sloan-Kettering Institute)是从Sloan-Kettering逆转录病毒中分离出来的,c-ski原癌基因编码的核蛋白,几乎在所有的哺乳动物组织中存在和表达,对转化生长因子β1(transforming growth factor-β1,TGF-β1)/Smad信号通路存在负性调控作用,具有生物多效性,既往研究表明其在肿瘤、神经系统、创伤修复及糖脂代谢等过程均有重要的作用[4]。亦有研究表明c-SKI可以调控成纤维细胞的表型,从而具有抗纤维化的特性[5],然而c-SKI在End-MT中的作用罕有报道。本研究应用过表达c-SKI进行干预,拟探讨c-SKI在人冠状动内皮细胞(human coronary artery endothelial cells,HCAECs)增殖及End-MT中的作用
材 料 和 方 法
1 主要材料
TGF-β1购自R&D System;携带绿色荧光蛋白(green fluorescent protein,GFP)的c-ski慢病毒载体(克隆号HO003036)构建包装购自湖南赢润生物技术有限公司;10%胎牛血清、0.25%胰酶和左旋谷氨酰胺均购自HyClone;青链霉素双抗溶液购自Gibco;DMEM/F12培养基购自Invitrogen;MTT和DMSO均购自Sigma;RIPA 裂解液、BCA蛋白定量分析试剂盒和Pierce ECL化学发光底物显色剂均购自Thermo Fisher;抗E-钙黏蛋白(E-cadherin, E-cad)、Smad2、Smad3、p-Smad2、p-Smad3和GAPDH抗体均购自Cell Signaling Technology;抗c-SKI、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和波形蛋白(vi-mentin)抗体购自Abcam;辣根过氧化物酶标记的 II 抗购自Santa Cruz;TRIzol RNA提取试剂购自TaKaRa;RT-qPCR引物序列合成由上海生工生物有限公司完成。
2 主要方法
2.1细胞培养及感染 HCAECs购自Lonza。用10%胎牛血清DMEM/F12培养基(含有1×105U/L青霉素和100 mg/L链霉素),于CO2培养箱内培养(37 ℃、5% CO2)。培养至汇合状态,再用0.25%胰酶和0.02% EDTA混合液消化、传代,至2~5代用于实验。细胞融合70%左右,换用无血清培养基饥饿6 h,随后进行细胞感染。在6孔板中按每孔1×106个细胞接种,病毒滴度为1×108TU/L进行感染,观察细胞状态,感染48 h后进行转染效率鉴定并进行后续实验。
2.2MTT实验 将HCAECs以每孔2×104个接种于96孔板中,培养24 h,使用TGF-β1刺激或不刺激后分别用过表达c-SKI慢病毒(LV-SKI)和对照病毒(LV-NC)感染细胞。加入MTT至终浓度为0.5 g/L,将细胞在37 ℃下温育4 h。通过微量板读数器(Bio-Rad)测量490 nm处的吸光度(A)值。每个实验重复3次。
2.3集落形成实验 在给予或不给TGF-β1刺激的情况下,分别用过表达c-SKI慢病毒和对照病毒感染HCAECs。将细胞悬浮在含有0.35%琼脂糖的低熔点RPMI-1640中,以每皿1×105个细胞接种在0.6%琼脂糖的6孔板中。将平板在37 ℃、5% CO2培养箱中培养2周,用0.1%结晶紫溶液染色后统计集落数量。
2.4RT-qPCR实验 用TRIzol试剂盒按说明书提取HCAECs总RNA,逆转录为cDNA,后以cDNA为模板进行PCR扩增。加入SYBR Premix Ex Taq,进行实时定量PCR。采用荧光定量 PCR仪扩增检测相关基因的表达水平,GAPDH作为内参照。采用 2-ΔΔCt方法分析结果,每组3个复孔,实验重复3 次。c-SKI的上游引物序列为5’-AGCACCGAGTTGAGAATCTGC-3’,下游引物序列为5’-ACTGGAAGGCGAGACCATCT-3’;GAPDH的上游引物序列为5’-GGCTGTTGTCATACTTCTCATGG-3’,下游引物序列为5’-GGAGCGAGATCCCTCCAAAAT-3’。
2.5Western blot实验 在不同处理后,收获HCAECs并用裂解缓冲液匀浆,使用BCA蛋白质测定试剂盒测量蛋白质浓度。通过8%~10% SDS-PAGE分离蛋白质(30 μg),转PVDF膜。使用抗c-SKI、α-SMA、E-cad、vimentin 和GAPDH特异性 I 抗(1∶1 000),抗Smad2和Smad3特异性 I 抗(1∶2 000)及抗p-Smad2和p-Smad3特异性 I 抗(1∶1 000)孵育,用5%脱脂奶粉封闭。后将膜进一步与相应的辣根过氧化物酶标记的 II 抗(1∶5 000)一起温育2 h,TBST洗膜3次,以ECL化学发光底物显色后成像,ImageJ软件分析测试结果。
3 统计学处理
应用SPSS 22.0软件对实验数据进行分析,用GraphPad Prism 6.0进行作图。实验数据用均数±标准差(mean±SD)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 c-SKI在TGF-β1诱导的HCAECs中的表达
通过Western blot检测TGF-β1刺激后HCAECs中c-SKI的表达水平,结果显示,分别给予不同浓度TGF-β1(0、1、2.5和5 μg/L)作用48 h后,c-SKI的表达呈剂量依赖性下降,与空白对照组比,5 μg/L浓度组的HCAECs中c-SKI表达下降最显著(P<0.01),见图1A。后选择5 μg/L浓度的TGF-β1继续实验,分别作用于HCAECs 0 h、12 h、24 h和48 h,Western blot检测显示,c-SKI的表达呈时间依赖性下降,处理48 h后c-SKI表达下降最显著(P<0.01),见图1B。

Figure 1. The expression of c-SKI in the HCAECs treated with TGF-β1. A: Western blot analysis of c-SKI expression in the HCAECs treated with TGF-β1 at different concentrations; B:Western blot analysis of c-SKI expression in the HCAECs treated with TGF-β1 at 5 μg/L for different times. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μg/L group;#P<0.05;##P<0.01vs0 h group.
图1 c-SKI在TGF-β1诱导下的冠脉内皮细胞中的表达
2 不同浓度TGF-β1对HCAECs内皮-间充质转化的影响
不同浓度的TGF-β1作用于HCAECs 48 h后,Western blot检测End-MT关键标志物的表达。结果显示,与空白对照组相比,TGF-β1组细胞中E-cad蛋白表达呈剂量依赖性下调,而vimentin和α-SMA表达呈剂量依赖性上升,5 μg/L浓度时效果最为显著(P<0.01),见图2。
3 HCAECs过表达c-SKI的效率检测
将c-SKI过表达慢病毒感染冠脉内皮细胞,48 h后用倒置荧光显微镜可见,病毒转染细胞呈现绿色荧光,转染率在80%以上,见图3A。RT-qPCR检测结果显示,与对照病毒组相比,转染后的HCAECs中c-SKI的表达水平显著上调(P<0.01),见图3B。
4 过表达c-SKI对HCAECs增殖的影响
使用MTT和集落形成实验分别检测HCAECs的增殖情况。MTT实验结果显示,与LV-NC+TGF-β1组相比,过表达c-SKI可显著抑制TGF-β1诱导的HCAECs活力(P<0.01),见图4A。集落形成实验结果显示,与LV-NC+TGF-β1组相比,过表达c-SKI可以减少HCAECs的集落形成数量(P<0.01),见图4B。
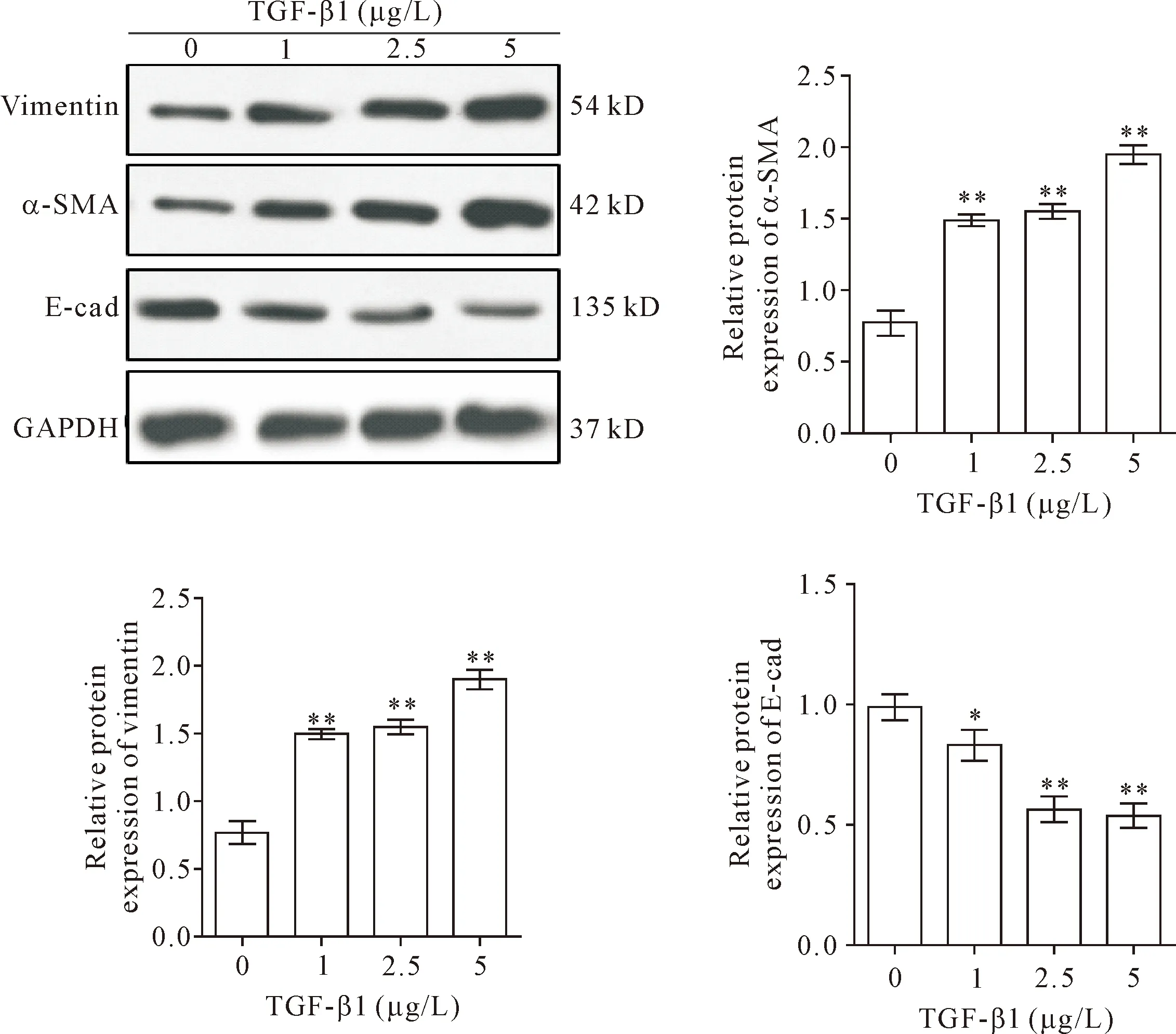
Figure 2. Western blot analysis of vimentin, α-SMA and E-cadherin (E-cad) in the HCAECs treated with TGF-β1 at different concentrations. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μg/L group.
图2 Western blot检测TGF-β1对HCAECs中vimentin、α-SMA及E-cadherin表达的影响
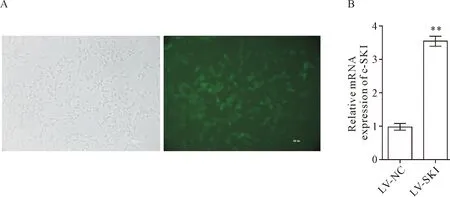
Figure 3. Detection of LV-SKI transfection efliciency. A: the images of green fluorescent protein expression for observing the efficiency of LV-SKI transfection (48 h after transfection, ×200); B: the mRNA expression of c-SKI after infection was detected by RT-qPCR. Mean±SD.n=3.**P<0.01vsLV-NC group.
图3 慢病毒c-SKI过表达载体感染效率鉴定
5 过表达c-SKI对HCAECs内皮-间充质转化分子标志物的影响
采用Western blot检测各组细胞End-MT相关分子标志物vimentin、α-SMA及E-cad蛋白的表达。结果显示,与空白对照组比,TGF-β1组和LV-NC+TGF-β1组的HCAECs中vimentin和α-SMA的蛋白表达均显著增加,E-cad蛋白表达下调(P<0.01),TGF-β1组和LV-NC+TGF-β1组HCAECs中α-SMA和E-cad蛋白表达无明显变化。与LV-NC+TGF-β1组相比,LV-SKI+TGF-β1组HCAECs中可见vimentin和α-SMA蛋白表达显著下调,而E-cad蛋白表达水平明显增加(P<0.01),见图5。

Figure 4. The effect of c-SKI on HCAECs proliferation. A: the changes of the cell viability; B: the images and quantitative analysis of the colony formation assay. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;##P<0.01vsLV-NC+TGF-β1 group.
图4 过表达c-SKI对冠脉内皮细胞增殖的影响

Figure 5. Expression of vimentin, α-SMA and E-cadherin (E-cad) in the HCAECs treated with TGF-β1. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsLV-NC+TGF-β1 group.
图5 Western blot检测vimentin、α-SMA及E-cadherin的表达
6 过表达c-SKI对TGF-β/Smad信号通路的影响
采用Western blot检测TGF-β/Smad信号通路关键信号分子Smad2和Smad3蛋白的磷酸化情况。过表达c-SKI后,各组细胞Smad2和Smad3的蛋白水平无明显变化;与LV-NC+TGF-β1组对比,LV-SKI+TGF-β1组的p-Smad2和p-Smad3蛋白水平显著下调(P<0.01),见图6。
讨 论
End-MT是一种受到高度调节的病理过程,涉及内皮功能障碍、炎症以及多个信号通路,已被确定为调节纤维化进程的关键机制[6-7]。在压力负荷诱导的心肌纤维化小鼠模型中,抑制End-MT可以抑制心肌纤维化改善心肌重构[8],在TGF-β1诱导的End-MT研究中发现了类似的结果[1]。Kato等[9]检测了心房颤动患者纤维化的心房组织,发现了End-MT的转录因子以及能产生胶原的间质细胞表型,在人体方面证实了End-MT参与了心肌纤维化。重要的是,在疾病进程中End-MT的过程是动态的,间质细胞可以向内皮方向逆向转化[10]。因此,逆转End-MT可以为心肌纤维化及其他心血管疾病提供新的思路,值得进一步深入研究。

Figure 6. Expression of p-Smad2, p-Smad3 in the HCAECs treated with TGF-β1. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;##P<0.01vsLV-NC+TGF-β1 group.
图6 Western blot检测p-Smad2和p-Smad3蛋白水平的变化
c-SKI是SKI蛋白家族的一员,在正常心肌组织中含量较低,但作为转录调节因子具有广泛的生物学效应。c-SKI能够作为靶基因参与调节心肌成纤维细胞和ECM的合成[11],在心肌细胞H9C2中沉默c-SKI的表达可以促进TGF-β1诱导的上皮-间充质转化(epithelial-mesenchymal transition,EMT)[12]。由此可见,c-SKI在心肌纤维化和EMT中均有重要的作用,但目前关于其对HCAECs以及End-MT的影响研究甚少。
最新研究发现,内皮细胞是成年大鼠心脏细胞中非心肌细胞数量最多的类型,其发生End-MT是心肌纤维化的关键因素[13],而TGF-β1作为促进纤维化的重要因子,在End-MT中也有同样重要的作用[14]。因此,本研究使用TGF-β1诱导HCAECs进行实验。采用不同浓度的TGF-β1处理HCAECs,观察内源性c-SKI表达变化,并验证TGF-β1对HCAECs中End-MT的诱导效应。结果发现TGF-β1可以抑制c-SKI的表达,呈剂量及时间依赖性,同时HCAECs表现出End-MT表型,由此可见,上调TGF-β1表达及下调c-SKI表达协同促进了内皮-间充质转化的发生。据报道,低浓度(0.25~2 μg/L)的TGF-β1便足以诱导End-MT的发生,而5 μg/L效果比10 μg/L更为显著[15],本研究结果与报道一致。此外,MTT和集落形成实验结果表明c-SKI能够抑制TGF-β1诱导的HCAECs增殖,与c-SKI抑制心肌成纤维细胞增殖的研究结果类似[12]。但c-SKI调控细胞增殖的作用具有双重性,在皮肤瘢痕愈合中,c-SKI能够促进真皮中成纤维细胞增殖[16],提示c-SKI在不同病理条件下作用存在差异性。c-SKI与TGF-β/Smad信号通路的关系既往已有研究。在生理状态下c-SKI能够适当限制Smads介导的基因转录,避免机体产生过多的TGF效应。在心肌纤维化病理进程中,c-SKI负性调控TGF-β/Smad信号通路是抑制胞外基质产生的重要机制[5],而在内皮细胞调控中,Smad2和Smad3又是介导TGF-β通路的关键效应蛋白[17]。本研究结果发现,c-SKI过表达可以抑制HCAECs中p-Smad2和p-Smad3蛋白的表达,提示c-SKI抑制HCAECs增殖及End-MT的机制可能与抑制TGF-β/Smad信号通路的活性有关。而Li等[18]的最新研究有不一样的发现,提出c-SKI并不是通过经典的TGF-β/Smad信号通路,而是通过ERK/CREB信号通路在TGF-β1诱导的细胞增殖中起关键调节作用。c-SKI的调节作用广泛涉及多个信号通路,需要更多的研究去探讨。
综上所述,本研究初步发现,在HCAECs中TGF-β1能剂量时间依赖性抑制c-SKI的表达,诱导HCAECs发生表型转化,使其失去原有内皮细胞特异性抗原,表达间充质细胞转化特有抗原。而过表达c-SKI可以抑制冠脉内皮细胞增殖,并且抑制HCAECs中vimentin和α-SMA蛋白表达而增强E-cad蛋白的表达,从而部分逆转TGF-β1诱导的End-MT。本研究还存在一定的不足和局限性,不同的诱导时间或条件下TGF-β1对细胞可能存在双向调节效应,而本实验观察的时间窗有限,延长诱导时间后是否仍有一致的作用有待进一步观察,并且该研究需要在动物实验中继续验证。

