锌镍单液流电池二维瞬态放电模型
姚寿广,赵倩,赵云辉,孙晓飞,程杰
1 江苏科技大学能源与动力工程学院,江苏镇江212003
2 张家港智电芳华蓄电研究所有限公司,江苏张家港215600
0 引 言
环境污染的加剧使得人们越来越关注清洁能源的利用,但是太阳能、风能等清洁能源往往具有间歇性和波动性,直接并入电网或者持续利用都很困难。因此,储能技术是清洁能源得以广泛应用的关键[1-2]。目前的储能主要集中在电化学系统上[3-4],电化学储能的特点是容量区间大,环境适应性强。液流电池(Flow battery,FB)因存储效率高、性能卓越、安全可靠性好以及操控灵活等特点而具有广阔的应用前景。其中,锌镍单液流电池因具有较高的开环电压和能量密度[5],且结构简单、成本较低,近年来获得了广泛关注。针对锌镍单液流电池的安全性、可靠性,研究者们在电池的结构、电解液性质、运行条件和副反应方面做了大量的基础实验研究[6-11]。尽管如此,在实现锌镍单液流电池大规模应用上还面临很多挑战,例如规模组建和性能优化。建模与仿真是解决这些问题行之有效的方法之一,与实验研究相比其成本更低,研究周期更短。通过建模与仿真对锌镍单液流电池基本过程进行研究,有助于优化电池设计和运行条件,加快储能电池的发展进程。
相对于发展较快的全钒液流电池[12-13],锌镍单液流电池的建模与仿真研究还处于起步阶段,近年来发展了一些模型。宋印东等[14]建立了锌镍单液流电池电堆流场分析的三维模型,并基于引入的不均匀性系数γ进行了电堆内部流场分布及流速不均匀性分析。Xiao 等[15]综合考虑电池内部流动、反应与传质,建立了锌镍单液流电池三维稳态模型,分析了离子浓度和电流密度的空间分布,研究了流道宽度、流速对电池电化学性能的影响。Yao 等[16]从数学角度出发,通过耦合反应速率方程和平衡电势方程建立了锌镍单液流电池电堆的纯数学模型,研究了充电过程中的电堆电压和电极过电位,通过与实验数据对比验证了数学模型的可靠性。然而到目前为止,对于锌镍单液流电池还没有一个完整的物理模型来描述内部多物理场的动态变化规律,并能准确预测电池的外部特性。
本文致力于建立一个完整的锌镍单液流电池二维瞬态等温模型,用于描述电池内部电荷、质量和动量传递以及涉及离子反应的反应动力学过程;在与实验数据对比证明模型可靠性基础上,考察内部流场、浓度场的空间分布及变化规律,探究流速、离子初始浓度的影响;以便为锌镍单液流电池的进一步研究以及优化奠定基础。
1 电池原理和结构
锌镍单液流电池的单体主要包括电极、极板间流道、泵、储液罐及电解液。其工作原理如图1所示,正极、负极共用同一种电解液,电解液由含氢氧根离子和锌离子的氢氧化钾溶液组成,并通过泵在电池单元中循环。正、负极中的反应分别如式(1)和式(2)所示:
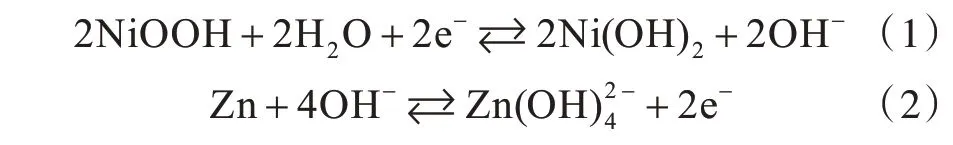
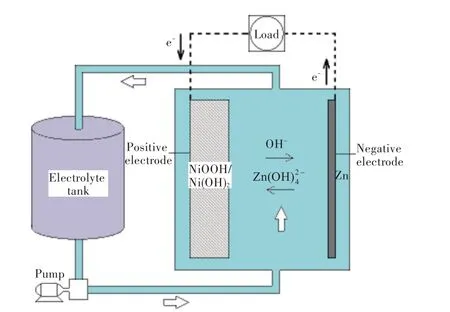
图1 锌镍单液流电池工作原理图Fig.1 Working principle diagram of zinc-nickel single flow battery
2 数值模型
本文研究电池的放电过程,将实际电池单元简化为二维模型,所建模型包括正极(多孔活性层)、流道和负极边界,如图2 所示,模型尺寸如表1 所示。图中:L 为电极高度;l=L/2。

图2 电池几何模型Fig.2 Geometric model of battery

表1 模型尺寸Table 1 Dimensions of the model
2.1 模型假设
模型假设条件如下:
1)电解液是稀溶液,流动为不可压缩层流。
2)将NiOOH 向Ni(OH)2转变的过程看成是质子在固相中产生和传递的过程,质子浓度与电池荷电状态θ有关,其关系如式(3)所示。

式中:cH为Ni(OH)2浓度;cmax为Ni(OH)2的最大浓度。
3)电极和电解液的物理性质是各向同性和恒定的,且不考虑温度、副反应的影响。
4)储罐内的电解液充分混合。
5)负极导电率很高,因此忽略电极中的电位梯度,几何模型中不考虑负极厚度。
2.2 传质方程
流道内电解液的流动是稳态的层流流动[15],采用Forchheimer 修正的布林曼方程[17]描述多孔域中的流动:
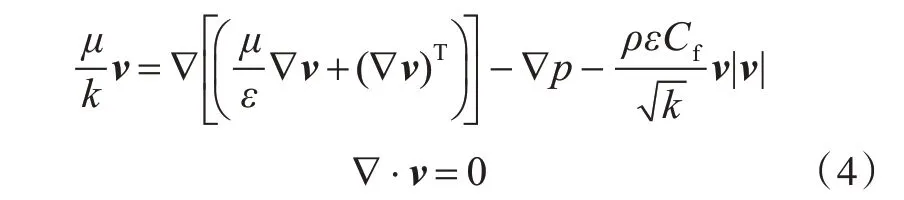
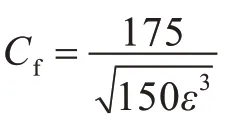
离子在液相中传递的物质守恒方程为

式中:ci为物质i的浓度;Ni为物质i 的浓度通量,根据Nernst-Planck 方程[15],它包括扩散项、迁移项和对流项。多孔电极中的扩散系数根据Bruggemann 关系校正;Si为物质i的源项。
固相质子在活性物质内的控制方程为
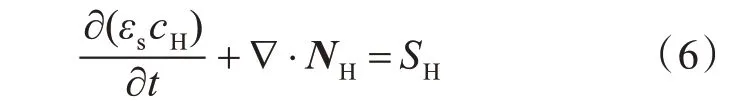
式中:εs为固相活性物质的体积分数;SH为质子的源项;NH为质子通量。
用Fick 定律来描述宏观上质子沿电极厚度方向的传递:
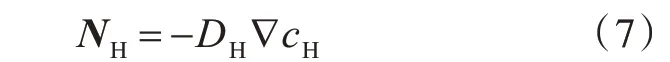
式中,DH为质子扩散系数。
电化学反应过程中物质的源项如表2 所示。表中:ae为正极活性比面积;j1为正极的转移电流密度;F为法拉第常数。
2.3 电荷守恒方程
电解液总电流密度满足:


表2 电化学反应过程中物质的源项Table 2 Source terms for species in the positive and negative electrodes
式中:Ii为物质i 的电流密度;zi为物质i所带电荷数;Di为物质i的扩散系数;φl为液相电位;keff为有效电导率,其表达式为

式中:R为气体摩尔常数;T为温度。
多孔电极内固相中的电流密度Is根据欧姆定律计算:

式中:σs,eff为固相有效电导率;φs为固相电位。
多孔电极内液相扩散系数和固相电导率根据Bruggemann 关系校正:

式中,σs为固相电导率。
电极内电荷传递满足守恒定律:

2.4 反应动力学方程
正极反应发生在内部固相表面,负极反应发生在电极表面,电极的电化学反应可用巴特勒—沃尔默(Butler-Volmer)方程[17]描述:


正、负极的过电位定义如下:

式中,U1采用修正的Nernst 方程,U2完全按照Nernst方程计算:

2.5 边界条件
对于动量守恒方程,电解液在电池单元内是稳态流动,设置均匀的入口流速vin,出口压力为Pout,所有固壁边界条件均设置为无滑移,方程如式(19)所示。

式中:P为电解液压力;n为垂直于壁面的单位矢量。
电解液从电池流出,流入储罐,经充分混合,再次从入口处流回电池。浓度边界设置如下:

式中:Ninlet,Noutlet分别为入、出口边界上离子的摩尔通量;cOHin和cZnin分别为电池流道入口处的氢氧根离子和锌离子浓度;cOHint和cZnint分别为初始氢氧根离子和锌离子浓度;S为电池流道进出口面积。
在放电过程中,多孔电极及负极表面电压分布的通量条件如下:

式中,I为施加的电流密度。
根据电荷守恒方程,离开固相的电荷量等于进入液相的电荷量。因此,电解液电势分布的边界条件是:
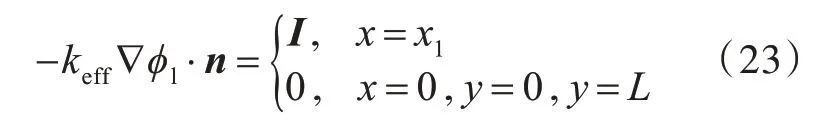
负极接地,负极与电解液接触面边界条件为

用于模拟仿真的参数,如表3 所示。

表3 锌镍单液流电池有限元法多场耦合计算参数Table 3 Multi-field coupling calculation parameters of zinc-nickel single flow battery by finite element method
3 结果与讨论
3.1 模型验证

图3 放电过程不同SOC 下电池模拟电压与实验值的对比Fig.3 Comparison of simulated and experimental values of the cell voltage at different SOCs
为了验证模型的准确性,以100 A/m2的电流密度进行恒流放电,电解液初始氢氧根离子浓度是11 000 mol/m3,锌离子浓度是300 mol/m3,储罐容积是6 × 10-5m3。图3 给出了不同荷电状态(State of Charge,SOC)下电压分布与实验值对比,以及模拟结果与实验结果的误差分析。结果表明,模拟值与实验值吻合良好,平均误差不超过1.15%,部分参数(如传质系数)被视为定量可能是造成其误差的主要原因。在SOC 小于0.1 时产生的误差较大,可能是放电末期实际浓差极化和电化学极化变化太快造成的。
3.2 流速的影响
电池运行时,电解液流量不宜过高或过低[18]:流速太低会造成循环效率低,电池内部浓度极化,流速太高则会增大耗功和产生安全隐患。以300 A/m2的电流密度进行放电模拟,不同流量下的放电曲线如图4 所示。当流量由2.85 mL/s 增大到5.70 mL/s,再由5.70 mL/s 增大到8.55 mL/s 时,前者电压平均增大了0.011 V,后者电压平均增大了0.007 9 V。显然,增大流量有利于提高放电电压,但是电压提升幅度较小,即随着流量增大,大流量对电压的积极作用在衰减。
在流量为5.70 mL/s、电池稳定运行时,开放流道和多孔介质的速度场分布如图5 所示。流动呈抛物线速度剖面,流道中央速度最大,负极壁面及多孔电极远流道侧速度为0。在入口和出口处由于流道变窄,多孔介质内流动变化较大,附近流道内也受到轻微的影响。图上还显示多孔壁上的速度有轻微的扰动,表明动量通过粘性效应传递。图6 所示为剖面l 处的流速分布。由图可知,流量每增大一倍,流道中间流速随之增大一倍,多孔电极内各点速度也增大了一倍。表明增大电解液流量,可以有效加强多孔电极内部的对流传质。
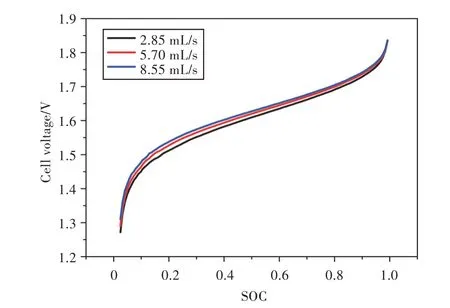
图4 电流密度为300 A/m2时,不同流量下电池电压随SOC 的变化Fig.4 Changes of cell voltage with SOCs for applied current density of 300 A/m2at different flow rates

图5 电解液流速分布Fig.5 Electrolyte flow rate distribution

图6 电池内部沿线l的流速分布Fig.6 The velocity distribution along the line l inside the battery
在电池放电中期(SOC=0.5),不同流量下l 处的离子浓度分布如图7 所示。由图可知,流量增大后,流道内电解液本体浓度也增大了,这说明流动影响电化学反应速率。反应速率的变化必然影响放电过程离子产生或者消耗的总量,离子浓度区间的变化如图8 所示,各氢氧根离子浓度区间之间平均相差990 mol/m3,各锌离子浓度区间之间平均相差163 mol/m3。流量每增大(或减小)0.5倍,氢氧根离子浓度区间减小(或增大)36%~41%,锌离子浓度区间增大(或减小)6.5%~6.6%,即流量越大,氢氧根离子的浓度区间越小,锌离子的浓度区间越大,而且氢氧根离子区间减小的幅度远远大于锌离子增大的幅度。这说明增大流速促进了负极产生锌离子、消耗氢氧根离子的反应,加剧了多孔正极表面氢氧根离子的生成,其中对正极反应的作用更大。图8 表明,随着流量增大,反应区的离子浓度梯度减小了。这是因为虽然增大流量促进了正极氢氧根离子和负极锌离子的产生,但是大流量加强了对流传质,使浓度趋于均匀。

图7 放电中期,不同流量下l处离子浓度分布Fig.7 Distribution of ions concentration at l for different flow rates at 50% SOC
3.3 离子浓度的影响

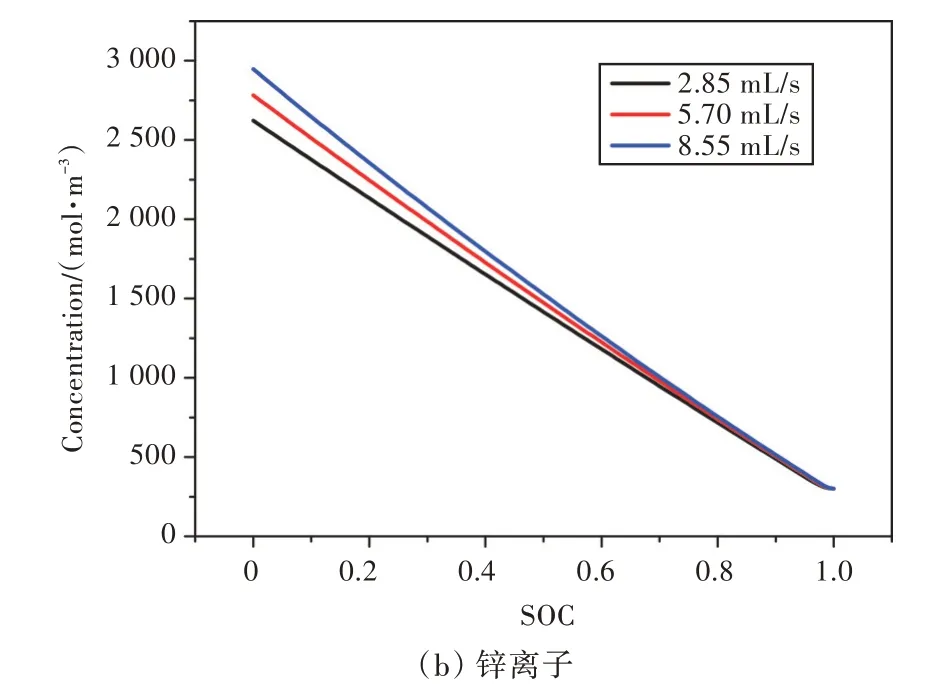
图8 放电过程中,不同流量下的离子入口浓度Fig.8 Inlet ions concentrations with different flow rates during discharge
图9 示出了锌镍单液流电池在放电电流密度为300 A/m2和流量为5.7 mL/s 条件下,离子初始浓度对电池放电电压的影响。研究表明,随着氢氧根离子初始浓度由9 000 mol/m3增大到11 000 mol/m3,电池的平均放电电压提升了0.027 V。研究同时发现,当锌离子初始浓度增大200 mol/m3,放电电压平均降低了0.002 V。因此,适当增大氢氧根离子初始浓度有利于提升电池的放电电压,而较大的锌离子初始浓度不利于提升放电性能。Cheng等[8]通过实验研究发现,锌离子在一定程度上降低了充电电压,其在放电过程可能也有相同的作用。

图9 不同离子初始浓度下的放电曲线Fig.9 Discharge curves at different ions initial concentrations
反应过程中,正极产生氢氧根离子并向电解液本体传递,供给负极消耗。同时,负极反应产生锌离子并向流道方向传递。当以300 A/m2进行恒流放电时,放电中期(SOC=0.5)的离子浓度分布如图10 所示。由图可知:主流区为对流传质区,离子浓度分布均匀,而多孔介质部和靠近负极壁面处流速很小,扩散控制了传质过程,浓度梯度较大;而且锌离子的扩散系数远小于氢氧根离子,所以负极表面的锌离子浓度梯度也远大于正极内部氢氧根离子的浓度梯度。放电中期电池半高处(l处)氢氧根离子的浓度分布如图11 所示。由图可知,初始浓度增大使电解液本体浓度增大,即离子浓度区间发生了改变(图8),虽然浓度区间宽度几乎没有改变,但区间内浓度值整体提高了。此外,图12 中不同初始离子浓度对应的曲线斜率不变,表明在这两种不同的放电过程中离子的产生速率相同,即电极表面的反应速率没有发生变化;而图11 中所展现的不同氢氧根离子初始浓度在反应区即多孔电极内部和负极表面的离子浓度梯度相同也恰恰证明了这一点。锌离子初始浓度变化的影响与氢氧根离子相似,此处不再赘述。
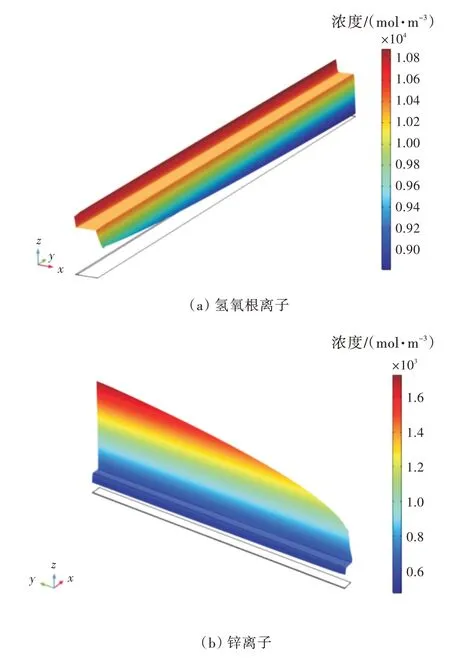
图10 放电中期氢氧根离子和锌离子浓度分布Fig.10 Hydroxide ion and zinc ion concentration distribution at 50% SOC
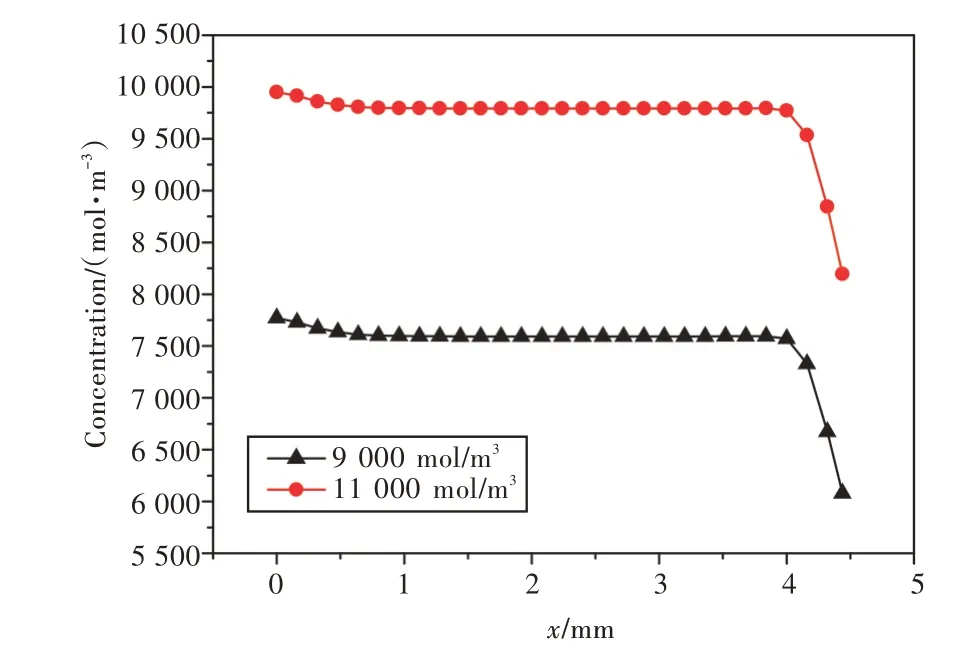
图11 放电中期l处氢氧根离子浓度分布Fig.11 Distribution of hydroxide ion concentration along l at 50% SOC

图12 放电过程中,氢氧根离子入口浓度的变化Fig.12 Changes of hydroxide ion inlet concentration during discharge
4 结 语
本研究开发了一个锌镍单液流电池的二维等温瞬态模型,模型基于基本的守恒方程,包括电荷、质量和动量方程以及涉及离子、质子反应的电极动力学方程。模拟结果与实验数据的对比验证了模型的准确性。
运用模型研究了电池内部反应与传质过程,研究表明:增大流量有利于提高放电电压,但是电压提升幅度较小,而且随着流量增大,大流量对电压的积极作用在衰减。流量每增大一倍,流道中间流速随之增大一倍,多孔电极内各点速度也增大了一倍。流量越大,氢氧根离子的浓度区间越小,锌离子的浓度区间越大,即大流速促进了负极锌离子产生、氢氧根离子的消耗,加剧了多孔正极表面氢氧根离子的生成。流量每增大(或减小)0.5 倍,氢氧根离子浓度区间减小(或增大)36%~41%,锌离子浓度区间增大(或减小)6.5%~6.6%。大流量同时也加强了对流传质,使浓度分布总体趋于均匀。
改变初始离子浓度,对应的离子浓度区间整体增大或减小,不影响其他离子浓度区间。初始离子浓度变化不影响反应速率,继而对浓度分布均匀性也没有影响。增大氢氧根离子初始浓度有利于提升电池放电电压,当氢氧根离子初始浓度由9 000 mol/m3增大到11 000 mol/m3,即离子初始浓度提高22%时,放电电压平均提升了0.027 V。较大的锌离子初始浓度则不利于提升放电性能。

