急性胰腺炎的影像术语:急性胰周液体积聚与急性坏死性积聚(一)
肖波,张小明,徐海波
急性胰腺炎(acute pancreatitis,AP)是一种常见的消化系统急腹症,临床上以急性发作的上腹部疼痛伴/不伴恶性、呕吐就诊。胆石症、酗酒、高脂血症是被广泛认可的三大致病因素[1-4]。
临床大多急性胰腺炎患者可依据临床表现和实验室检查作出早期诊断,而不必常规依赖影像学检查。但当患者出现或疑似以下情况时,需尽早行影像学检查明确诊断:①急性胰腺炎症状不典型,同时血胰脂肪酶和胰淀粉酶未超过正常上限值的3倍;②与其他急腹症如空腔脏器穿孔、急性胆囊炎、急性阑尾炎、肠梗阻等难以鉴别时;③需明确是否为胆源性胰腺炎,了解胆囊结石伴或不伴胆管结石的情况以指导治疗;④患者病情持续不缓解,怀疑发生胰腺坏死,了解坏死严重程度和范围;⑤排除由胰腺导管腺癌或胰腺导管内乳头状粘液瘤继发的急性胰腺炎[1-4]。随着急性胰腺炎2012年新亚特兰大分类标准[1]在临床诊疗、科学研究及多学科交流中的逐步应用,使影像科医生在相关诊断中扮演着至关重要的角色。笔者在每日的临床工作中发现在急性胰腺炎的诊疗报告中依然存在较多的“错误术语或术语不当”,这可能与“新亚特兰大分类观念的缺乏”和“对某些局部并发症鉴别诊断认识不足”有关。鉴于此,笔者分两大部分分别介绍急性胰腺炎的早期局部并发症(第一部分:急性胰周液体积聚与急性坏死性积聚的CT/MRI鉴别诊断)和后期局部并发症(第二部分:假性囊肿与包裹性坏死的CT/MRI鉴别诊断),旨在澄清相关影像学术语,以利于日常影像学报告的规范化书写和相关学术交流。本文着重阐述急性胰腺炎的早期局部并发症(症状发作后4周以内)即急性胰周液体积聚(acute peripancreatic fluid collection,APFC)与急性坏死性积聚(acute necrotic collection,ANC)的CT/MRI鉴别诊断思路。
急性胰腺炎的临床影像学诊断思维
参照新亚特兰大分类,有关急性胰腺炎的临床诊断思维流程图如图1所示。
急性胰腺炎相关液体积聚APFC/ANC的来源
病理学急性胰腺炎被经典地划分为:间质水肿性胰腺炎(Interstitial edematous pancreatitis,IEP)与急性坏死性胰腺炎(Acute necrotizing pancreatitis,ANP)两型。而后者在新亚特兰大分类中又被细分为3个亚型:①胰腺实质坏死和胰周组织坏死同时存在,该型约占所有急性坏死性胰腺炎的80%;②仅胰周组织坏死(胰腺本身无坏死)约占15%;③仅胰腺实质坏死(无胰周组织的坏死)仅占5%左右[1-4]。IEP的CT/MRI诊断标准是胰腺体积局限性或弥漫性增大,但胰腺实质的密度或信号基本均匀,增强后胰腺内没有无强化的病变,同时胰周积液均质、无混杂的软组织样/脂肪样密度或信号影。ANP的CT/MRI诊断标准为发现胰腺内外存在坏死组织,即增强扫描(通常发病3d后检查更可靠)胰腺内出现斑点状、斑片状或大片状无强化区域和(或)胰周积液不均质、含有混杂密度或信号即提示胰周坏死组织碎片或脂肪碎片。对于影像科医生而言,在诊断急性胰腺炎的同时,需首先弄清楚其影像学分型是否是坏死性胰腺炎?属于坏死的哪一种亚型?这将为后面识别局部并发症并予以正确术语奠定基础。在急性胰腺炎的早期(腹痛症状发作后发病1周内)至发病4周以内,若并发局部液体积聚,CT/MRI报告中诊断APFC(图2、3)即指此患者来源于IEP;报告ANC则指患者来源于ANP(图4、5)。可见这两种局部并发症的来源指向明确、一一对应,不可颠倒错用[5,6]。
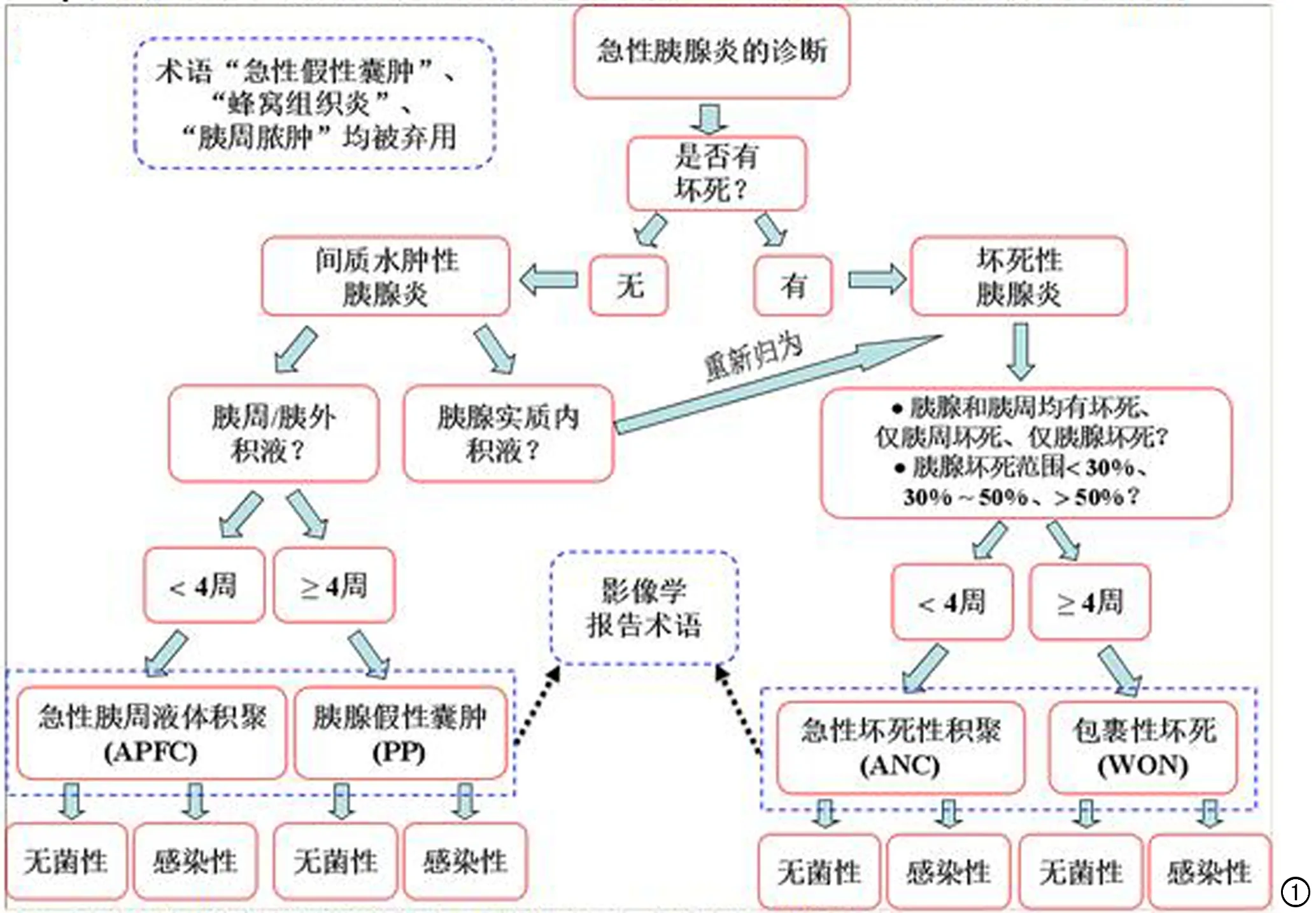
图1基于急性胰腺炎新亚特兰大分类的临床诊断思维导图。
急性胰腺炎相关液体积聚APFC/ANC的位置
胰腺位于腹膜后间隙的肾旁前间隙内,使得急性胰腺炎液体渗出可以向前、后、左、右、上、下 6个方向蔓延,可累及腹膜后三大间隙和相关筋膜间平面,积液可以顺着壁腹膜和脏腹膜的走行累及相应腹膜腔或腹膜外的不同区域(膈下间隙、肝裸区、门脉周围间隙、肝肾隐窝、结肠旁沟、肝胃间隙、网膜囊、脾胃间隙、脾肾间隙、胃裸区等),同时积液顺着横结肠系膜、小肠系膜蔓延至腹膜下间隙,积液向下可侵犯肾下间隙或锥下间隙,沿着髂血管周围间隙进入盆腔腹膜外间隙,还可向腹前外侧壁和腹后壁侵犯至腹壁肌间隙、皮下间隙[7,8]。当然,积液向上经由膈肌孔隙可进入纵隔、胸腔,引起双侧胸腔积液。尽管急性胰腺炎相关性积液可以扩散至上述诸多部位,但在临床影像诊断工作中,我们发现早期液体积聚(APFC/ANC)仍以小网膜囊和左侧肾旁前间隙为主(图6)。它们的鉴别点CT/MRI图像上APFC范围更为单一或局限化(常在某一个腹膜后间隙),而ANC位置常更为宽泛,多呈“跨腹盆腔多间隙、多筋膜间平面”表现(表1)。
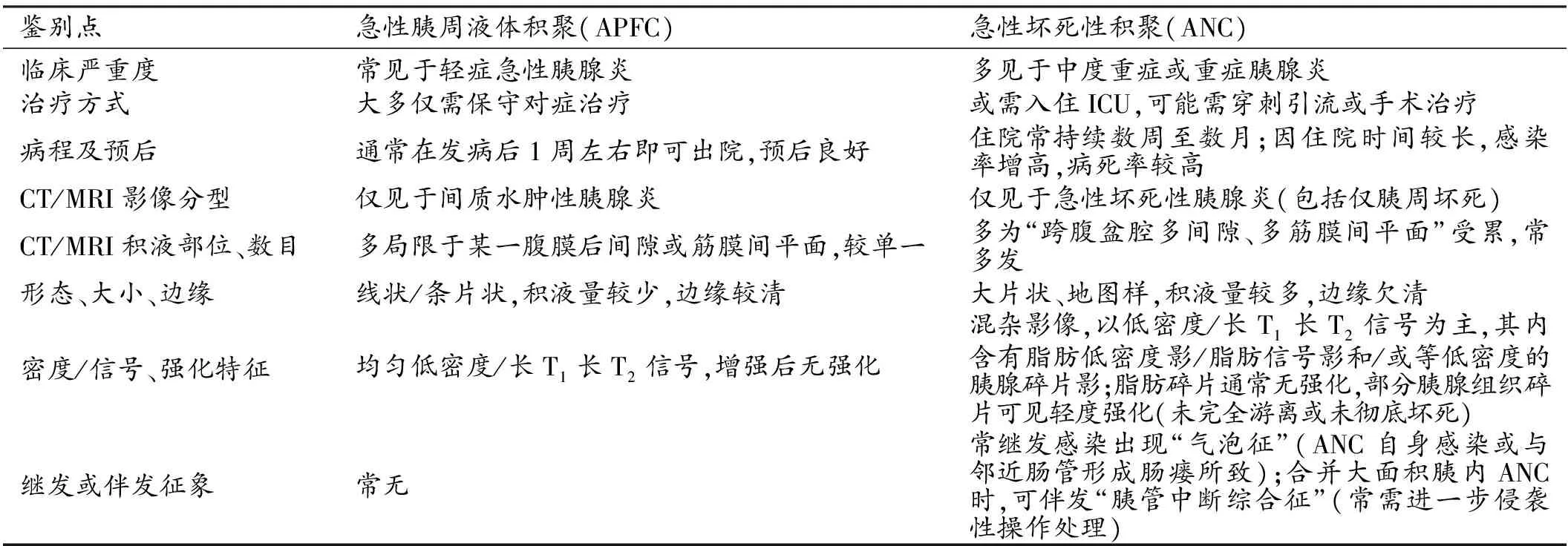
表1 APFC与ANC临床和影像学鉴别诊断要点

图2急性间质水肿性胰腺炎(IEP)发病4周内伴发急性胰周液体积聚(APFC)示意图,即APFC的诊断只针对IEP患者。 图3女,66岁,腹痛5d。轴面FSE压脂T2WI示间质水肿性胰腺炎伴小网膜囊APFC。P:胰腺。图4急性坏死性胰腺炎(ANP)发病4周内伴急性坏死性积聚(ANC)示意图,即ANC的诊断只针对ANP患者。 图5男,56岁,腹痛2d。轴面CT增强静脉期示坏死性胰腺炎(胰腺体尾部坏死累及范围>50%),故对应小网膜囊积液应诊断为ANC。P:胰腺,N:坏死灶。 图6男,43岁,腹痛10d伴恶性、呕吐。冠状面T1WI增强静脉期示急性坏死性胰腺炎伴急性坏死性积聚(ANC)。ANC累及部位宽泛,除累及常见位置小网膜囊(LS),还上至左侧膈下间隙(1)、脾胃间隙(2),向下沿途侵犯肠系膜后平面(RMP)、肾旁后间隙(PPS)、肾后平面(RRS)及联合后的锥下间隙(ICS)。P:胰腺,K:左肾,St:胃底,Sp:脾脏。 图7女,40岁,腹痛3d。轴面FSE压脂T2WI示间质水肿性胰腺炎伴急性胰周液体积聚(APFC)。APFC积液量较少、呈线状,局限于胰周、左侧肾旁前间隙(APS)。 图8男,53岁,腹痛2d。轴面CT增强静脉期示坏死性胰腺炎伴“地图状”分布的、多发急性坏死性积聚(ANC)。ANC积液量大、呈大片状,除累及左侧肾旁前间隙(APS)外,还经由腹膜后沿着横结肠系膜根部侵犯横结肠系膜所在的腹膜下间隙(SPS),且边缘模糊不清。P:胰腺,TC:横结肠,DC:降结肠。
APFC/ANC的形态、大小、数目、边缘
CT/MRI图像上APFC多呈均匀的线状或条片状液体形态,由于常局限于腹膜后某一个间隙或筋膜间平面,积液量较少,边缘分布较清[1-4](图7)。而ANC常突破筋膜间平面的限制或侵犯肾前、侧锥、肾后筋膜而累及多个腹膜后间隙、筋膜间平面和腹膜下间隙(图8),故液体积聚常多发、积液量较大、呈大片状的地图状分布、边缘欠清[1-4]。
APFC/ANC的密度/信号、强化特征
间质水肿性胰腺炎出现的APFC在平扫和增强CT上呈均匀的低密度影;在MRI上呈均匀的长T1长T2信号影(图3、7),增强后APFC通常无强化[1-4,6]。而急性坏死性胰腺炎伴发的ANC在平扫和增强CT上呈不均匀的(非均质性)稍低密度影,其内混杂小圆形、斑片状、条片状脂肪样低密度影(脂肪碎片或坏死脂肪组织)和/或不同程度的斑片状等低混杂密度影(胰腺坏死碎片)[1-4,6](图9)。MRI上ANC内的脂肪碎片或坏死脂肪组织呈低信号影(压脂序列)(图10);增强后ANC未成熟的、厚薄不均的纤维肉芽组织壁可强化,其内部“漂浮的坏死碎片”一般无强化,但也有少数碎片组织并未完全游离而出现强化表现(尚存部分血供)(图10、11)。

图9急性坏死性胰腺炎(ANP)发病4周内伴急性坏死性积聚(ANC)示意图,随着病程的延长,ANC周围可逐步形成纤维肉芽组织壁、常厚薄不一(箭);ANC内部含有两种成份:胰周脂肪碎片或坏死脂肪组织(直箭)、胰腺实质碎片(弯箭)。N:坏死灶。 图10男,46岁,上腹痛2d。a)轴面FSE压脂T2WI示坏死性胰腺炎伴网膜囊、肾旁前间隙多发急性坏死性积聚(ANC)。ANC内夹杂着大量斑片状、条状低信号影(箭),即胰周脂肪碎片或坏死脂肪组织;b)轴面T1WI增强静脉期示碎片组织本身不强化(箭),但其边缘及移行的ANC未成熟纤维肉芽组织壁条状强化(箭)。该患者行开腹坏死组织清除术,术后病理证实病变区有纤维肉芽组织壁伴脂肪坏死物。 图11男,60岁,腹胀、腹痛2d,伴呼吸困难1d入院。入院第16天,轴面CT增强静脉期示网膜囊和左侧肾旁前间隙多发急性坏死性积聚(ANC),ANC周围未完全成熟的壁呈环形轻度强化(箭),ANC内容物中脂肪碎片或坏死脂肪组织无强化(直箭),而部分残碎的胰腺实质组织仍轻度强化(弯箭),提示尚存部分血供。P:胰腺,Gb:胆囊。 图12男,59岁,急性坏死性胰腺炎发病后25d出现高热、呼吸困难、血象增高。轴面CT增强静脉期示胰周、肾旁前间隙急性坏死性积聚(ANC)内散在分布多发气体密度影。患者行剖腹胰周坏死组织清除术,术后标本病原学培养证实草绿色链球菌和克雷伯氏菌混合感染。 图13急性坏死性胰腺炎(ANP)伴急性坏死性积聚(ANC)示意图,合并主胰管(MPD)断裂(箭)。
APFC/ANC继发或伴发CT/MRI征象
APFC/ANC除上述的一些直接征象外,还可继发/伴发多种并发症,使得临床病情更为错综复杂。间质水肿性胰腺炎出现的APFC通常范围局限、量少,经过临床保守对症治疗,常很快吸收,不带来后续并发症,这类患者大多在入院1周左右即出院[1-4,6]。而急性坏死性胰腺炎伴ANC形成,大多见于中度重症和重症胰腺炎患者,病程往往很长(可持续数周甚至数月),故而较APFC更易继发感染性并发症[9,10](图12)。此外,当坏死性胰腺炎大面积胰腺实质坏死累及主胰管、导致胰管坏死,形成胰腺内和胰周相连的ANC时,常可伴随主胰管破裂、中断,即“胰管中断综合征”(图13、14),这类患者往往需要外科手术处理方能治愈[11]。
影像学报告中术语误用的常见类型
结合急性胰腺炎新亚特兰大分类说明和我们的临床实践,笔者将APFC和ANC在日常影像学报告中容易误用的4种情况汇总如下:
CT/MRI上胰腺实质未见坏死,主观臆断为“间质水肿性胰腺炎”,而将胰周相应区域的液体积聚错报为APFC。出现这种情况的原因是忽视了液体积聚中存在“坏死脂肪组织碎片”的可能(图15、16)。

图14男,60岁,腹胀、腹痛2d,伴呼吸困难1d入院。入院第16天,轴面CT增强静脉期示网膜囊急性坏死性积聚(ANC)向胰腺实质内大面积延伸,致胰腺“离断”征象(箭)。该患者后经手术证实主胰管破裂中断。P:胰腺。 图15女,58岁,急性胰腺炎发病3d后。轴面CT增强静脉期示胰腺实质强化可、未见确切坏死;网膜囊和左侧肾旁前间隙液体积聚易误报为APFC。仔细观察发现积液并非均质性,而包含多发、斑片状脂肪密度影(圆圈内),提示存在胰周脂肪碎片或坏死脂肪组织,故应诊断为急性坏死性胰腺炎(仅胰周坏死型)伴急性坏死性积聚(ANC)。 图16男,40岁,急性胰腺炎发病6d后。轴面FSE压脂T2WI胰腺未见确切坏死征象,同样易将周围积液误报为APFC;压脂T2WI仔细观察发现左侧肾旁前间隙和胰周存在条絮状、斑片状低信号影(箭),应诊断为急性坏死性胰腺炎(仅胰周坏死型)伴急性坏死性积聚(ANC)。 图17男,47岁,腹痛5d。轴面GRE压脂T1WI示胰腺体尾部坏死出血(*),提示坏死性胰腺炎。尽管网膜囊和左侧肾旁前间隙液体积聚信号均匀、未见坏死碎片影,仍需诊断为急性坏死性胰腺炎伴ANC。
CT/MRI上发现胰周、腹膜后间隙等区域液体积聚的密度、信号均匀,随即诊断为APFC。但这也存在陷阱,理由是如果胰腺本身存在坏死(为急性坏死性胰腺炎),即使周围积液影像学上是均质的、未见所谓的“碎片内容物”,按照新亚特兰大分类,依然需诊断为ANC(图17)。
CT/MRI上液体积聚密度或信号均匀,但积液累及至胰腺实质内,将其诊断为APFC。出现这种错误的原因是对新指南认识不足。新分类指出凡累及至胰腺实质内的积液,即使密度/信号均匀,仍需判定为坏死性胰腺炎(即胰腺内的液体积聚对应坏死灶范围),故周围的液性积聚应诊断为ANC(图18)。
少数影像科医生依然在使用“胰周蜂窝组织炎”、“胰腺/胰周脓肿”等术语,需注意2012新亚特兰大分类明确提出“胰周蜂窝组织炎”和“胰腺/胰周脓肿”等命名均已被弃用。若在发病4周以内出现感染并发症,正确的影像学诊断术语应为急性坏死性胰腺炎伴急性坏死性积聚(ANC)合并感染(图12)。
目前存在问题与展望
虽然通过我们的介绍明确了APFC和ANC的诸多不同,但在临床实际工作中APFC和ANC在急性胰腺炎发病的早期(尤其是起病3d内)在CT扫描图像上有时仍难以准确鉴别。就其原因可能与以下3个因素有关:①急性间质水肿性胰腺炎有可能在病程的发展过程中演变为急性坏死性胰腺炎,故APFC的命名可能随之更名为ANC。出现这种情况的原因在于急性胰腺炎起病早期行CT检查,胰腺有可能仅表现为局限性/弥漫性稍低密度影(胰腺缺血或灌注不良),增强后动脉期胰腺仍可见一定程度的较均质强化;但随着疾病本身的进一步发展,胰腺组织的微循环障碍可能会加剧,一部分实质从短暂性的缺血缺氧向不可逆性的液化性坏死演变;②胰周脂肪组织坏死同样存在一定的过程,早期液体积聚内尚未形成可发现的“不均质内容物”;③CT扫描由于软组织分辨力较低,难以察觉少量的“不均质内容物”。鉴于此,新亚特兰大指南建议此类患者在发病后5~7d复查CT,方能准确区分它们[1-4]。笔者的经验是MRI(尤其是FSE/TSE压脂T2WI结合MRCP)对少量“不均质内容物”的检出更敏感、对早期坏死性胰腺炎的识别更佳,故对APFC/ANC的早期鉴别更有帮助[6]。此外,MRI扩散加权成像结合ADC值的测量(图19)有助于间质水肿性胰腺炎和急性坏死性胰腺炎的鉴别诊断,是否有助于APFC/ANC的早期鉴别诊断可成为今后研究的一个方向。但MRI的局限性在于扫描时间较长,需要患者密切配合,对于部分情况差的重症胰腺炎患者普及MRI检查存在一定的困难。

图18女,56岁,腹痛3d。轴面CT增强静脉期示胰周和横结肠系膜根部区均匀水样低密度影,易误报为APFC。观察上述液体积聚向胰腺头颈部实质内延伸通连(箭),诊断为急性坏死性胰腺炎伴急性坏死性积聚(ANC)。 图19男,28岁,急性坏死性胰腺炎伴急性坏死性积聚(ANC)。a)DWI示胰腺体尾部片状低信号灶;b)ADC图示胰腺体尾部不同病理组织的ADC值的差异。
综上所述,新亚特兰大分类系统已将急性胰腺炎相关局部并发症的命名进行了规范化,这有利于指导临床工作和学术交流。笔者将急性胰腺炎症状发作4周内出现的局部并发症APFC和ANC的鉴别诊断汇总于表1。影像科医生应充分认识到这些标准化术语,并运用在日常的诊疗报告中。