颞骨HRCT多平面重组及MinIP在评估内耳畸形中的价值
石琴, 张文, 田野, 刘青明
1珠海市中西医结合医院影像科(广东珠海 519000); 2珠海市妇幼保健院耳鼻喉科(广东珠海 519001)
内耳畸形是先天性感音神经性聋的重要原因之一,人工耳蜗植入是治疗双侧重度-极重度感音神经性聋的有效手段,随着人工耳蜗植入手术适应证的扩展,内耳畸形患者接受人工耳蜗植入的比例逐渐增加。但人工耳蜗植入手术操作难度大,易致并发症,故术前行颞骨高分辨率CT(HRCT)扫描,经后处理重组观察内耳畸形解剖特征,有助于了解内耳畸形类型和程度,对人工耳蜗植入术前评估极为重要。此类研究已有多篇文献报道,但在HRCT后处理重组方面多仅应用多平面重建(MPR),显示畸形欠缺直观和整体性,部分医疗单位还采用容积再现(VR),虽能弥补MPR的不足,但重组效率低,对迷路腔内结构显示欠佳,最小强度投影(MinIP)重组是在MPR基础上进行,重组步骤简单,能较VR技术显示更多细节,既往罕见报道,笔者收集一组内耳畸形患者HRCT资料,探讨MPR联合MinIP后处理重组的诊断价值。
1 资料与方法
1.1 一般资料 收集本院2013年1月至2018年12月间31例内耳畸形患者的临床及颞骨HRCT资料,计57例畸形耳。男12例,女19例,年龄1~56岁,平均(11.9±10.9)岁。主要临床表现为自幼单侧或双侧耳聋或听力差、言语障碍,1例表现为咳嗽后眩晕,所有患者均经脑干诱发电位确诊。排除外伤性、感染性、药物性所致后天性聋。所有患者均行颞骨高分辨CT扫描,检查前均签署知情同意书。
1.2 HRCT扫描 使用东芝64排螺旋CT扫描仪,所有患者均取仰卧位,行颞骨容积扫描,扫描范围自弓状隆起至乳突下缘,扫描基线听眉线,管电压管电流120 kV、120~150 mAs,层厚1 mm,螺距0.6,FOV 190 mm×190 mm,容积扫描结束后将所得原始数据传输至东芝后处理工作站,用骨重建算法,重建层厚0.5 mm,重建间隔0.3 mm,FOV 60 mm×60 mm,分别以单侧耳为中心进行后处理重组,在重组后图像上观察内耳诸部位结构特征。
1.3 HRCT后处理重组技术 本组患者经后处理薄层重叠重建后主要行MPR及MinIP重组。耳蜗、前庭、外半规管在斜轴位及斜冠状MPR上观察;上、后半规管在分别以单侧耳上、后半规管为中心及长轴走行的斜矢状、斜冠状MPR上观察;前庭导水管在斜轴位MPR上观察;内耳道在斜轴位及斜冠状MPR上观察(分别观察前后径及上下径)。在MPR重组基础上调整层面角度、中心点位置、层厚等参数后进行最小密度投影得到MinIP图像,用来观察内耳膜迷路。
1.4 内耳畸形分型标准[1]按照内耳解剖结构并参考与临床关系密切的Sennaroglu分类方法进行。(1)米歇尔型:即骨迷路完全不发育,为最严重的内耳畸形,常伴内耳道异常。(2)耳蜗未发育:耳蜗缺如,前庭-半规管正常或发育不良。(3)共腔畸形:耳蜗和前庭呈单一囊状结构,两者无法区分。(4)耳蜗发育不全:耳蜗形态可基本正常,但发育扁小,常表现为从发出的小芽状结构。(5)IP-Ⅰ型:即囊性耳蜗前庭畸形,耳蜗呈囊状,蜗轴缺乏。(6)IP-Ⅱ型(即Mondini型,以下均用Modini型描述):耳蜗仅1.5周,底周正常,中顶周蜗轴缺乏,融合呈囊状。(7)前庭-半规管畸形:表现为前庭半规管扩大、融合、半规管部分或全部缺如。(8)前庭导水管扩大:表现为前庭导水管增宽。(9)内耳道发育畸形:主要表现为内耳道缺如、狭窄或扩大。
1.5 内耳畸形测量标准[2-4]耳蜗发育不良:高度≤3.4 mm或≥4.3 mm,宽度>5.4 mm;前庭扩大:横断面宽径>3.4 mm;小前庭:横断面宽经<2.8 mm;半规管发育不良:中心骨岛宽度≤2.97 mm;导水管扩大:导水管中段直径>1.5 mm,或与总脚通;内耳道畸形:宽度/高度任一经线≤3 mm为狭窄,≥6 mm并伴相关临床症状为扩张。
2 结果
2.1 内耳畸形概况 本组31例患者中单耳畸形3例(9.7%,3/31),其余28例为双耳畸形(90.3%,28/31)。单一结构畸形13例耳(22.8%,13/57),分别为上半规管裂1例,大前庭导水管综合征(LVAS)10例,内耳道狭窄2例;≥2种以上畸形44例耳(77.2%,44/57)。
2.2 MPR与MinIP结合显示内耳畸形 本组检出耳蜗畸形41例(71.9%),具体分型及累及内耳结构情况:米歇尔畸形11例(19.3%,图1-A、1-B),耳蜗未发育6例(10.5%,图2),IP-Ⅰ型4例(7%,图2),耳蜗发育不全1例(1.8%,图1-A、图3),Modini型19例(33.3%,图4-A、4-B),无共腔畸形;前庭-半规管畸形4例(7%): 1例上半规管裂(图5-A、5-B、5-C),2例外半规管-前庭融合畸形(图6-A),其中1例MinIP重组可清晰显示正常的上、后半规管及正常耳蜗(图6-B、6-C),1例上半规管前脚扩张;前庭导水管扩大24例(42.1%),其中单纯前庭导水管扩大即LVAS 10例(17.5%,图7-A、7-B),其余14例均伴其他结构内耳畸形;内耳道畸形24例(40.3%):其中未发育1例,狭窄13例(22.8%),扩张10例(17.5%),单纯内耳道狭窄2例(3.5%),其余均伴内耳其他畸形。见表1。
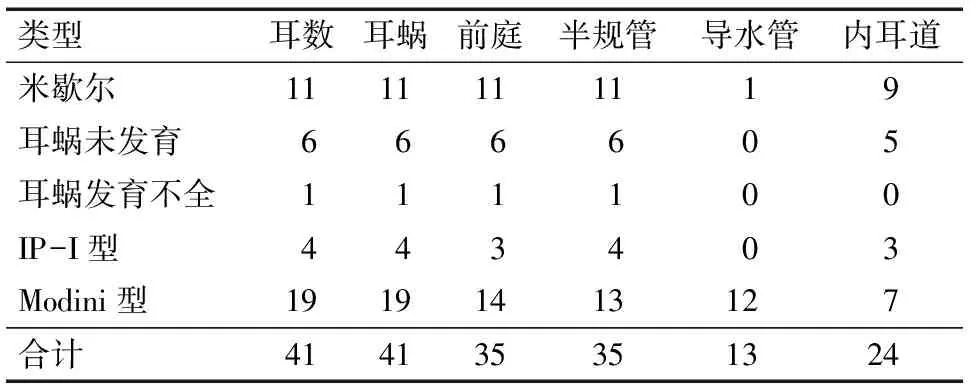
表1 耳蜗畸形分型及累及内耳结构情况 耳
2.3 MPR与MinIP结合显示面神经管异常及内耳道底部骨质缺损 面神经管异常及内耳道底部骨质缺损常与内耳畸形伴发,本组57例内耳畸形中9例合并迷路段面N管走行异常,其中8例均见于米歇尔,1例见于Modini,MPR与MinIP结合可清晰显示迷路段面神经管发育及走行情况,具体表现为:管腔内径扩大、位置前移、第一膝角度变大甚至消失(图1-B);此外本组检出5例内耳道底部与前庭或耳蜗间骨性分隔缺失(图4-C),内耳道底部均呈扩大状:2例Modini,2例IP-1,1例耳蜗未发育。
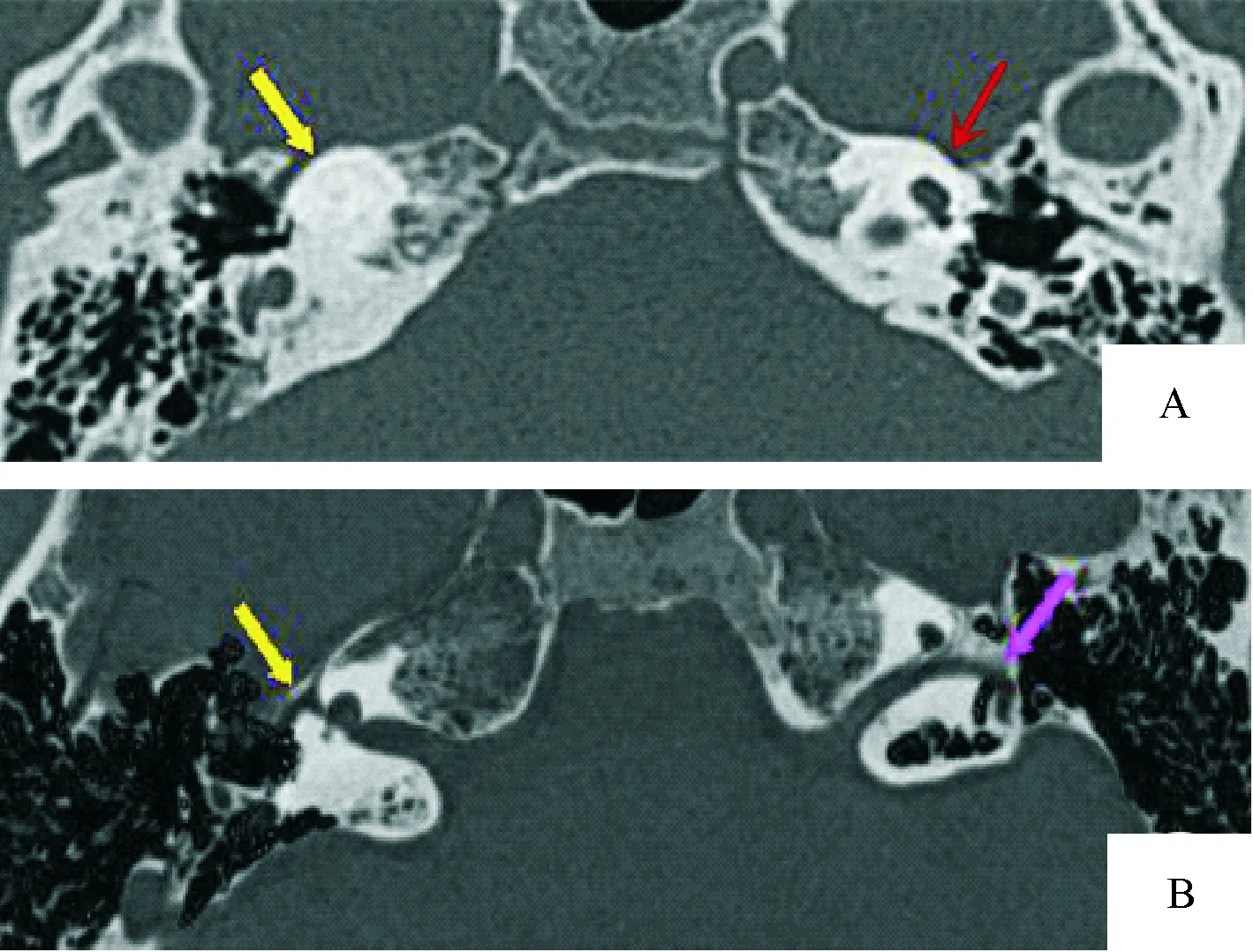
图1 米歇尔畸形的斜轴位MPR显像
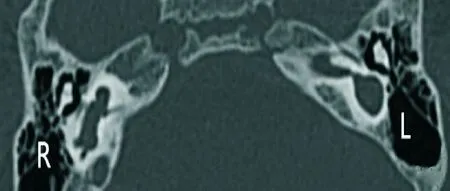
图2 右耳IP-I型的斜轴位MPR显像

图3 左后半规管发育不良的斜冠状位MinIP显像

图4Mondini畸形的MPR联合MinIP重组显像
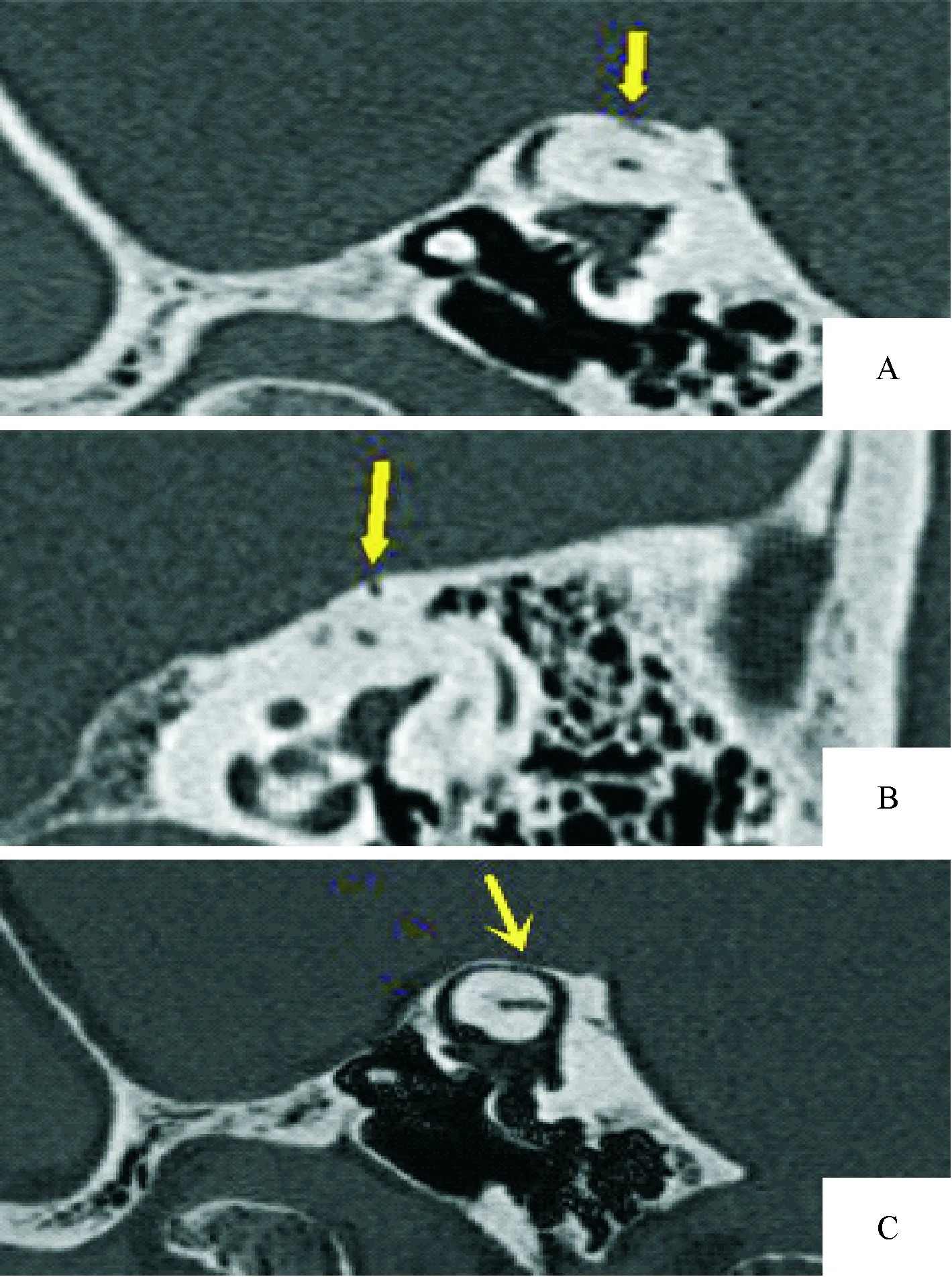
图5 左上半规管裂的MPR联合MinIP重组显像
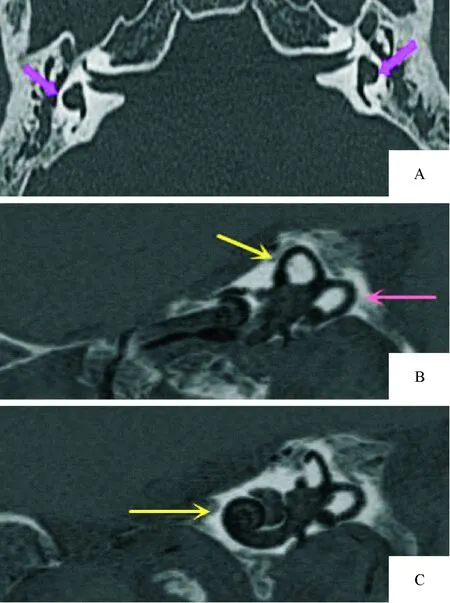
图6 半规管-前庭融合畸形的MPR联合MinIP重组显像
3 讨论
据近年来几宗大样本研究得出[3-5],内耳畸形仅累及单侧耳占比4.17~7.4%,仅累及内耳单一结构占比6.04~8.51%,本组畸形累及单侧耳与文献报道接近(9.7%,3/31),累及单一结构本组达22.8%(13/57),主要为LVAS,高于文献报道,考虑可能与样本数少造成统计偏差有关。但均显示了内耳畸形同时累及双侧耳及内耳多个结构的特征。
3.1 内耳畸形分型情况及影像特征
3.1.1 耳蜗畸形 临床表现为中重度感音神经性聋。(1)米歇尔型:本组检出11例,2例表现为与内耳道底相连的小泡影,双侧对称,1例表现为岩锥内均一软组织密度影,其余均表现为致密骨质。11例中9例伴发内耳道畸形。(2)耳蜗未发育:本组6例,均伴前庭-半规管畸形,5例伴有内耳道畸形。(3)共腔畸形:本组未见。(4)耳蜗发育不全:本组检出1例,同时伴前庭发育小和半规管发育不良。(5)IP-Ⅰ型:本组4例,3例伴外半规管前庭融合畸形,1例伴后半规管发育不良。(6)Mondini型:本组共检出19例,其中13例伴前庭-半规管发育异常,多为前庭-外半规管融合(11例),1例为小前庭-半规管不发育,1例前庭扩大;12例伴前庭导水管扩张,7例伴内耳道畸形。
3.1.2 前庭-半规管畸形 单纯前庭畸形极少见,多与半规管畸形并存,且多与耳蜗畸形伴发(本组伴发率85.4%,35/41),也可单独发生,单纯前庭-半规管畸形时临床可为传导性聋、感音神经性聋,也可听力正常。本组4例单纯前庭-半规管畸形中含1例半规管裂,患者为56岁男性,以咳嗽时继发眩晕来诊。CT显示左侧上半规管顶后部骨质局部缺裂,无其他内耳伴发畸形。文献报道[6]该病发病机制为半规管缺裂处膜半规管与硬脑膜直接接触,形成除圆窗和前庭窗之外的迷路第三窗,使半规管壶腹嵴对压力敏感性增高所致。Sennaroglu的分类未纳入此畸形,但半规管属于骨迷路,除前庭症状外,也可引发传导性耳聋,影像医师应认识本病,故笔者将之纳入本文进行讨论。
3.1.3 前庭导水管扩大 临床主要表现为耳聋,部分呈波动性听力下降。可为单纯扩大,即LVAS,本组10例(17.5%);另14例前庭导水管扩大者伴有其他部位内耳畸形。胚胎学研究表明,耳蜗、前庭、半规管和前庭导水管这4个结构源于同一胚层(外胚层)且发育时间重叠,故合并畸形常见[3],本组14例前庭导水管扩大伴其他内耳畸形者中,14例均伴发耳蜗畸形,9例同时还合并前庭-半规管畸形。另文献报道Mondini畸形绝大多数合并前庭导水管扩张(66.7%),本组耳蜗畸形中11例米歇尔畸形仅1例合并前庭导水管扩张(9.1%),而19例Mondini畸形中12例合并前庭导水管扩张(63.2%),其他几种耳蜗畸形未见合并,均与文献报道一致。
3.1.4 内耳道畸形 本组11例米歇尔畸形中9例伴发内耳道畸形,1例未发育,余8例均表现为重度狭窄。严重狭窄常伴有听神经发育不良或缺如,从而致感音神经性耳聋。但研究表明内耳道狭窄程度与听神经发育程度并不成正比,在内耳道扩大者亦可见听神经异常[7-8],故依据直径来判断听神经发育情况不全面。本组7例同期行内耳MRI检查示前庭、蜗神经发育纤细或未发育者中,5例显示内耳道未发育或重度狭窄,2例则显示内耳道扩大,支持以上结论。
3.2 颞骨HRCT对人工耳蜗植入手术的指导意义 具有可供电极植入的耳蜗结构以及完整的听神经传导通路是实施人工耳蜗植入手术的2个基本条件。米歇尔畸形两者均不具备,为人工耳蜗植入的绝对禁忌证;耳蜗未发育之前也归为绝对禁忌证,但近年来国内外临床实践表明[9-10]对于听神经存在并可在术前引出听觉诱发反应的耳蜗未发育畸形患者,在前庭中植入人工耳蜗仍可使患者获益,属于相对禁忌证;共同腔畸形、耳蜗发育不良、耳蜗不完全分隔、大前庭导水管综合征、前庭及半规管畸形及狭窄等内耳畸形患者均属人工耳蜗植入适应证,术后可获得良好的听觉及言语效果[11]。此外,可根据不同内耳畸形类型选择手术入路及适宜的人工耳蜗电极,以获得更好的植入效果。
面神经管损伤是人工耳蜗植入的并发症之一,面神经管由内耳原基的听囊及第2腮弓软骨形成,面神经管异常常与内耳畸形同时发生[12-13],发现这些变异可调整手术路径,避免术中损伤面神经。脑脊液“井喷”是人工耳蜗植入术中另一常见并发症,内耳道底部骨质缺损是人工耳蜗植入术中脑脊液“井喷”的主要原因,由于耳蜗基底部与内耳道直接相通,脑脊液经耳蜗开窗处漏出,增加了电极植入的难度以及术后脑脊液漏的风险[14],术前检出此异常利于术中采取预防措施。
3.3 颞骨HRCT后处理重组技术比较(MPR、MinIP、VR) 内耳畸形结构复杂,且不在一个平面上,故原始扫描所得轴位图像观察欠佳,本组HRCT后处理技术主要选用斜位MPR及MinIP重组,前者是利用原始数据直接进行任意平面的重建,优势在于不失真,细节显示准确。内耳骨迷路内充满内、外淋巴液,在CT上表现为均匀低密度,经一定层厚MinIP后即得到重组图像。本组资料显示因发育不良的上半规管多伴有旋转异常,使得其纵径趋近于后半规管,若将中心位置置于总脚处,选择适当层厚可同时显示上/后半规管全貌,从而清晰显示半规管的缺失、盲端、管腔扩张等(图4-B);本组1例半规管裂患者,MinIP显示缺裂处骨质呈筛孔样(图5-C),而MPR不能显示此征象,仅见局部骨质缺裂,且MinIP对缺裂处在半规管的位置及范围也较MPR显示更直观;对于囊性耳蜗、前庭-半规管融合、导水管扩大及与总脚通、内耳道内经、迷路段面神经管走行及与邻近畸形耳蜗关系等,MinIP均较MPR显示更直观、整体性更好,而在MPR重组图像上则需要调整层面并连续进行多幅图观察才能获取以上信息。因为MinIP是在MPR重组基础上直接进行,不用退出MPR重组界面,不另外对原始数据进行重建,不对周围结构进行人工切割,与同样可直观显示畸形的VR重组比较,过程简捷,节省了后处理时间,对操作者依赖低;国内戴慧等[15]也认为可通过MinIP快速显示内耳骨迷路。此外,文献报道[16]VR重组不能分辨正常耳蜗中、顶周,而本组资料显示薄层MinIP可清晰分辨两者(图6-C),从而更利于显示耳蜗异常。笔者实际操作中发现由于容积效应存在,MinIP可能导致部分结构内径显示较真实稍增宽,也易致内耳低密度区内小的骨性高密度结构被不同程度覆盖,如会使耳蜗内的蜗轴、阶间隔的密度变淡;此外邻近的低密度结构如乳突、岩骨尖的气房重叠也会导致假象,所以重建时中心点位置,层厚以及层块倾斜角度都是关键因素,应依据所观察对象而调整,本文所用层厚多在2.5~6 mm,3 mm左右居多。所以笔者认为与MPR及VR比较,MinIP可快速、全面、较为准确地显示内耳各类畸形,较MPR重组显示畸形更直观,避免空间想象力不足所致误诊;较VR重组处理效率高,薄层块MinIP重组对耳蜗内部结构显示也优于VR,MPR与MinIP结合,可快速准确诊断内耳畸形。
综上所述,颞骨HRCT可精细显示内耳结构并对畸形进行准确分类;可显示内耳邻近结构的伴发异常,以上对于人工耳蜗植入适应证选择、并发症预防有重要指导意义;依据内耳道狭窄程度预判听神经发育情况有局限性,内耳MRI检测观察听神经发育是必要的;颞骨CT后处理重建技术中MinIP有独到优势,MPR与MinIP结合,可快速准确诊断内耳畸形,临床应用价值高。

