单指数、双指数、拉伸指数模型DWI在胶质瘤术前分级中的应用
郝凤玲,吴慧,牛广明
根据世界卫生组织中枢神经系统分级标准,胶质瘤分为低级别胶质瘤(Ⅰ、Ⅱ级)和高级别胶质瘤(Ⅲ、Ⅳ级)。准确评估胶质瘤等级对于胶质瘤患者治疗方式的选择及预后至关重要。随着磁共振技术的发展,基于扩散加权成像(diffusion weighted imaging,DWI)等一系列物理模型在微观水平上能够为胶质瘤的术前分级提供更多可靠的信息。本研究通过单指数、双指数、拉伸指数模型DWI所得参数对胶质瘤进行分级,分析各参数诊断效能,评价灌注参数与血流量(cerebral blood flow,CBF)的相关性。
1 材料与方法
1.1 研究对象
收集2017年3月至2018年7月在我院神经外科就诊的脑胶质瘤患者34 例,包括WHOⅡ级17例,WHO Ⅲ~Ⅳ级17例。其中男性22例,女性12例,年龄15~69岁,平均46岁。纳入标准:(1)通过手术病理诊断为胶质瘤的患者;(2)检查前患者未经手术、放化疗及其他治疗手段;(3)行常规平扫、增强扫描、3D动脉自旋标记成像(three demensional arterial spin labeling,3D ASL)、多b值DWI序列。排除标准:(1)未能获得病理结果者;(2)图像质量不能求满足需求者(如运动、假牙等产生的伪影);(3)瘤体实性部分太小、囊变坏死较大者及测量不准确者。
1.2 成像序列及参数
采用GE Discovery MR 750 3.0 T超导型磁共振成像仪、8通道头颅相控阵线圈进行扫描。多b值DWI采用0、10、20、40、80、140、200、400、800、1000、2000、3000 s/mm2共12组b值。TR/TE:5000 ms/84.4 ms,层厚/层间距:5.0 cm/1.5 cm,层数:22层,视野:24 cm×24 cm,扫描时间:8 min 25 s。3D ASL是采用三维容积扫描,TR/TE:5327 ms/10.5 ms,TI:2525.0 ms,视野:24 cm×24 cm,层厚/层数:4.0 cm/36层,带宽:62.5 kHZ,标记延迟时间:2.0 s,扫描时间:3 min 44 s。
1.3 图像后处理及感兴趣区的选取
由一位高年资放射科医师将DWI、多b值DWI及3D ASL的原始数据导入GEAW4.6工作站,利用Functool后处理工具包中的MADC、3D ASL后处理软件对数据进行处理。结合T1WI增强及T2加权成像,绘制肿瘤实性区域感兴趣区(region of interes,ROI)(图1、2),并选择最大层面及上下相邻层面,避免囊变、坏死、出血及钙化区,取三者平均值。根据单指数模型公式(1):Sb/S0=exp (-b×ADC),采用b值为0、1000 s/mm2拟合得到表观扩散系数(apparent diffusion coefficient,ADC),根据双指数模型公式(2):Sb/S0=(1-f)•exp (-bD)+f•exp [-b (D+D*)]及拉伸指数模型公式(3):Sb/S0=exp [-(b×DDC)α],采用从低到高12组b值拟合得到D、D*、f、分布扩散系数(distribute diffusion coefficient,DDC)及水分子各向异性(alpha,α)值。使用3D ASL后处理软件得到CBF值。
1.4 统计学分析
使用SAS9.4统计软件进行数据处理,结果以均数±标准差来表示。采用两独立样本t检验比较高、低级别胶质瘤组之间ADC、D、D*、f、DDC、α值的差异,P<0.05表示差异有统计学意义。作各参数在鉴别高、低级别胶质瘤的受试者工作特性(receiver operating charactsteristic,ROC)曲线,计算曲线下面积(area under curve,AUC),得出诊断的临界值。所有研究者的D*与CBF间值采用Spearman相关性分析,P<0.05认为差异有统计学意义。
2 结果
2.1 胶质瘤病理组织分型
结合HE染色及免疫组化病理诊断,将收集到的34例胶质瘤患者分为低级别(Ⅱ级)胶质瘤17例(包括星形细胞瘤8例、少突胶质细胞瘤5例、少突-星形细胞瘤1例、纤维型星形细胞瘤1例、弥漫型星形细胞瘤2例)和高级别(Ⅲ~Ⅳ级)胶质瘤17例(包括Ⅲ级7例:间变型少突胶质瘤细胞瘤3例、间变型星型细胞瘤2例、星型细胞瘤1例、少突神经胶质细胞瘤1例;Ⅳ级10例:胶质母细胞瘤9例、多形性胶质母细胞瘤1例)。
2.2 各模型所得参数结果

表1 ADC、D、f、D*、DDC及α值组间差异比较Tab. 1 The comparison of ADC, D, f, D*, DDC and α vaules between two groups
高级别胶质瘤组ADC、D、f、DDC、α值低于低级别胶质瘤组,D*值高于低级别胶质瘤组,且差异均有统计学意义(P<0.05,表1、图1、2)。
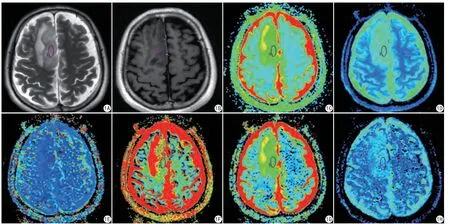
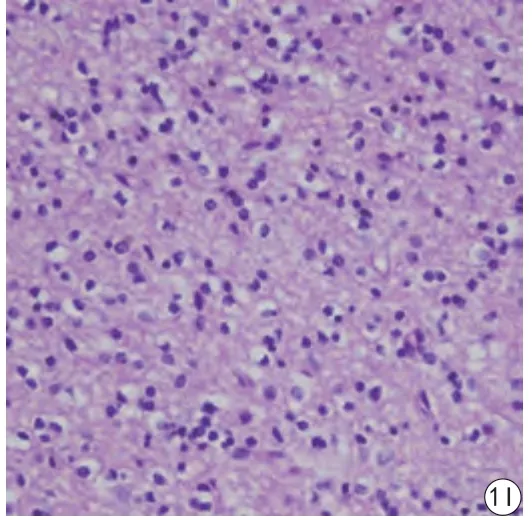
图1 男,39岁,病理结果证实为右额叶少突胶质细胞瘤。A:T2WI;B:T1WI增强扫描;C~H的伪彩图分别是ADC、D、D*、f、DDC、α图,所选ROI的值分别为:1.32×10-3 mm2/s、0.949×10-3 mm2/s、2.85×10-3 mm2/s、0.423%、1.24×10-3 mm2/s、0.923;I:HE染色图Fig. 1 A 39-year-old male patient with pathology confirmed right frontal lobe oligodendroglioma. A: T2WI; B: T1WI enhanced scan; the pseudo-color maps of C—H are ADC, D, D*, f, DDC, and ɑ maps, respectively. The values of the selected ROI were: 1.32×10-3 mm2/s, 0.949×10-3 mm2/s, 2.85×10-3 mm2/s, 0.423%, 1.24×10-3 mm2/s, 0.923, respectively; I: HE staining map.
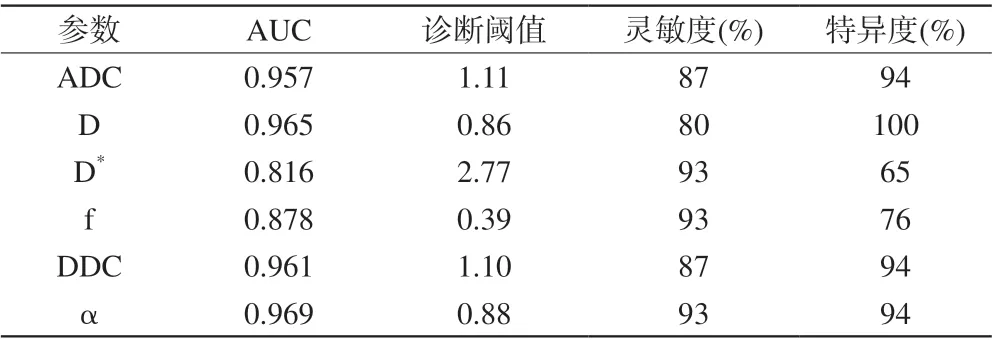
表2 ADC、D、f、D*、DDC及α值在高、低级别胶质瘤的ROC比较Tab. 2 The comparison of ROC in ADC, D, f, D*, DDC and α vaules between high and low grade gliomas
2.3 相关性分析
利用Spearman相关性分析得出:所有研究者D*与CBF值之间呈正相关(r=0.51,P<0.05)。
2.4 ROC曲线
各模型所得参数ROC曲线结果见表2、图3。α、D、DDC、ADC均具有较高诊断效能,其AUC分别为0.969、0.965、0.961、0.957,诊断阈值分别为0.88×10-3mm2/s、0.86×10-3mm2/s、1.10×10-3mm2/s、1.11×10-3mm2/s。
3 讨论
3.1 三种模型的引入
单指数模型DWI是基于水分子信号衰减单一的情况下定量计算出反映组织内水分子扩散状态的ADC值,其与肿瘤细胞增殖情况负相关。然而,ADC值所反映的扩散还包括了一部分灌注的干扰。1986年,Bihan等[1]提出了体素内不相干运动的概念,将组织内的水分子运动假设为细胞内外的慢扩散,和血管内外的快扩散即反映微循环灌注成分。通过双指数模型拟合算法得到灌注参数:假性扩散系数(fast ADC,D*)、灌注分数(fraction of perfusion,f)及真性扩散系数(slow ADC,D),可以将毛细血管网及细胞内外水分子运动分开,从而得到真正的扩散成分。然而Bennett等[2]认为双指数模型过于理想、简单化,未考虑到一些客观因素如涡流、相位移动等的影响。为了更大程度地探索组织内水分子微观特性,他们引入了另一种用于描述组织内水分子连续分布扩散情况及组织异质性的物理模型即拉伸指数模型,得到分布扩散系数及水分子各向异性。目前国内外关于单指数、双指数模型DWI成像已有不少研究,单指数模型DWI逐渐成为常规检查,双指数模型中的灌注参数D*及f值目前尚有争议,而关于拉伸指数模型DWI亦有少量文献应用于胶质瘤术前分级中。
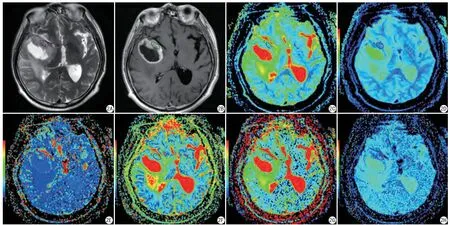
图2 患者,男,64岁,病理结果证实为右颞叶胶质母细胞瘤。A:常规T2WI,病变周围可见大片状水肿;B:T1WI增强扫描,病变呈明显环形强化;C~H的伪彩图分别是ADC、D、D*、f、DDC、α图,所选ROI值分别为:0.745×10-3 mm2/s、0.474×10-3 mm2/s、8.23×10-3 mm2/s、0.325%、0.78×10-3 mm2/s、0.679;I:HE染色图,其内可见核分裂及异型Fig. 2 A 64-year-old male patient with pathology confirmed right temporal lobe glioblastoma. A: Routine T2WI with large edema around the lesion; B: T1-enhanced scan, lesion with obvious ring enhancement; the pseudo-color maps of C—H are ADC, D, D*, f, DDC, and ɑ maps, respectively. The values of the selected ROI were: 0.745×10-3 mm2/s, 0.474×10-3 mm2/s, 8.23×10-3 mm2/s, 0.325%, 0.78×10-3 mm2/s, 0.679, respectively; I: HE staining map in which nuclear fission and nuclear atypia are seen.
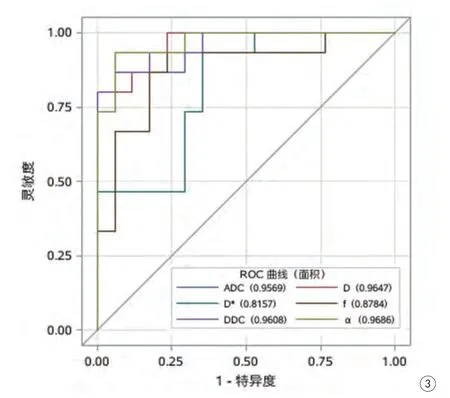
图3 ADC、D、D*、f、DDC及α鉴别高低级别胶质瘤的ROC曲线Fig. 3 The ROC curve of ADC, D, D*, f, DDC and α in identifying high and low grade gliomas.
3.2 扩散参数及扩散异质性指数在胶质瘤分级中的讨论
通过以上3种模型可以得到扩散参数ADC、D、DDC及扩散异质性参数α值。通过比较两组ADC、D值的差异,得出高级别胶质瘤的ADC、D值较低,且D值低于ADC值,这与以往研究相似[3],且D值的AUC高于ADC值。D和ADC值均能间接反映组织中水分子的布朗运动,高细胞密度会阻碍水分子自由扩散,因此恶性程度高的胶质瘤两者均低。但两者不同的是,D值能剔除快速扩散成分的影响,从而反映组织的真实扩散[4]。此外,通过比较各模型伪彩图还可以发现D图在显示肿瘤范围有较好对比度。
本研究还发现高级别胶质瘤的DDC、α值显著低于低级别胶质瘤,这与Bai等[5]、刘志成等[6]、Kwee等[7]的研究结果相似。DDC是拉伸指数模型中反映扩散的参数,代表体素的平均扩散率,是ADC值的加权和,它能克服双指数模型关于快、慢扩散假设的局限,可用于反映胶质瘤扩散特征,与肿瘤密度负相关,有研究还得出DDC值与Ki-67呈负相关[8]。α值是通过拉伸指数模型引入的另一个反映组织的异质性的参数,范围0~1,越接近0,表示组织越不均质。高级别胶质瘤因为它们具有更多组织异质性,如异型的细胞及增生的血管等,因此扩散异质性更高,α值更低。
3.3 灌注参数在胶质瘤分级中的讨论及相关性分析
通过双指数模型得出的另外两个参数可以反映血流灌注,D*值代表的是体素内毛细血管灌注相关成分,主要取决于血流量,f值是灌注分数,主要受血容量影响。D*和f值均与微循环灌注相关,有研究证实[9-10]它们与3D ASL等灌注成像中的灌注参数相关。从理论上讲,高级别胶质瘤的D*和f值均应高于低级别胶质瘤,本研究得到的D*值的统计结果也符合高级别胶质瘤的富血供生物学特性,这与Bisdas等[11]、林园凯等[12]研究相似,而f值却在高级别胶质瘤中低。分析高级别胶质瘤f值较低的原因除与b值设定、入选病例有关,它还与回波时间有关[13]。此外,可能由于高级别胶质瘤肿瘤细胞密度较高,导致细胞间质微血管受压,也会导致其f值降低。因此,f值虽然理论上也反映微循环灌注,但其还有一定局限性,有研究[4,14]得出f与CBF值无相关性或呈负相关,也有研究得出[15]f值在高、低级别胶质瘤组间差异并无统计学意义。本研究相关性结果表明灌注参数D*与CBF值呈正相关,这与林园凯等[12]研究类似,但二者相关性较弱,分析原因可能是由于D*低信噪比,容易受到脑脊液、小血管等影响,稳定性较差造成的。因此,笔者认为D*值虽然可以一定程度上反映肿瘤血流灌注,但是仍然值得去探索研究。
3.4 三种模型所得参数的ROC分析
在胶质瘤分级中,笔者在对所得参数进行ROC曲线分析时得出:α值的诊断效能最好,AUC为0.969,灵敏度及特异度分别为93%和94%,有学者[5]也得出类似结论。本研究还得出:D与DDC值诊断效能接近,均稍高于ADC值,这说明双指数与拉伸指数模型也可真实反映胶质瘤DWI信号的衰减方式。
3.5 本研究的不足之处
本研究存在的问题首先是入选病例样本量小、说服力不足,仍需进一步收集病例来验证本次初步研究结果的可靠性。其次,肿瘤内可能包含不同级别的肿瘤成分(如胶质瘤Ⅱ~Ⅲ级或Ⅱ~Ⅳ级),病理上也很难区分,这可能是本研究D、DDC、ADC值诊断效能接近的最主要原因,为了避免这种情况的发生,应该尽量排除这样的病例。
总之,单指数、双指数及拉伸指数模型DWI能从灌注和扩散异质性方面反映胶质瘤的微观特性,从而为胶质瘤术前的准确分级提供更有价值的信息。
利益冲突:无。

