Ce3+/Mn2+共掺Ca3Y(PO4)3红色荧光粉的制备及其能量传递
冯宁宁,阳结根,杨子諓,张佩雪,王春兰
(1.西安工程大学 理学院,陕西 西安 710048;2.太原理工大学 物理与光电工程学院,山西 太原 030024)
0 引 言
白光LED作为新一代的固体照明光源,具有亮度高、体积小、功耗低、寿命长以及节能环保等优点而被受关注[1-3]。目前,荧光粉转换白光LED是合成白光LED的主要方案。商业用的白光LED主要是蓝光LED芯片激发Y3Al5O12∶Ce3+(YAG∶Ce3+)黄色荧光粉[4]。由于白光LED荧光粉中红光成分的缺失,存在色温高(CCT>7 500 ℃)、显色指数低(CIR<75)等诸多弊端[5-6]。为了克服这些不足,(近)紫外LED芯片激发三基色荧光粉(红、绿、蓝)这种新型的制备方案被广泛采用[7]。然而这种制备白光LED方案的核心内容是需要寻找红、绿、蓝3种高效的荧光粉,尤其是目前紧缺的红色荧光粉。因此,研究紫外光激发的红色荧光粉是非常迫切的工作。
荧光粉主要由基质与发光中心构成。由于磷酸盐基质具有良好的物理化学稳定性,较高的热稳定性和能量传递效率以及合成温度低等优势,近年来,关于磷酸盐系列基质的研究不断涌现。王志军课题组的Ba3Y(PO4)3∶Ce3+/Eu2+/Mn2+荧光粉[8],王雪娇研究的Ba3La(PO4)3∶Ce3+, Mn2+荧光粉[9]以及文献[10]对SrZn2(PO4)2∶Mn2+荧光粉的研究等。早在2006年,Fukuda等[11]就对Ca3Y(PO4)3正磷酸盐的晶体结构做了详细分析,表明Ca3Y(PO4)3正磷酸盐是一种良好的荧光粉基质材料。另一方面,稀土离子由于具有丰富的电子层结构,其发射光谱几乎涉及了从紫外可见光到红外光的全部波段,因此,它是荧光粉作为发光中心的最佳选择[12]。一般而言,根据自旋-耦合作用,Ce3+的基态能级被分裂为2F5/2,2F7/22个光谱支项。电子从5d激发态跃迁到2F5/2,2F7/2基态通常会产生紫外或者蓝光。5d电子轨道暴露在晶体场环境中,当电子从4f能级被激发到5d能级时,受晶体场环境影响,5d能级会形成一个发光带,且拥有较强的光谱强度[12]。Ce3+离子特殊的电子层结构,常被作为一种良好的发光中心,起到敏化作用。然而,Mn2+作为过渡金属离子可用于低成本的白光LED荧光粉中,在500~700 nm之间会产生一个宽的发光带,这主要归因于Mn2+离子4T1(4G)-6A1(6S)的禁戒跃迁。因此,Mn2+离子与稀土离子共掺于荧光粉中可作为良好的活化剂成分。
本文采用高温固相法合成了Ca3Y(PO4)3∶Ce3+, Mn2+红色荧光粉。XRD分析表明,Ce3+/Mn2+单掺和双掺都没有改变Ca3Y(PO4)3的晶体结构,没有多余的杂峰出现。通过改变Mn2+的掺杂浓度,可调节Ca3Y(PO4)3∶Ce3+, Mn2+荧光粉的发光颜色从蓝色到红色。这主要是由于Ce3+→Mn2+之间的能量传递所产生的,能量传递机理为电四极-电四极相互作用。
1 实 验
1.1 样品制备
使用的原材料为CaCO3(纯度 99%),Y2O3(纯度 99.99%),(NH4)2HPO4(纯度 98.5%),CeO2(纯度 99%),MnCO3(纯度>47%)。实验过程如下:(1) 按照化学计量比称取一定的原材料放入玛瑙研钵中充分研磨1 h;(2) 将混合均匀的试剂倒入小坩埚,并放入70 ℃的烘干箱中干燥1 h;(3) 将烘干后的样品移至马弗炉中煅烧(煅烧条件为:CO还原气氛下,升温速率5 ℃/min,恒温温度1 350 ℃,恒温时间10 h[13]);(4) 煅烧结束,将温度自然冷却至1 000 ℃,随即取出样品,使其迅速降温至室温[13],将样品再次研磨得到Ca3Y(PO4)3∶Ce3+, Mn2+样品。样品的制备流程如图1所示。
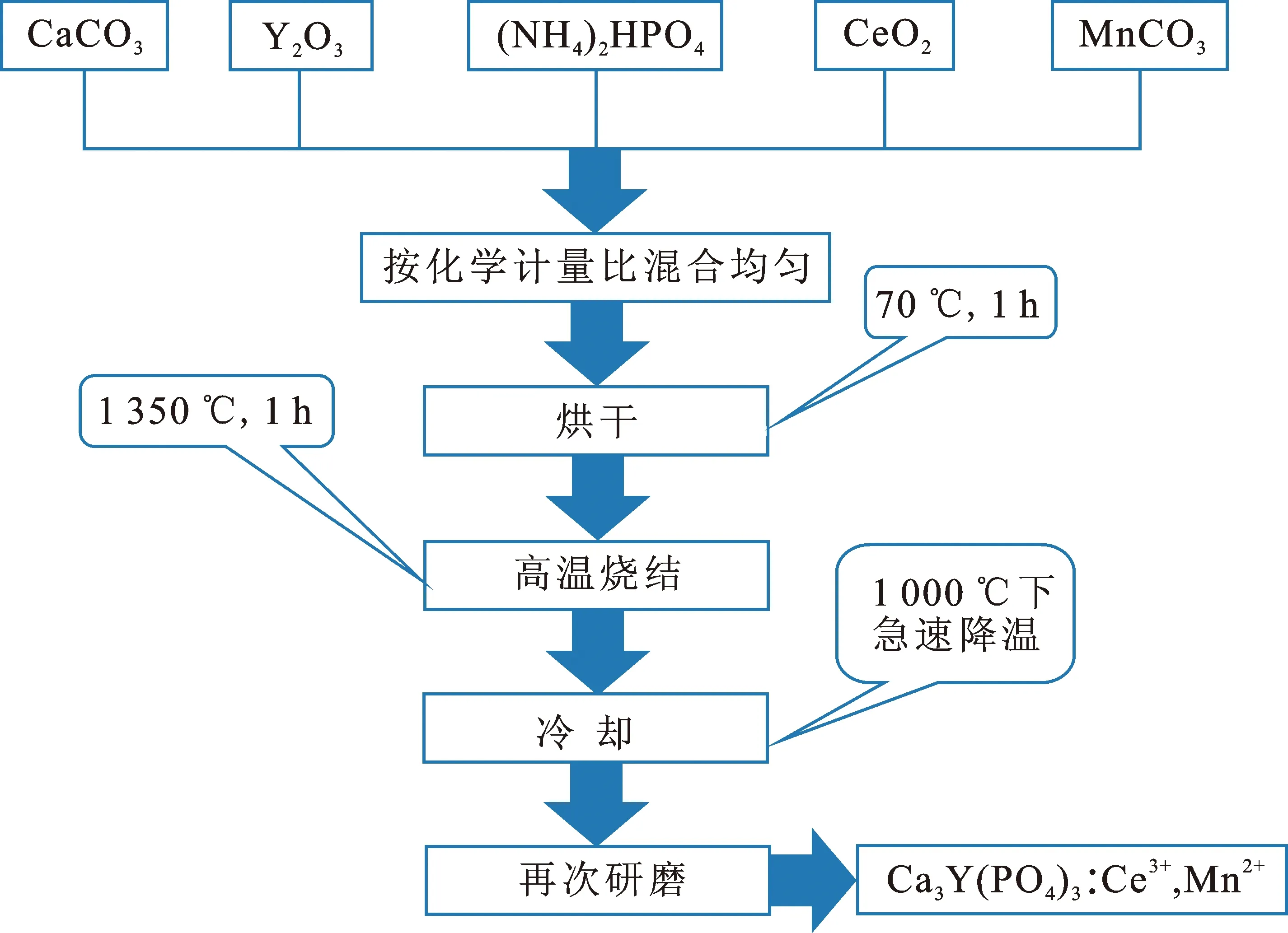
图 1 高温固相法合成Ca3Y(PO4)3∶Ce3+, Mn2+荧光粉的制备流程
Fig.1 Flow chart of preparation of Ca3Y(PO4)3∶Ce3+, Mn2+phosphors via high temperature solid-state method
1.2 样品表征
采用日本岛津的X射线衍射(XRD-6000)分析仪对Ca3Y(PO4)3∶Ce3+, Mn2+荧光粉进行XRD的物相表征。测试条件为:扫描范围10°~70°,扫描分辨率0.02°,光源Cu Kα射线,λ=1.540 6 nm,管电流 30 mA,管电压 40 kV。采用法国HORIBA JY公司的FluorMax-4型荧光分光光度计表征样品的激发发射光谱,150 W无臭氧氙灯作为激发光源,狭缝宽度为5 nm。
2 结果与讨论
2.1 样品物相分析
图2为 Ca3Y(PO4)3∶0.25Ce3+, 0.05Mn2+; Ca3Y(PO4)3∶0.25Ce3+, 0.12Mn2+荧光粉与Ca3Y(PO4)3标准卡片(JCPDS∶44-0319)的 XRD 衍射图[11]。可以看出,随着Ce3+,Mn2+离子的引入, Ca3Y(PO4)3的XRD衍射峰与标准卡片完全吻合,并没有杂峰出现,即没有改变基质的晶体结构。与此同时,根据有效离子半径匹配原则及化合价守恒原则,Ce3+(r=1.01 Å)取代Y3+(r=0.90 Å)的位置, Mn2+(r=0.66 Å) 取代 Ca2+(r=1.00 Å)的位置[14]。
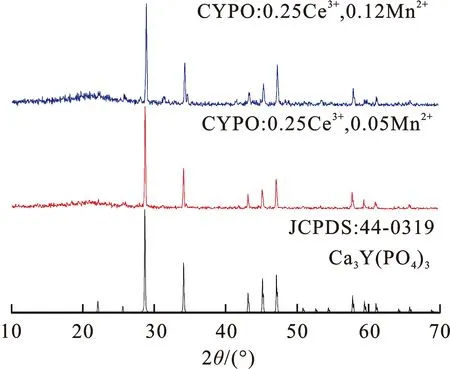
图 2 Ca3Y(PO4)3∶0.25Ce3+, 0.05Mn2+;Ca3Y(PO4)3∶0.25Ce3+, 0.12Mn2+与Ca3Y(PO4)3标准卡片的XRD图
Fig.2 XRD patterns of Ca3Y(PO4)3∶0.25Ce3+, 0.05Mn2+;Ca3Y(PO4)3∶0.25Ce3+, 0.12Mn2+and the standard card Ca3Y(PO4)3
2.2 发射光谱及能量传递机理
Ca3Y(PO4)3∶0.25Ce3+样品的激发与发射光谱如图3(a)所示。监测383 nm的发射峰,得到样品的激发光谱在240~360 nm之间有一宽且强的吸收带,归因于Ce3+离子4f基态到5d激发态的电子跃迁,与紫外光谱范围很好地吻合,表明Ce3+单掺Ca3Y(PO4)3的荧光粉能够被紫外光LED芯片有效激发。Ca3Y(PO4)3∶0.25Ce3+样品在325 nm紫外光激发下,在350~500 nm范围内有一较强的发光带,发光中心位于383 nm,源于Ce3+离子5d激发态电子至4f基态的能级跃迁。Mn2+单掺Ca3Y(PO4)3荧光粉的激发和发射光谱如图3(b)所示。监测波长为627 nm,Ca3Y(PO4)3∶Mn2+荧光粉的激发光谱包含一系列的吸收峰,分别在348,376,412,472 nm处,这些吸收峰主要是由于Mn2+离子从6A1(6S)基态至4E2(4D)、4T2(4D)、[4A1,4E](4G)、4T1(4G)激发态间的能级跃迁。其中412 nm激发峰最强,表明样品在该波长范围内能够被有效激发。Mn2+单掺样品的发射光谱在580~700 nm范围内有一微弱的红色发光带,这是由于Mn2+的4T1(4G)-6A1(6S)的禁戒跃迁所导致。
从图3(a),(b)可以看出,单掺Ce3+(活化剂)的发射光谱和单掺Mn2+(敏化剂)的激发光谱有明显的光谱重叠,表明在Ca3Y(PO4)3基质中,Ce3+→Mn2+存在能量传递效应。图3(c)为Ce3+/Mn2+共掺Ca3Y(PO4)3的激发及发射光谱。可以看出,同时监测波长为383 nm和627 nm,其激发光谱轮廓基本一致,证明Ce3+和Mn2+之间可能存在能量传递。其发射光谱包含2个不同的发光中心分别在383 nm和627 nm,源自于Ce3+的5d-4f电偶极允许的跃迁和Mn2+的4T1(4G)-6A1(6S)的禁戒跃迁。
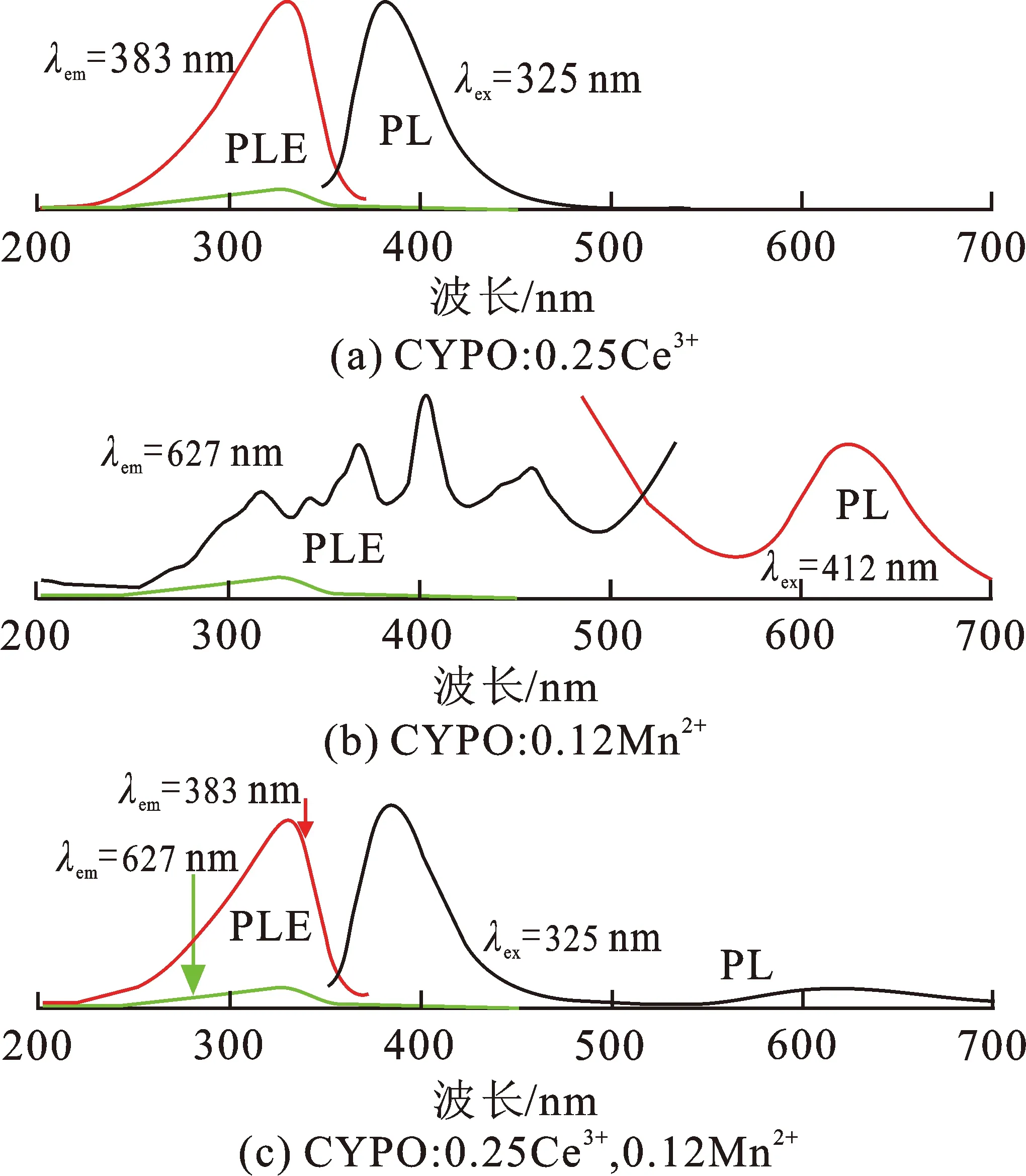
图 3 样品的激发和发射光谱
Fig.3 The emission and excitation spectra of the samples
为调节出高亮度的红色荧光粉,Ce3+离子作为敏化剂被引入Ca3Y(PO4)3∶Mn2+荧光粉中。在波长325 nm紫外光激发下,Ca3Y(PO4)3∶0.25Ce3+,zMn2+(0.01≤z≤0.12)荧光粉的发射光谱如图4(a)所示。样品的发射光谱由蓝色光谱带(源自Ce3+离子)和红色光谱带(源自Mn2+离子)2部分组成。随着Mn2+离子浓度的增加,Ce3+离子的发光强度逐渐下降,而Mn2+的发光强度不断增强,如图4(b)所示,Ce3+→Mn2+间存在能量传递。与此同时,随着Mn2+浓度的增加,其发光中心在615~627 nm范围内逐渐红移,如图4(a)所示。由于离子半径较小的Mn2+离子取代基质晶格中离子半径较大的Ca2+离子位置,使其Ca2+/Mn2+—O的键长缩短,增强了Mn2+离子周围的共价性强度,晶胞收缩,晶体场劈裂增强,引起Mn2+离子由基态到激发态的能量差减小,从而导致Mn2+的发光中心光谱红移[15]。在Ca3Y(PO4)3∶Ce3+, Mn2+荧光粉中,Ce3+→Mn2+的能量传递效率ηET可根据公式(1)推导[16-17],即
ηET=1-IS/IS0
(1)
式中:IS0和IS分别代表没有掺杂Mn2+与掺杂Mn2+的Ca3Y(PO4)3∶Ce3+, Mn2+荧光粉中Ce3+离子的发光强度。如图4(c)所示,Ce3+→Mn2+的能量传递效率随着Mn2+掺杂浓度的增加而逐渐增大,当Mn2+的浓度达到0.12 mol时,其能量传递效率达到最大值75%。表明在Ca3Y(PO4)3∶Ce3+, Mn2+荧光粉中,从Ce3+到Mn2+存在有效的能量传递。图4(d)为从Ce3+到Mn2+的能级图,在紫外光(UV)激发下,Ce3+的4f基态电子吸收了部分光子,跃迁至较高的5d激发态。由于激发态能级不稳定,一部分能量以热辐射的形式被消耗;另一部分通过辐射跃迁,以光子的形式被释放。然而,释放的能量一部分被Mn2+离子吸收,使得Mn2+的基态电子跃迁到较高的激发态,而后较高激发态的电子通过交叉驰豫回到最低激发态,又通过辐射跃迁的形式释放出光子回到基态,形成不同波长的可见光[18]。

(a) Ca3Y(PO4)3∶0.25Ce3+,zMn2+的发射光谱
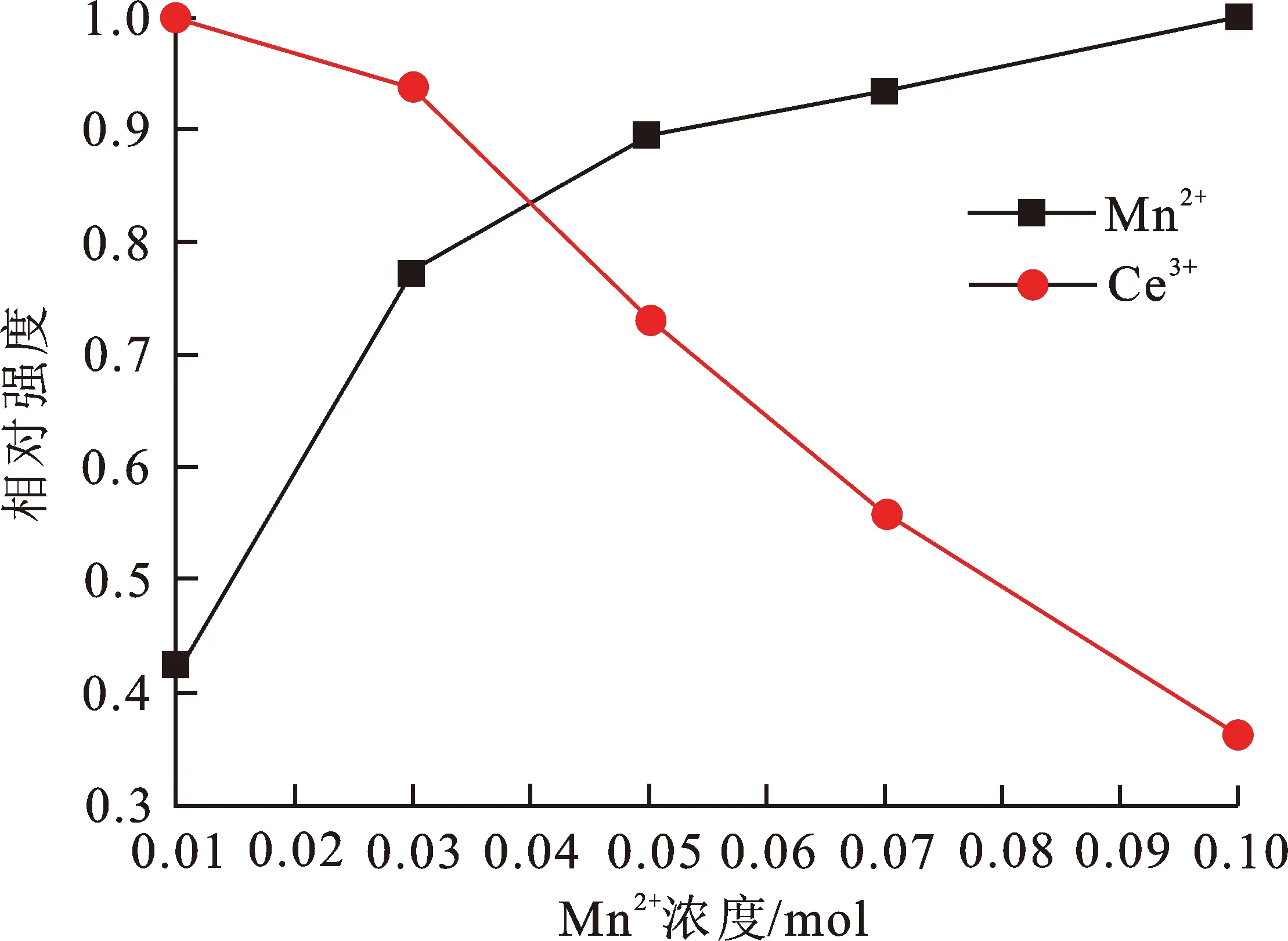
(b) Ce3+和Mn2+发光强度与Mn2+浓度的关系

(c) Ce3+→Mn2+的能量传递效率与Mn2+浓度的关系
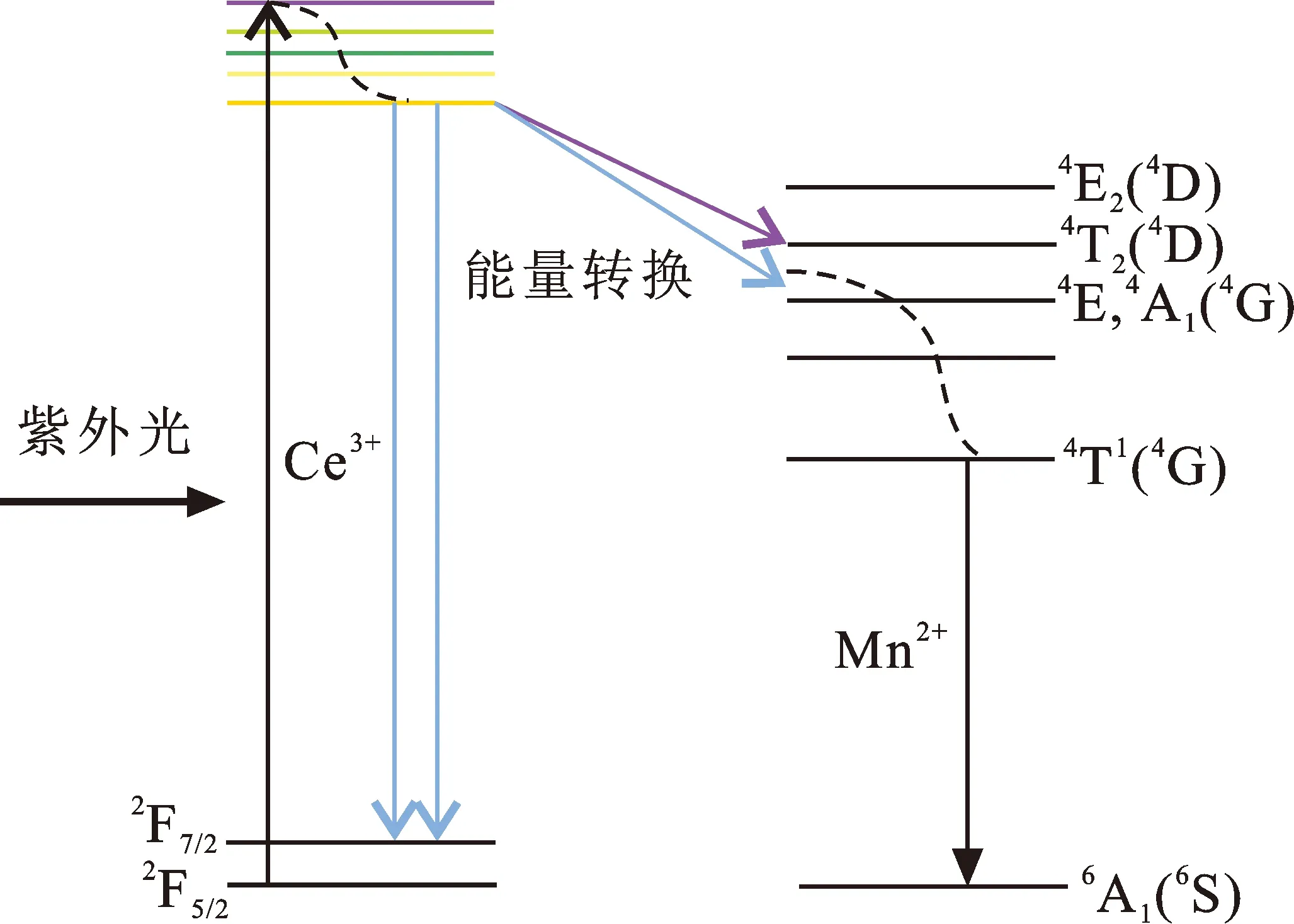
(d) Ce3+→Mn2+的能级结构图图 4 荧光粉的发射光谱图及Ce3+→Mn2+能级结构图
一般来说,从敏化剂到活化剂的能量传递机理可分为2种:电子交换相互作用和电多极矩相互作用[2]。而电子交换相互作用的前提条件是敏化剂与活化剂两相邻离子间的临界距离在5 Å左右[19]。以Blasse[19]提出的发光中心间的临界距离RC(见式(2))[20-21],进一步确定浓度猝灭机理。
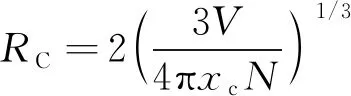
(2)
式中:V为晶胞体积;xc为敏化剂与活化剂总的掺杂浓度;N为单位晶胞体积内阳离子的个数。在Ca3Y(PO4)3∶Ce3+, Mn2+荧光粉中,V=951.14 Å3,xc=0.37 mol,N=4[13]。由此可知,临界距离RC=10.71 Å ,远大于5 Å。因此,从Ce3+到Mn2+的能量传递机理主要为电多极矩相互作用。电多极矩相互作用又可分为3种,根据Dexter理论以及精修近似理论推导公式计算[22-23],即
I0/I∝Cα/3
(3)
式中:I0为未掺杂Mn2+时Ce3+的发光强度;I为在Mn2+存在时Ce3+的发光强度;C为Ce3+和Mn2+掺杂的浓度之和。在电多极矩相互作用中,当α=6,8,10时,分别表示电偶极-电偶极相互作用(d-d)、电偶极-电四极相互作用(d-q)、电四极-电四极相互作用(q-q)[24]。图5为I0/I与Cα/3的拟合关系图。不难看出,α=10的拟合度最高。该结论表明,从Ce3+到Mn2+的能量传递机理为电四极-电四极相互作用。

图 5 Ce3+的I0/I与Ce3+和Mn2+离子浓度和的C6/3, C8/3和C10/3关系图
Fig.5 Dependence ofI0/Iof Ce3+on Ce3+and Mn2+concentration ofC6/3,C8/3andC10/3
2.3 色度坐标图
根据Ca3Y(PO4)3∶0.25Ce3+,zMn2+(0.01≤z≤0.12)荧光粉的发射光谱数据推导出样品的色度坐标,如图6所示。可以看出,随着Mn2+浓度的增加,合成样品的发光颜色能够被调节,从蓝色逐渐向红色移动。当Mn2+离子掺杂浓度达到0.12 mol时,样品的色度坐标为(0.406, 0.221)在红色区域,归因于Ce3+→Mn2+之间的能量传递。
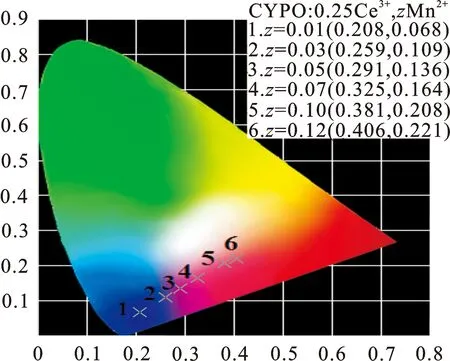
图 6 Ca3Y(PO4)3∶0.25Ce3+, z Mn2+ (0.01≤z≤0.12)荧光粉的色度坐标图
Fig.6 The chromaticity coordinate diagram of Ca3Y(PO4)3∶0.25Ce3+,zMn2+(0.01≤z≤0.12) phosphors
3 结 论
本文采用高温固相法成功制备一种新型的Ca3Y(PO4)3∶Ce3+, Mn2+红色荧光粉。
(1) XRD物相分析表明,Ce3+/Mn2+离子的引入并没有改变Ca3Y(PO4)3基质的晶体结构。在波长325 nm紫外光激发下,Ca3Y(PO4)3∶Ce3+, Mn2+样品的发射光谱包含2个较宽的光谱带,分别为350~500 nm(Ce3+离子的5d-4f能级跃迁)和580~700 nm(Mn2+离子的4T1(4G)-6A1(6S)能级跃迁)。
(2) Ce3+→Mn2+间存在有效的能量传递效率,效率值可高达75%。电四极-电四极相互作用为Ce3+→Mn2+的能量传递机理。
(3) 通过改变Mn2+离子的掺杂浓度,可以调节出Ca3Y(PO4)3∶Ce3+,Mn2+红色荧光粉,其色度坐标为(0.406,0.221)。这种红色荧光粉在紫外光激发的白光LED中有望获得极大的应用价值。

