达托霉素菌种16SrRNA基因序列分析和遗传稳定性检验
李爱锋

摘 要:近几年来,达托霉素需求量猛增,作为次级代谢产物,由于结构比较复杂,达托霉素的产量极低。通过各种方法选育达托霉素高产菌株,保证种子批的遗传稳定性,对于提高达托霉素生产质量和产量,降低生产成本具有重要意义。大量试验表明,达托霉素在培养与保存过程中,可能会因培养液、保存环境等产生变异,从而降低甚至失去其在临床医学上较高的应用价值,而研发性能稳定、耐药菌抑制效果更好的达托霉素,对达托霉素菌种进行培养与筛选,获得质量好的菌种,降低菌种遗传变异的机率,改良达托霉素的生产工艺和提升达托霉素的产量就必须要对达托霉素菌种的16SrRNA基因序列开展分析并对其遗传稳定性进行检测。立足笔者工作实际,本文致力于对恒瑞医药的原辅料达托霉素菌种实施检验,确定恒瑞医药提供的菌种的遗传稳定性,为达托霉素的生产工艺优化与产量提升提供支持。
关键词:达托霉素;16SrRNA基因序列;遗传稳定性
1.前言
临床医学中,耐万古霉素粪肠球菌、耐万古霉素金黄色耐甲氧西林金黄色葡萄球菌以及耐甲氧西林金黄色葡萄球菌等是目前在医院中传播速率较快,致死率较高的病原体,由于抗生素滥用问题越来越普遍,细菌耐药性不断增强,采用普通抗生素对这些细菌的灭杀作用效果甚微,一旦发生感染,患者病情难以控制,最终很有可能导致患者因感染加深而病情加深,甚至不治。达托霉素是一种新型环脂肽抗生素,主要用于治疗耐药革兰氏阳性菌造成的感染,能够快速杀死绝大多数的细菌,不易受到其他抗生素所产生的交叉耐药性的影响,市场前景一片广阔,被誉为制剂简单、对耐药菌抑制效果良好、毒素作用小抗生素之一。
2013年,达托霉素在美国上市,被批注能用于治疗皮肤结构感染与复杂皮肤感染,如皮肤溃疡和术后切口感染,以及革兰阳性菌引起的各种严重感染,其中就包括了对甲氧西林敏感的右侧心内膜炎,菌落获得性肺炎和VRE感染。其副作用较小,安全性颇高,被临床医学界誉为耐药菌感染的最后一道防线。
据有关数据显示,2016年,达托霉素的全球销量超过了20亿美元。同年,我国食品药品监督总局批准华东医药和恒瑞医药生产达托霉素,学术研究界及医药行业致力于研究达托霉素的工业批量生产方法,就目前而言,发酵法依然是达托霉素生产中最为重要的方法,但菌种培养过程中,很可能由于外界因素的变化而影响达托霉素的遗传稳定性,所以,对菌种实施16SrRNA基因序列分析和遗传稳定性检验是必要的。
2 达托霉素的概述
2.1达托霉素的结构
达托霉素是一种由玫瑰孢链霉菌发酵而来的环脂肽结构的新型抗生素,临床上属于脂蛋白抗生素,达托霉素分子由连接到一个环状 13 - 氨基酸肽的 N - 末端色氨酸上的癸酰基侧链构成。
达托霉素天然存在于土壤腐生营养玫瑰孢链霉菌发酵液中的,生物医学领域采用各种方法提取而来,作为玫瑰孢链霉菌经过发酵产生一组脂多肽混合物,色氨酸N的末端含有不同长度的脂肪链,是人类发现的第一个脂肪类抗生素。
化学分子式是C72H101N17O26,分子量为1620.67,精确质量为1619.71,熔点在202-204oC之间。被作为医药中间体,应用于临床医学中,注射试剂呈现为微浅黄色或黄色的晶体粉末,较易溶解于水,在碱性溶液和酸性溶液中可大量溶解,也较易溶解于小分子的有机溶剂中。
2.2达托霉素的作用机制
关于达托霉素的具体作用机制,目前并没有较为权威的定论,就目前的研究结果而言,仅能证明达托霉素是一种Ca2+依赖性抗生素,与其他类型抗生素的作用机制有明显的差别,达托霉素虽不能穿透细胞膜,但在与Ca2+结合之后,达托霉素将以非共价键的形式结合到细胞膜蛋白上,细胞膜上的达托霉素结合蛋白成为其作用靶位,达托霉素亲脂尾部在细胞膜上起到了“离子通道”的作用,能够阻碍细菌细胞壁中脂类物质的生物合成,从破坏细菌的细胞膜,导致内容物溢出,而达到细菌深度灭杀的效果,因此,最大限度的避免了细菌疯狂繁殖而导致的炎症反应。达托霉素良好的耐药性正源于其特殊的作用机制,生物制药公司的试验阶段,没有发现达托霉素对其他类型的抗生素有不利影响,临床实验阶段,也并未发生达托霉素于其他类型抗生素的交叉耐药问题。
临床试验表明,达托霉素溶于水后非常稳定,在室温条件下可保存长达7天,但在酸碱性发生变化时,达托霉素也较为容易变性,这种变性是不可逆的[4],从目前的应用效果来看,因各种原因引起的耐药在临床实验中是较为罕见的。
2.3达托霉素的生产
目前,用于治療威胁身体系统乃至生命的革兰氏阳性菌所造成的各种感染的达托霉素的生产,有三种方法:微生物发酵法、生物合成法和化学合成法。
微生物发酵是目前应用中最重要的方法,采用较多的为前体诱导法,在玫瑰孢链霉菌发酵的过程中,添加癸酸,令达托霉素的前体A21978C通过酰化作用,与癸酸产生连接,合成最终的达托霉素。实验表明,加入癸酸使得达托霉素的产量获得了大幅提升。但在实际生产中,利用天然发酵的方法来生产达托霉素,产量显然无法满足市场需求,研究学者开始探索达托霉素培养基,采用激光诱变、代谢网络分析等工艺,提升达托霉素的产量,效果显著。
化学合成法要突破氨基酸单体的来源过少的问题,由于达托霉素结构中含有非蛋白氨基酸和D型氨基酸,大量学者要需要绕过疑难问题,绕过国外专利保护,突破性的进行合成,虽然我国徐红岩和钦传光采用不同方法合成了达托霉素,但由于的操作复杂、成本较高的问题,目前还未能实现工业批量生产。
生物合成法的探索,国内研究学者投入了巨大精力,达托霉素是一种非核糖体合成的抗生素,研究学者解决了达托霉素合成基因簇的结构与功能,并且利用对遗传基因簇的遗传性操作,试图寻找出比达托霉素更具优势的衍生物,由于还处于研究试验阶段,也未实现工业化生产。
3.达托霉素批的16SrRNA基因序列分析和遗传稳定性检验
3.1 实验材料
3.1.1 菌种
由江苏恒瑞医药股份有限公司提供的样品MS-1,原辅料达托霉素种子批。
3.1.2 主要培养基、试剂及缓冲液配置
2升LB培养基的配制:分别称取氯化钠(AR)20.0克,胰化蛋白胨(CP)20.0克,酵母抽提物(CP)10.0克于2升洁净干燥的刻度烧杯中,加入约1.8升蒸馏水,用玻璃棒搅拌至溶解均匀,再用蒸馏水定容至2.0 升。
磷酸盐母液配方:340mmol/L KH2PO4/1.44 mol/L K2HPO4的溶液4.62g的磷酸二氢钾和25.08g磷酸氢二钾(32.86g K2HPO4.3H2O)溶在足量的水中,使终体积为100ml。
Platinum R TaqDNA聚合酶、缓冲液体系、定制引物均由LifeTechnologiesTM提供;TA克隆使用的是TAKARA的pMDTM18-TVectorCloningKit;基因组DNA提取试剂盒,凝胶回收试剂盒,质粒小抽试剂盒均由上海硕美生物提供。
3.1.3 培养基分装灭菌处理
将配好的培养基溶液分装于专用试剂瓶内,盖紧瓶盖后再将瓶盖拧松一圈(防止高压下瓶子爆裂),并在瓶盖外包上铝箔纸。同批培养基若有不同种类,标注特别标识。
把装有培养基的试剂瓶放入灭菌锅内灭菌,设定灭菌温度为121摄氏度、时间为20分钟、压力控制在0.1-0.15MPa。灭菌完毕后,从灭菌锅中取出试剂瓶,将其冷却至室温(不烫手便可)后,将瓶盖拧紧,放入冰箱中冷藏备用。
3.1.4 培养基加入抗生素处理
实验前,分别在上述已经冷却的培养基中加入一定体积的AMP/KAN储备液,配成AMP/KAN抗生素培养基。
其它抗生素培养基在实验过程中加入,在无抗性的培养基中加入一定体积的储备液,具体添加储备液浓度、加药量、加水量、加乙醇量、培养基中储备液加入量如下表所示。
储备液的配制溶剂为乙醇(AR)或去离子水,自行保存管理,放置于冰箱冷冻室进行保存,保存期限为六个月。
3.1.5 实验仪器
采用ABI9700型PCR仪进行PCR扩增,使用ABI3730XL型DNA测序仪进行测序。
3.2 16SrRNA基因序列分析试验方法
3.2.1 试验步骤
按照以下的方法步骤,开展16SrRNA基因序列分析:
第一步 根据目的序列设计并合成16s序列,引物序列如下图;
第二步 按试剂盒说明操作,从提供的菌体中提取出基因组DNA;
第三步 以提取的模板和设计的引物进行PCR反应,2%琼脂糖凝胶电泳检测产物;
第四步 产物直接测序,双向引物测通,同时进行TA克隆;
第五步 TA克隆测序结果出来后与产物结果进行比对,是否一致;
第六步 对测序结果进行Blast,并展示结果。
3.2.2 结果与数据分析
(1)鉴定结果
鉴定结果如图1所示(图a为DL2000标准maker,图b为pcr产物跑胶鉴定结果及与maker的对比),电泳跑胶结果显示片段大小在1500bp左右,与16S rRNA序列理论大小一致。
(2) 样品MS-1测定序列
样品MS-1测定序列如下表所示:
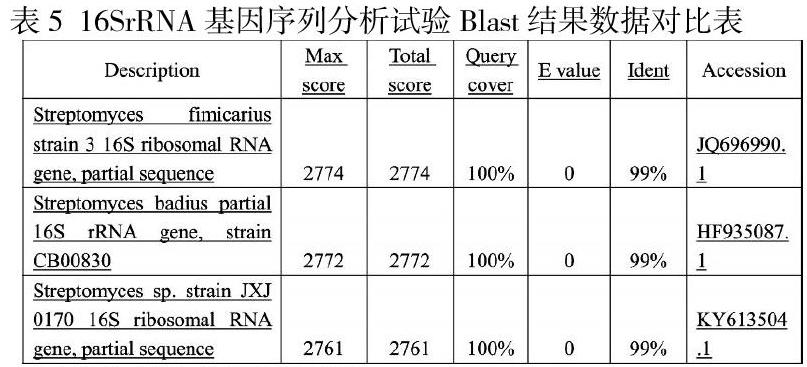
(3)Blast结果
通过NCBI网站进行数据比对, Blast结果如下表所示:
3.3 遗传稳定性检测试验方法
3.3.1 试验步骤
按照以下的方法步骤,开展遗传稳定性检测试验:
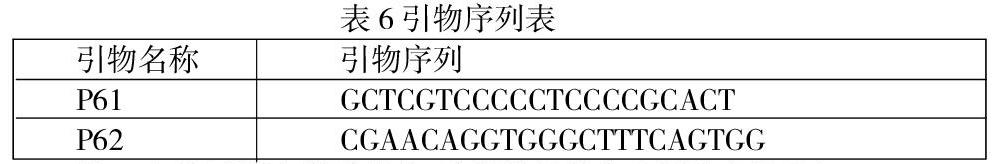
第一步 根据目的序列设计并合成特异引物,引物序列如下表;
第二步 按试剂盒说明操作,从提供的菌体中提取出基因组DNA;
第三步以提取的模板和设计的引物进行PCR反应,2%琼脂糖凝胶电泳检测产物;
第四步产物可以直接测序,双向引物测通,同时进行TA克隆;
第五步TA克隆测序结果出来后与产物结果进行比对,是否一致;
第六步对测序结果进行Blast,并展示结果。
3.3.2 结果与数据分析
(1)鉴定结果
鉴定结果如图2所示(图a为DL2000标准maker,图b为pcr产物跑胶鉴定结果及与maker的对比): 电泳跑胶结果显示片段大小在700bp左右,与分析遗传稳定性的特征序列理论大小一致。
(2)样品MS-1测定序列
样品MS-1测定序列如下表所示:
(3)Blast结果
NCBI网站进行数据比对,结果如下表:
结论:目的条带明显,大小在600-700bp左右,与Streptomyces 菌株同源性最高为99%。
4.结论与讨论
测得16S rRNA序列与Streptomyces 菌株同源性最高为99%,NCBI网站进行数据比对,Streptomycessp同源性達到99.86%。表明江苏恒瑞医药股份有限公司提供的样品MS-1,原辅料达托霉素种子批是能够稳定表达和传代的菌株,可用于医药工业批量生产中。
参考文献:
[1] 高芳霞,俞岩青,王昆蓉,谢云,张洪兰,冉启平,田敏. 常压室温等离子体及紫外复合诱变选育达托霉素高产菌株[J]. 中国抗生素杂志,2016,41(06):425-428.
[2] 廖国建,何颖,谢建平. 以达托霉素产生菌菌株改造为主线的微生物工程综合实验的探索和实践[J]. 微生物学通报,2018,45(03):713-716.
[3] 刘体颜. 达托霉素生物合成基因簇异源表达及调控机制初步研究[D].安徽大学,2013.
[4] 范晶华. 达托霉素高产菌株选育及发酵条件优化[D].天津大学,2007.
[5] 杨一恭. 达托霉素的菌种选育及发酵条件的优化研究[D].浙江工业大学,2015.
[6] 卢文玉,闻建平,范晶华,曹博翔,孙冰. 激光诱变玫瑰孢链霉菌结合链霉素抗性筛选法选育达托霉素高产菌株[J]. 微生物学通报,2006(03):114-117.
[7] 张智翔,段然,敬科举,吴意珣,卢英华. 组合抗性筛选法选育达托霉素高产菌株[J]. 中国抗生素杂志,2012,37(03):202-206+219.
[8] 洪娟,刘佳佳. 达托霉素的作用机制和药物来源的研究进展[J]. 广州化工,2012,40(09):28-30.

