苯炔在有机合成中的应用
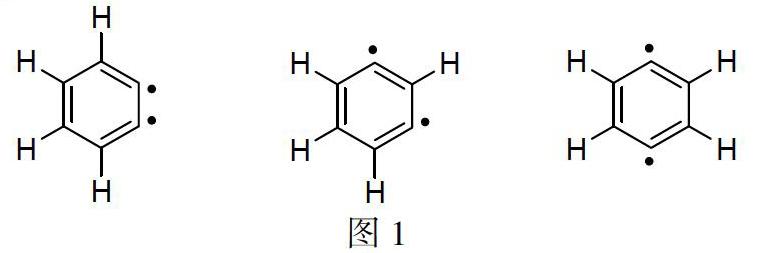
苯炔作为有机化合物中活泼的中间体,反应活性高,在低温条件下就可以发生反应。苯炔是指缺失两个氢原子的去氢苯,它主要包括三种结构,分别为l,2-去氢苯、l,3-去氢苯、l,4-去氢苯(图1),但一般情况下仅指1,2-去氢苯及其杂环类似物。它参与的反应大致分为三类:周环反应、亲核加成反应和过渡金属催化的反应。其中周环反应就可以大概分为四种,主要包括D-A反应;[2+2]环加成反应;l,3-偶极环加成反应;1,4-偶极环加成反应;苯炔参与的ene反应。苯炔的亲核加成反应分为多种,最主要的是:与氮和碳负离子的亲核加成反应。苯炔的过渡金属催化反应主要是通过钯催化反应制备多环芳基化合物。
1 周环反应
1.1 Diels-Alder反应
苯炔中碳碳三键的亲电性很强,在周环反应中可以转化成环戊二烯、呋喃、吡咯、四苯基环戊二烯酮等,然后再与其他试剂发生加成反应。Snieckus等先用邻硅基芳基磺酸酯生成了中间体苯酰胺苯炔,再将苯酰胺苯炔与呋喃反应,最后得到了产率为63%的环加成的产物。同样,氨基甲酸酯苯炔也可以与呋喃发生Diels-Alder反应,并且生成与其相似的产物,且产率为79 %,比上述苯酰胺苯炔与呋喃反应的产率都高。
Buszek等人发现,二卤素取代的吲哚,会在叔丁基锂的乙醚溶液中失去卤素原子生成苯炔的衍生物,然后衍生物与呋喃进一步发生加成反应,也会生成萘的衍生物。Guitián小组将苯炔与两分子的呋喃发生反应,苯炔会与呋喃发生两次Diels-Alder反应的串联过程,然后选择性的得到了多芳环衍生物,再将多芳环衍生物经过酸化等简单操作,最终合成了大稠环芳烃。李健等以CsF为催化剂,将苯炔在60℃条件下与亚甲基吲哚酮发生反应,在这种反应方法下可以生成含有萘结构的吲哚酮,这种方法在以后制备含萘结构吲哚酮中起到了关键的作用。
1.2 [2+2]环加成反应
苯炔可以参与各种类型的反应,其中与烯烃的加成反应就有很多的报道,苯炔与烯烃主要发生[2+2]环加成发应,并且都可以生成苯并环丁烯衍生物[24]。苯炔与烯烃反应时,可以得到很好的收率,因为苯炔的亲电性很强,很容易与烯烃发生反应,所以该方法是制备苯炔中间体最简单、直接的方法。
Mohamed等发现苯炔和芳香醛反应可以生成氧杂蒽化合物,苯炔和芳香醛的当量比为2:1,该反应苯炔先与羰基[2+2]环加成,然后分子内重排,最后与另一分子的苯炔发生[4+2]环加成反应。Hamura小组发现在过量碱的条件下,以当量比1:2将二(三氟磺酰基)二碘苯与乙烯酮甲硅烷基反应,会发生缩醛反应,其中起主要作用的是苯炔上的甲氧基,最终生成了双加成的产物。Hayashi小组将2-(三甲基硅基)苯基磺酸酯在CsF的催化作用下,与烯胺的不饱和键发生反应最终生成苯炔,这个反应主要是2-(三甲基硅基)苯基磺酸酯的不饱和键与烯胺的不饱和键发生反应,在反应中会发生两次环加成反应,首先是苯基磺酸酯与烯胺分子外的加成,再是苯基磺酸酯与烯胺反应物间分子内的加成,最后得到最终的产物。
1.3 1,3-偶极环加成反应
苯炔以杂原子为中心的l,3-偶极体系的环加成反应的报道特别多,亲偶极体系也可以是含碳、氮、氧、硫的重键化合物,科学家们在制备苯并五元环时经常用到该反应,但是以碳为核心的环加成反应的报道十分少,几乎在文献中找不到。
1.4 1,4-偶极环加成反应
在化学反应中蒽醌和葸酮中间体的生成就是苯炔与1,4-偶极化合物的环加成。Biehl等在蒽醌和葸酮的合成上应用了此方法,在此之前,该方法从来没有被使用过,此反应是第一次被使用,为后来蒽醌和葸酮中间体的合成奠定了基础。
1.5 苯炔参与的Ene反应
苯炔的ene反应在有机合成中几乎就没有应用。Cheng等将有机中间体苯炔与含有炔丙基氢的炔烃反应,最终生成了苯基联烯化合物,这为苯基联烯化合物的制备在有机化学中的制备研究出了一种新方法。
2 亲核加成反应
2.1 与氮亲核试剂的反应
氮试剂的亲核能力特别强,可以与苯炔发生亲核加成反应生成N-取代的芳香类化合物。2005年,Ohshita等人报道了苯炔与N-Si双元素试剂的亲核加成。该反应能够与苯环邻位的两个取代基都发生反应,可以用来合成多取代的苯类化合物。
2.2 与腈类碳负离子的亲核加成
在碱性条件下,氰基C≡N会失去质子,变成活泼的碳负离子,再与苯炔发生反应。早在1978年,Oppolzer就报道了分子内的氰基碳负离子与苯炔加成反应生成苯并环丁烷。此方法后来用于合成类固醇和生物碱。
2.3 与烯醇碳负离子的亲核加成
烯醇负离子作为一类活泼的碳负离子,也能跟苯炔发生很多反应。Zouaoui小组将苯炔与环酮类化合物烯醇负离子进行亲核加成,制得了苯并环丁烷类化合物。
3 过渡金属催化的反应
2008年,Yamamoto小组将苯炔与零价Pd催化的烯丙基氯反应,得到菲类化合物,它的反应机理普遍适用于过渡金属催化的苯炔反应,而且过渡金属催化的苯炔的三组分反应是一种有效的制备取代芳香类化合物的方法,一旦被發现,便成为化学家们研究的热点。最近,Cheng将苯炔在金属镍的催化下,与烯烃反应生成镍杂的五元环中间体,然后再与硼酸类化合物反应,最终得到了双取代的芳香化合物。
4结论
苯炔作为有机中间体,在天然产物、药物和功能材料分子中可以合成芳香环结构,一直以来深受人们的关注。因为其结构的特殊性以及较高的反应活性,所以在有机合成化学和天然产物的合成领域应用很广泛。更加重要的是苯炔的反应条件都比较温和,而且耗能低,污染也小,对环境也友好。这使得苯炔在合成含芳香结构化合物中具有重大研究意义和价值。本文通过对苯炔参与的反应进行综述,希望能读相关的研究工作者提供一定的借鉴和参考。
参考文献
[1] 仵清春,李保山,石常青等. 苯炔前体邻-三甲硅基苯酚三氟甲磺酸酯的合成[J]. 合成化学,2007,
[2] 黄宪,陈振初. 有机合成化学[M]. 化学工业出版社,1984,118:987-994.
作者简介:张志鹏(1998-),男,四川省成都,药学专业本科生。

