一种以海藻酸钠、羧甲基纤维素为主要成分的止血微球的皮肤致敏、皮内反应和溶血试验研究
袁丽欣 徐炜区 林柏佑 臧德跃

摘要: 目的:对一种以海藻酸钠、羧甲基纤维素为主要成分的止血微球进行皮肤致敏、皮内反应和溶血试验研究,为该种止血微球在医学临床使用提供生物安全依据。方法:根据GB-T 16886中豚鼠最大剂量试验、动物皮内反应试验和与血液相互作用试验选择的要求进行试验。结果:皮肤致敏试验动物在观察期内致敏反应等级均为0;皮内反应试验动物在观察期内的反应均为无红斑、无水肿;溶血率为0.9%。结论:该种止血微球无致敏反应和皮内反应,溶血率符合标准要求范围内,可进一步用于临床研究。
关键词:止血微球 皮肤致敏 皮内反应 溶血
【中图分类号】R322 【文献标识码】A 【文章编号】2107-2306(2019)04-241-04
止血对术中减少失血、保持术中视野清晰、防止重要组织损伤、保证手术安全以及术后创口愈合等均有重要意义,止血微球可用于各种复杂、大面积、喷射状出血的迅速止血,颗粒状分子迅速吸收血液中的水分【1】,并将血液中有形成分(如血小板、红细胞、白蛋白、凝血酶和纤维蛋白等)聚集在颗粒表面,形成一种凝胶混合物,达到即刻止血的功效。目前市面上大部分止血微球产品以壳聚糖为主要成分,本文所研究的止血微球主要成分为海藻酸钠、羧甲基纤维素,海藻酸钠是来源于褐藻中的一种海藻多糖,由于其强成胶性能,可在伤口表面形成凝胶,减轻病人的疼痛和预防伤口的二次出血【2】;羧甲基纤维素是天然纤维素与氯乙酸经化学改性得到的一种衍生物,其水溶液具有增稠、成膜、黏结、水分保持、胶体保护、乳化等作用【3】。由于该成分的止血微球作为一种表面接触医疗器械,直接用于出血体表,不仅需要具有良好的止血性能,还需要良好的生物相容性,生物相容性是指生物医用材料与人体之间相互作用产生的各种生物、物理、化学反应的性质,包括组织相容性、力学相容性、血液相容性以及免疫相容性等方面,是评价生物材料安全性与功能性的重要指标,也是生物材料研究中始终贯穿的主题【4】。本文主要对该产品生物相容性中的皮肤致敏、皮内反应及溶血的作出试验研究,皮肤致敏试验采用最大剂量法,最大剂量法为最敏感的方法【5】,皮内试验通过皮内注射材料浸提液,对材料在试验条件下产生刺激反应的潜能做出评定;溶血被认为是一种重要的反映材料与血液相互作用的筛选试验【6】。通过以上三个试验对主要成分为海藻酸钠、羧甲基纤维素的止血微球进行评价,为该产品的发展及其在生物临床应用中提供安全可靠的依据。
1试验材料
1.1试验样品
试验样品为止血微球,在无菌操作下,根据厂家提供该样品的无膨胀吸收量,加入相应生理盐水后充分溶胀后,根据GB16886.12的标准要求加入相应浸提介质,轻轻振摇,将微球充分浸泡在并均匀分散在浸提介质中,置37℃恒温烘箱中浸提72小时,72小时后将浸提液和浸泡后的微球全部转移到离心管中,2646×g离心10分钟,取浸提液上清经0.22μm有机滤膜过滤后作为试验的样品溶液。
1.2试验体系
普通级白化豚鼠50只,雌雄兼用,雌鼠未产并无孕,体重范围:300g~400g,动物来源,广州市花都区花东信华试验动物养殖场生产许可证号:SCXK(粤)2014-0023;
新西兰兔,体重范围:2.5kg~2.8kg,动物来源:广东省医学试验动物中心,生产许可证号:SCXK(粵)2018-0002。
试验动物管理按照ISO 10993-2的规定进行,每天供给由广东省医学试验动物中心提供的饲料,给予合格生活饮用水。监测每日的室温,并将温度范围控制在20℃~26℃之间。监测每日的室内湿度,相对湿度控制在40%~70%范围。
1.3主要试剂
精制棉籽油:ACROS公司;0.9%氯化钠注射液:四川科伦药业股份有限公司;弗氏完全佐剂:SIGMA公司;二硝基氯苯溶液:阿拉丁生化科技股份有限公司。
1.4主要仪器
电子天平(岛津 UX4200H)、鼓风恒温烘箱(BINDER FD115)、细胞离心机(贝克曼库尔特 Allegra X-12R)、紫外可见分光光度计(岛津 UV-2600)、恒温水浴锅(Memmert WNB29)
2.试验方法
2.1皮肤致敏试验
备皮:取上述豚鼠50只,在试验前4h将动物背部4cm×6cm被毛除去,随机分成5组,极性浸提液组10只,极性对照组10只;非极性浸提液组10只,非极性对照组10只;阳性对照组10只。
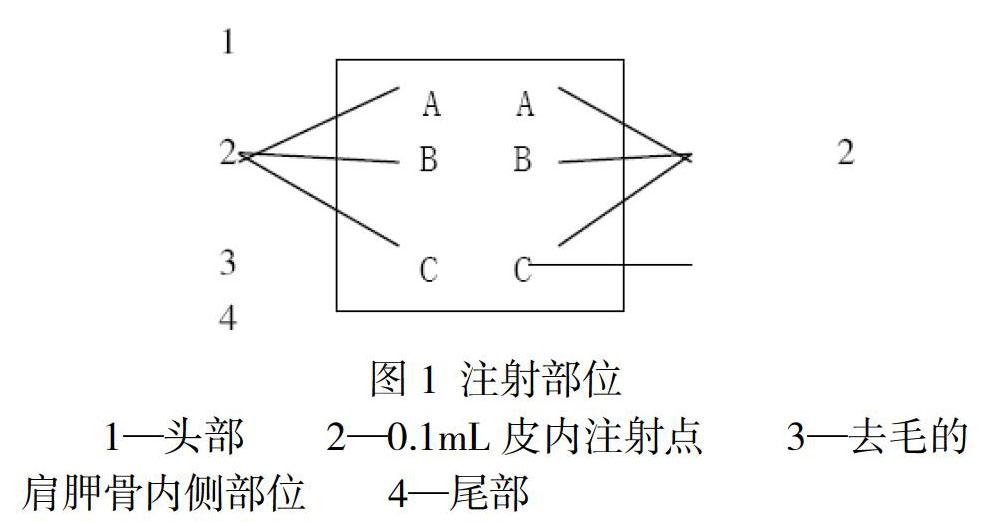
皮内诱导:按图1 所示,在每只动物去毛的肩胛骨内侧部位成对皮内注射0.1mL。
1—头部 2—0.1mL皮内注射点 3—去毛的肩胛骨内侧部位 4—尾部
部位A:注射弗氏完全佐剂与浸提介质以50:50(体积比)比例混合的稳定性乳化剂。
部位B:注射试验样品浸提液;阴性及阳性对照组动物分别注射相应对照液。
部位C:注射试验样品浸提液以50:50的体积比例与弗氏完全佐剂和浸提介质(50%)配制成的稳定性乳化剂混合液;阴性及阳性对照组动物分别注射相应对照溶液以50:50的体积比例与佐剂配制成的乳化剂。
局部诱导:皮内诱导阶段后6d,试验区用10%十二烷基硫酸钠按摩导入皮肤。24h后,采用面积约8cm2的吸收性纱布块分别置于试验样品浸提液、阴性对照液及阳性对照液中浸透后,分别局部贴敷于每只动物的肩胛骨内侧部位,覆盖诱导注射点。用封闭式包扎带固定敷贴片,并于48h后除去包扎带和敷贴片。
激发:局部诱导阶段后15d,将约2.5cm×2.5cm大小的吸收性纱布块分别置于试验样品浸提液、阴性对照液及阳性对照液中浸透后,分别局部贴敷于诱导阶段未试验部位(每只动物的上腹部)。用封闭式包扎带固定,并于24h后除去包扎带和敷贴片。
观察:除去敷贴片后24h和48h观察试验组和对照组动物激发部位皮肤,参照GB/T 16886.10 Magnusson和Kligman分级标准(见表1 示)对每一激发部位和每一观察时间皮肤红斑和水肿反应进行分级并记录。
结果评价:阴性对照组动物等级小于1,而样品组中等级大于或等于1时一般提示致敏。如阴性对照组动物等级大于或等于1时,样品组动物反应超过阴性对照组中最严重的反应则认为致敏。
2.2皮内反应试验
备皮:取健康家兔3只,试验前4h在脊柱两侧各剪剃约10cm×15cm区域兔毛,尽量避免机械损伤皮肤,以备注射浸提液。
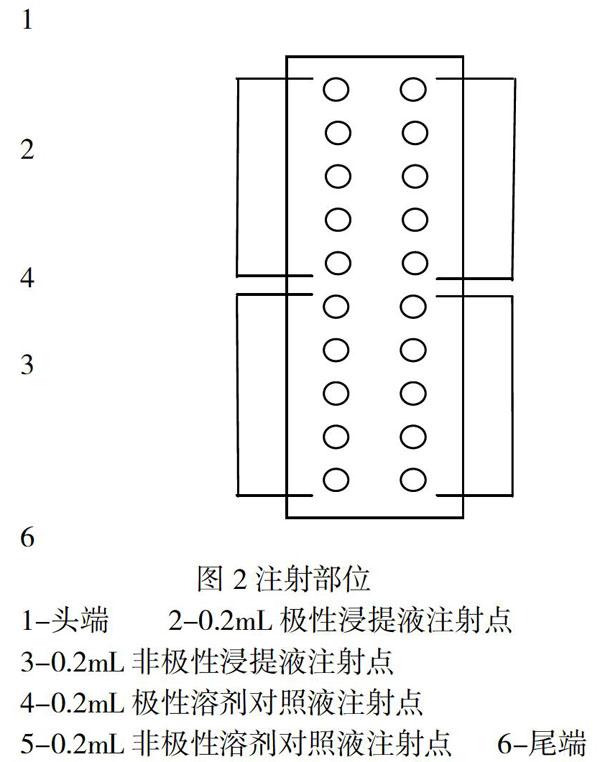
给药:在每只兔脊柱一侧的前5个点皮内注射0.2mL极性溶剂制备的样品浸提液,同一侧的后5个点皮内注射0.2mL非极性溶剂制备的样品浸提液;在每只兔脊柱另一侧的前5个点皮内注射0.2mL极性溶剂对照液,同一侧的后5个点皮内注射0.2mL非极性溶剂对照液(见图2示)。
1-头端 2-0.2mL极性浸提液注射点
3-0.2mL非极性浸提液注射点
4-0.2mL极性溶剂对照液注射点
5-0.2mL非极性溶剂对照液注射点 6-尾端
观察:注射后即刻以及24h、48h和72h观察和记录各注射部位状况,根据GB/T 16886.10-2017/ISO 10993-10:2010《医疗器械生物学评价 第10部分:刺激与皮肤致敏试验》动物皮内反应试验记分系统(见表2)对每一观察期各注射部位的红斑和水肿的组织反应评分,并记录试验结果。在72h评分后,分别将每只动物试验样品或空白对照的24h、48h和72h的全部红斑与水肿记分相加,再除以15[3(记分时间点)×5(试验样品或空白对照注射点)],计算出每只动物试验样品或空白对照的记分。三只动物记分相加后除以3得出每一试验样品和相应空白对照的总平均记分。试验样品记分减去空白对照记分可得出试验样品最终记分。如试验样品最终记分不大于1.0,则符合该试验要求。
2.3溶血试验
兔血制备
由健康家兔心脏采血10mL,加质量浓度20g/L草酸钾溶液0.5mL,制备成新鲜抗凝兔血。取新鲜抗凝兔血8mL,加质量浓度9g/L氯化钠注射液10mL稀释备用。
血液与被测样品的相互作用
在无菌操作下,分别取样品10mL至3支试管中,作为样品组;阴性对照组3支试管,每管加入10mL0.9%氯化钠注射液;阳性对照组3支试管,每管加入蒸馏水10mL。
全部试管放入37℃恒温水浴中保温30min后,每支试管加入0.2mL稀释兔血,轻轻混匀,置37℃水浴中繼续保温60min。
倒出管内液体以800g离心5min,吸取上清液移入比色皿内,用紫外分光光度计在545nm波长处测定吸光度。
根据测得的吸光度计算样品的溶血率。
ATS-ANC
溶血率(%)= ——————×100%
APC-ANC
式中:ATS—样品组吸光度
ANC—阴性对照组吸光度
APC—阳性对照组吸光度
阴性对照管的吸光度应不大于0.03;阳性对照管的吸光度应为0.8±0.3。
3.试验结果
3.1皮肤致敏结果
阴性对照组、样品组动物在观察期内致敏反应等级均为0,阳性对照组动物在观察期内致敏反应等级为2~3。(详见表3)
3.2皮内反应试验结果
样品组和对照组动物在观察期内的反应均为无红斑、无水肿,样品组和对照组的总平均记分之差为0。(详见表4)
3.3溶血试验结果
样品组和对照组的试验数据见表5。样品的溶血率为0.9%。
4.讨论
在本试验条件中,以海藻酸钠、羧甲基纤维素为主要成分的止血微球所制备的浸提液在皮肤致敏反应试验(最大剂量法)中,根据Magnusson和Kligman分级标准,样品浸提液组未见引起皮肤致敏反应,而涂抹2,4-而硝基氯苯的阳性对照组豚鼠均产生2~3级反应;皮内反应试验无红斑、无水肿现象出现;溶血率为0.9%,符合标准要求范围内。综上所述,该成分的止血微球在皮肤致敏、皮内反应试验、溶血试验中均有较好安全性,可进一步用于临床研究。
参考文献
[1]李旭丽 止血微球关键技术指标的讨论 中国医疗器械信息 1006-6586(2017)12-0012-02
[2]Chan L W, Jin Y, Heng P W S. Cross-linking mechanisms of calcium and zinc in production of alginate microspheres [J] . International Journal of Pharmaceutics, 2002, 242(1/2):255-258
[3]李健,刘雅南,刘宁,刘涛 羧甲基纤维素的制备研究及应用现状 食品工业科技
[4]邓乐君,樊鸿浩,李伟达,朱晋辉,李茹冰 可吸收止血材料的生物相容性研究进展 中国生物医学工程学报 0258-8021(2016)02-0241-06
[5]FRANKILD,S. V?LUND, A., WAHLBERG, J.E.et al., Comparison of the sensitivities of the Buehler test and the guinea pig maximization test for predictive testing of contact allergy, Acta Derm. Venereol., 80, pp.256-262,2000
[6]侯丽,乔春霞,赵增琳 解读ISO 10993-4:2017《医疗器械生物学评价第4部分:与血液相互作用试验选择》 1674-1633(2018)11-0001-06

