被子植物心皮及其相关功能基因研究进展
杨 静,王为然,朱家辉,宁新民,刘志清,孔 杰,阿里甫·艾尔西
(新疆农业科学院经济作物研究所,乌鲁木齐 830091)
0 引 言
【研究意义】心皮作为开花植物的重要雌性器官,目前已成为作物生殖发育研究的热点。心皮作为被子植物雌蕊发育的关键,对于产量性状的建成极为重要,研究心皮及其发育过程对于作物高产优质育种意义重大。【前人研究进展】心皮作为植物界进化的产物,是被子植物特有的组织[1-3],它也是包含胚珠和雌性配子体在内的雌性器官[4],心皮不仅能够保护胚珠免受昆虫或微生物的侵害,也有助于花粉识别和花粉管的伸长,为植物雌雄配子体的发育和受精后形成果实提供了重要场所[2,5]。虽然心皮对于被子植物的生殖发育作用重要,但由于其在发育早期较为隐蔽、结构复杂且取样困难,对心皮的起始研究进展较慢。在1991年,Coen等[6]才提出了心皮是由花发育ABC模型中C功能基因调控,后来补充形成的ABCDE模型中进一步确定C+E功能基因控制心皮发育[7-8]。【本研究切入点】近年来,随着研究的不断深入,特别是分子生物学的快速发展。国内外相关成果的检索总结以心皮的起源、作用、发育过程,心皮的遗传及激素调节、控制心皮发育的相关基因的研究进展。【拟解决的关键问题】通过成果梳理,明晰心皮的起源、作用和相关功能基因的种类,为培育出多心皮、高品质种质资源提供技术参考。
1 材料与方法
1.1 材料
查阅收集国内外相关官网(中国知网,web of science)及文献资料。
1.2 方 法
对检索数据资料进行整理汇总并分析。
2 结果与分析
2.1 心皮的起源、作用及发育过程
2.1.1 心皮的起源
1857年我国植物学者李善兰译英国植物学家Lindley所著《植物学原理》一书时,提出心皮一词,并将雌蕊的组成部分称为“心皮”,认为心皮是变态的叶,也是被子植物特有的器官,而雌蕊则是由心皮卷合而成的。心皮的产生被当作植物进化的重要标志,也被作为划分植物类群的依据。
心皮的研究始于被子植物,关于其起源目前有两种学说,即心皮学说和生殖叶学说[4]。Goethe在1790年提出心皮学说,认为心皮可能是变态的大孢子叶,它是子房表面或边缘上着生着胚珠的大孢子叶,通过对折、边缘融合而产生的结构[9],它的演化过程与相关基因的调控、诱导等共同作用形成的[5]。Melville在1963年提出了生殖叶学说,认为雌蕊和雄蕊是源于一个着生于可育枝上名为“生殖叶”的叶状器官联合体,同时在该联合体上分生出两类小叶片,不育的称为“苞叶”,可育的称为小育叶,而后苞叶可以演化成花瓣和花萼,小育叶则形成被子植物的子房壁[10]。在被子植物中,若生育枝上着生两种性别的器官,被称为“两性生殖叶”(图2A),而其雌蕊由具雌性可育枝的叶状器官联合体演化而来(图2B-D),雄蕊则是由一个着生于多个雄性可育分枝的叶状联合体演化而来的(图2E-G)[11]。这不仅解释了心皮的由来,也阐述了心皮与各部分花器官发育演化的相互关系。图1,图2
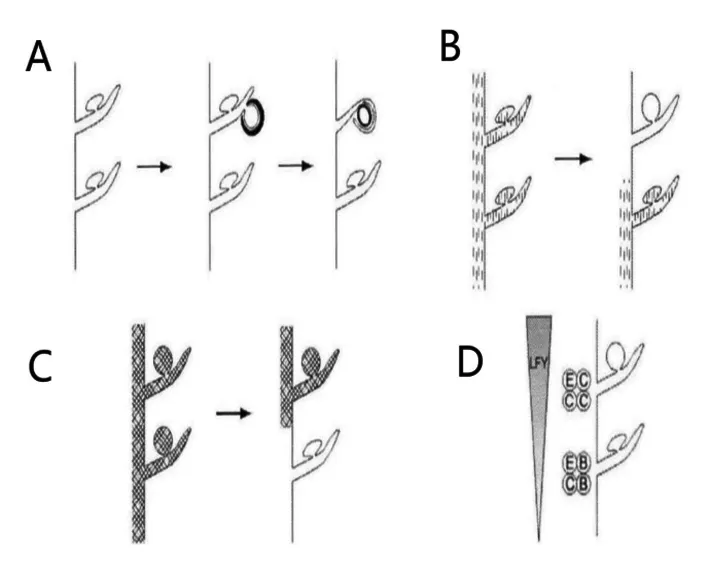
图1 心皮学说示意[5]
Fig. 1 The sketch map of hypotheses for theorigin of the carpel[5]
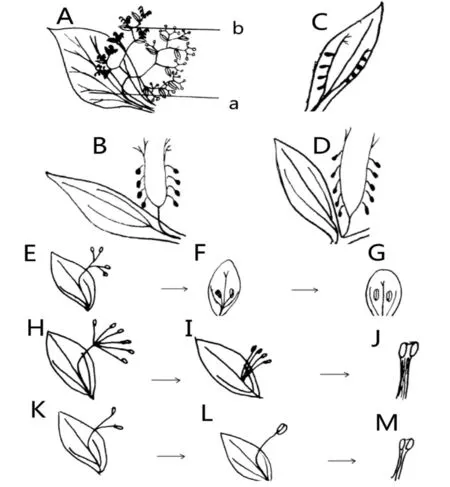
图2 生殖叶学说[11]
Fig. 2 Gonophyll theory[11]
2.1.2 心皮的作用
心皮作为被子植物花发育中最重要的器官,具有保护胚珠、接受花粉和引导花粉管生长致使卵细胞受精的作用[2]。在花粉粒萌发和生长的阶段,心皮则为其自交不亲和或内部特异不亲和机制提供一个位点,用以阻止近亲繁殖,促进后代广泛杂交,这也将有助于保护植物进化演变的能力。心皮的柱头获得花粉粒,可引导花粉管通向心皮组织[1]。
心皮作为新一代孢子体发生和发育的场所,同时也具有保护和传播种子的作用[2]。在心皮发育过程中,构成子房的心皮,其内壁产生一些隔膜将子房分隔为若干部分,形成不同的心室。当心皮展开,彼此以边缘相接合,全部形成子房壁;心皮向内弯入,在子房的中心彼此互相结合,心皮则部分形成子房壁,部分形成子房内隔膜而将子房分隔为数室。心皮融合在植物发育过程中有很多好处,其中最重要的是提供一个花柱通腔,可以为整个花柱组织和子房提供内部交换的地方;另一个重要的好处是能够增强花粉管的竞争力,可选择更强健的父本。除此之外,合生心皮不仅可以保护较大果实,在细胞壁保护方面减少能量的消耗,也可进行更复杂和有效的种子传播机制[12]。
2.1.3 心皮的发育过程
心皮作为雌蕊中一个特殊的结构,它通常在花的器官中通过折叠、卷曲形成内在的空间,胚珠被包裹在其中发育。被子植物里双子叶植物心皮的数目在2~5,而且多数都排列在一个轮生体中[13]。相对于花芽来说,心皮形成是整个花器官形成过程中的一个特殊阶段,雌蕊的子房、花柱、柱头均由其卷合而形成。因此,仅仅从花芽分化来考虑心皮的形成机制,一是在形成阶段上过于笼统,不能精确到具体的时期与位置;二是对于心皮分化特别是CMM (carpel marginal meristem)的形成机制无法深入解析。因此,心皮作为发生在花发育组织第四轮器官上的雌蕊群,不仅要了解其参与花发育事件的具体过程,也要了解其发育类型对雌蕊类型的影响。由于心皮数目及分合情况的不同会引起雌蕊类型的差异,仅由一心皮所构成的雌蕊为单雌蕊,如豌豆、大豆、蚕豆等;由二个以上的心皮彼此分离,形成的雌蕊是分离的为离生雌蕊,如莲、草莓、玉兰等;在植物界中多数被子植物为这种合生的雌蕊,如番茄、茄、南瓜等。除此之外,心皮有时由子房直连至柱头,完全合生成一个雌蕊;有时仅子房合生而花柱及柱头仍为离生;有时子房及花柱合生而柱头分离仍为离生;有时花柱合生而子房却离生。世界上80%以上的植物类型都是合生心皮,而融合过程发生在心皮发育早期,它们均在花中央结合成一个单一的雌性组织,来参与花发育的后期进程[14]。心皮发生和融合阶段也是决定心皮数目的重要时期[3]。因此,根据心皮融合的类型,也可初步确定植物生殖器官的演化历程。在不同类型的植物中,组成雌蕊群的心皮数不同,而胚珠又是通过胎座沿心皮腹缝线排列而着生于心皮上的,所以不同的心皮类型也会影响胎座类型发生变化。
2.2 心皮的遗传及激素调节
2.2.1 心皮数目的遗传
在植物的发育过程中,除了心皮的融合方式会影响后期花形态发育外,心皮数量差异也会导致果实发育的变化。心皮的数目可以通过花柱的数量或者腹缝线数目来识别,花柱头或腹缝线的数量等于心皮的数量。在植物雌蕊器官发育过程中,大多数植物其心皮数目受遗传的控制为主,因此,数量较为稳定。
关于心皮数目的遗传,在油菜中研究较多,但结果不尽相同。一种研究认为,白菜型、芥菜型油菜多室性状受 1 对隐性基因控制[15-16],且多室性状无胞质效应[15];而另一种研究则认为,芥菜型油菜多室性状受 2 对隐性基因控制[17],这可能与材料的特殊性有一定关系。在番茄心皮研究方面,多心室和少心室亲本杂交一代的心室数与双亲平均值比较接近[18]。
在油菜中利用普通油菜2心皮与多心皮油菜进行杂交,可获得稳定遗传的3心皮油菜,3心皮油菜其单株产量显著髙于2心皮油菜[19]。在番茄[20]、葡萄[21]、黄瓜[22]中,利用人工杂交、基因工程等多种方式,获得了经济性状好的多心皮品种,从而达到了增大果实、提高产量的目的。
2.2.2 激素对心皮的影响
在植物的生长过程中,激素的调控也会影响心皮的发育及其果实的形成。例如,高浓度的生长素存在于荠菜柱头,能够维持心皮中生长素在顶端发生极性分布,而不同极性的生长素分布则会共同促进了荠菜心皮的形态建成[23]。当荠菜中生长素的侧向运输,能够在一定程度上促进细胞区位分裂增加,导致心皮发生弯曲[24];若生长素在心皮中的纵向极性运输能力降低,则直接影响心皮长度发生变化[25]。生长素不仅参与心皮发育过程,而且在其存在的不同位置会出现浓度梯度分布,其中荠菜与拟南芥心皮发育中生长素的极性分布差异就导致了二者心皮形态的不同[26]。与此同时,研究者发现,乙烯可促进黄瓜心皮的发育,而ACC氧化酶(ACO)能将ACC转化成乙烯;因此,ACC氧化酶基因通过调控乙烯的含量参与心皮发育[27];并且,ACS11介导产生的乙烯对于雌雄同株黄瓜心皮发育都是必需的[28]。同样,在拟南芥的花发育到第5个时期时,心皮原基中就可以检测到细胞分裂素的响应信号[29];在花发育到第6~7时期,心皮原基细胞中ARR类和AHK类等细胞分裂素响应基因高水平表达[30]。其中拟南芥中的ckx3和ckx5通过调节细胞分裂素的浓度来调控花序分生组织的活性,而在双突变体中细胞分裂素的浓度升高,心皮数量则会增加[31]。因此,植物中较高浓度细胞分裂素有利于正常发育的心皮;同时细胞分裂素对心皮的发育起正向调控作用,且高浓度的细胞分裂素可诱导心皮的生长和数量的增加。
表1 不同类型植物中影响心皮发育数量的相关基因
Table 1 Genes related to carpel development of number in different types of plants

基因来源Gene from plant基因名称Gene name基因功能Gene function作者Author发表时间Publication time拟南芥Arabidopsis thalianaAG作用于CTK,增加心皮数量Li等[29]2010ckx3和ckx5心皮数量增加Bartrina等[31]2011AtMIF2/SlIM决定心皮数量,大小Bollier等[34]2018AP1心皮数量减少,缺失Roth等[35]2018STM心皮数量减少或缺失Roth等[35]2018玉米Zea mays LZag1在雌蕊中下调,心皮数量会减少Bartlett等[36]2015番茄Lycopersicon esculentum Millerfasciated增加果实心室数Cong等[32]2008locule-number增加心皮数量Muños等[33]2011ATMIF2/SlIMA增加心皮数量Bollier等[34]2018
2.3 控制心皮发育的相关基因
2.3.1 调控心皮数量的基因
控制心皮数目的基因最早在番茄中发现,2008年Cong等首次利用QTL方法从番茄中克隆得到数量性状fasciated(FAS)基因,并且主要在番茄花形成期的雄蕊和心皮中表达,该基因在多心室花芽发育期的第1个内含子中插入了1段6~8 kb的片段致使FAS基因的表达量下降,使得果实中子房心室数量增多[32]。Munos等利用图位克隆得到了另外一个调控番茄心室数量的locule-number(lc)基因,该基因位于WUSCHEL(WUS)基因3’末端下游1 080 bp处,长度为1 608 bp。对于lc基因的分析发现,其中的2个SNP的变化能够影响心室数的增加,这可能是由于多态性的数量性状核苷酸而引起的[33]。而在含有Pro35S:SlKNU-RNAi基因的植株中,ATMIF2和SlIMA能够使番茄的心皮数增至8个[34]。
拟南芥中的ckx3和ckx5是使得心皮数增加的两个基因[31],而AG基因则作用于细胞分裂素的改变来增加心皮[29],与此同时,研究发现部分基因会导致拟南芥中的花瓣和雄蕊数目显著减少,心皮的数量随之出现减少和缺失[35],而AtMIF2/SlIM则能够影响拟南芥心皮的数量和大小[34]。在玉米中,同样发现了心皮数量减少的基因Zag1,该基因在雌蕊中主要通过下调表达起到减少心皮数量的作用[36]。表1

图3 模式植物复合花器官结构鉴定[40]
Fig. 3 Specification of floral organs by complexesof floral organ identity factors[40]
2.3.2 影响发育的基因
1990年,Yanofsky等从拟南芥中克隆出具有C类基因功能且唯一的同源异型基因AG,该基因能调控雄蕊和心皮原基的发育[37],这也是较早对心皮研究的结果。1991年,提出了花发育的ABC模型[6],研究认为,心皮发育受遗传物质的调控,主要是通过C类功能基因MADSbox中的AGAMOUS(AG)和至少三个E类功能基因参与心皮发育的调控[38-39];之后经补充形成的ABCDE模型,才进一步认为C+E功能基因控制心皮发育[7-8],并且对ABCDE 模型中不同功能基因对花器官的发育进行了详细的划分。图3,图4,表2

图 4 花器官决定的ABCDE 模型[41]
Fig. 4 The ABCDE model of flower organ identity[41]
表2 拟南芥中ABCDE同源基因的分类[41]
Table 2 Classification of ABCDE homologous genes inArabidopsisthaliana

基因类型Gene classes基因成员Gene memberClass AAP1、AP2Class BAP3、PIClass CAG、SPT、CRCClass DSTK(AGL11)、SHP1、SHP2Class ESEP1(AGL2、E1)、SEP2(AGL4、E2)、SEP3(AGL9、E3)、SEP4(AGL3、E4)
3 讨 论
近年来,关于植物心皮的研究发展较快。相关研究证实,大概有80 余种基因与心皮发育有关[42]。其中,最为相关的可以归结为两类,一类主要是植物激素及其相关调控基因直接或间接影响了心皮的发育进程,另一类是直接相关基因的调控导致了心皮的数目变异。
以拟南芥为例,ARR类和AHK类基因、AGAMOUS基因、WUS-AG基因、DRNL基因高水平表达能够促进心皮的发育[27,30,43, 44],而KNOX-I、SEP1/2/3/4基因(表2)、AgM、ATMIF2基因则会调节或抑制心皮的发育[27, 34,41,45]。与此同时,除发现的可直接调控心皮发育的基因外,也有通过间接作用改变激素浓度,从而起到调控心皮发育的作用的相关基因,可以使心皮形态发生变化[24-25]。
在黄瓜中,CsGID1a基因被敲除后将导致果实心皮和心室异常[28],而ACC氧化酶(ACO)能将ACC转化成乙烯参与心皮发育[27],ACS11介导产生的乙烯对于雌雄同株黄瓜其心皮发育同样非常重要[28],CUM1则通过特异基因的驱动表达来促进心皮的发育[22]。
在棉花中,GhMADS3基因在雄蕊和心皮中的表达水平高,而Gh-MADS13参与了心皮的形成[46-47];在荠菜中,发现SPATULA能够调控心皮发育,CRC作为心皮发育的诱导因子,能够改变心皮性状和大小[48];在矮牵牛中,同属于C类基因的pMADS3和FBP6 对心皮发育起到调节作用[49]。此外,在玉米[36],小麦[50],葫芦[28]中也分别找到了调节心皮发育的部分相关基因。表3
4 结 论
心皮作为被子植物雌蕊发育的关键,对于产量性状的建成极为重要。但由于其本身在早期发育的隐蔽性和特殊的复杂结构,目前其研究所涉及的植物种类较少,且多限于几种模式植物。花芽分化初始期是心皮数量形成的关键时期,但该时期的研究极少,在后期的发育阶段中,完整的调控机制尚还不明晰,这对多心皮、高产材料的创制是不利的。未来心皮研究应重点围绕心皮发育的全过程,从其表观形态、激素调控、基因表达等方面,尽早明晰调控心皮数量和发育的相关功能基因,并进行克隆验证和遗传转化,进而培育出多心皮、高质量种质资源。
表3 不同类型植物中影响心皮发育的相关基因
Table3 Genes related to carpel development in different types of plants
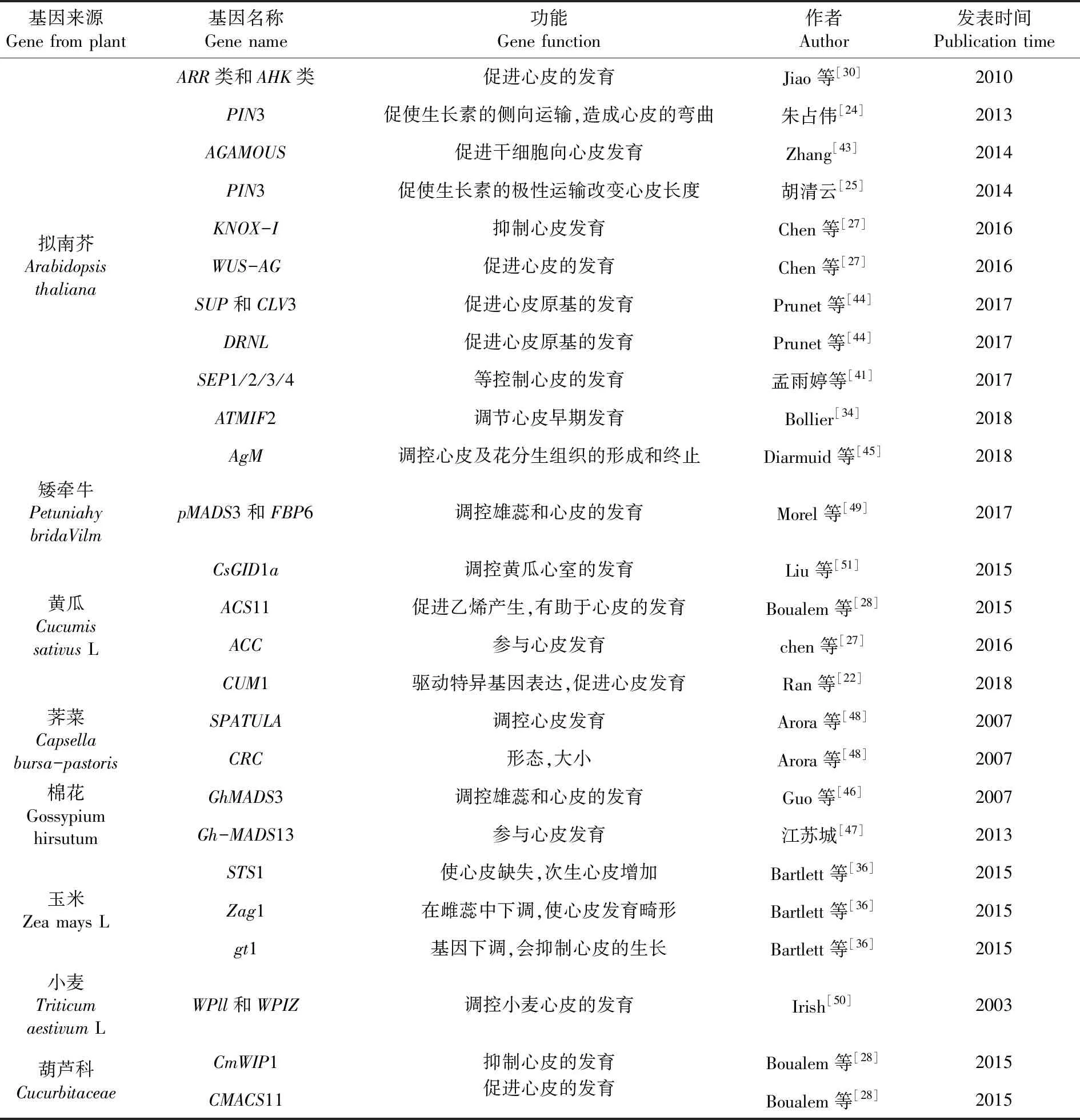
基因来源Gene from plant基因名称Gene name功能Gene function作者Author发表时间Publication time拟南芥Arabidopsis thalianaARR类和AHK类促进心皮的发育Jiao等[30]2010PIN3促使生长素的侧向运输,造成心皮的弯曲朱占伟[24]2013AGAMOUS促进干细胞向心皮发育Zhang[43]2014PIN3促使生长素的极性运输改变心皮长度胡清云[25]2014KNOX-I抑制心皮发育Chen等[27]2016WUS-AG促进心皮的发育Chen等[27]2016SUP和CLV3促进心皮原基的发育Prunet等[44]2017DRNL促进心皮原基的发育Prunet等[44]2017SEP1/2/3/4等控制心皮的发育孟雨婷等[41]2017ATMIF2调节心皮早期发育Bollier[34]2018AgM调控心皮及花分生组织的形成和终止Diarmuid等[45]2018矮牵牛Petuniahy bridaVilmpMADS3和FBP6调控雄蕊和心皮的发育Morel等[49]2017黄瓜Cucumis sativus LCsGID1a调控黄瓜心室的发育Liu等[51]2015ACS11促进乙烯产生,有助于心皮的发育Boualem等[28]2015ACC参与心皮发育chen等[27]2016CUM1驱动特异基因表达,促进心皮发育Ran等[22]2018荠菜Capsella bursa-pastorisSPATULA调控心皮发育Arora等[48]2007CRC形态,大小Arora等[48]2007棉花Gossypium hirsutumGhMADS3调控雄蕊和心皮的发育Guo等[46]2007Gh-MADS13参与心皮发育江苏城[47]2013玉米Zea mays LSTS1使心皮缺失,次生心皮增加Bartlett等[36]2015Zag1 在雌蕊中下调,使心皮发育畸形Bartlett等[36]2015gt1基因下调,会抑制心皮的生长Bartlett等[36]2015小麦Triticum aestivum LWPll和WPIZ调控小麦心皮的发育Irish[50]2003葫芦科CucurbitaceaeCmWIP1抑制心皮的发育Boualem等[28]2015CMACS11促进心皮的发育Boualem等[28] 2015

