宫颈癌患者血清胰岛素样生长因子1、基质金属蛋白酶9的水平及临床意义
张瑞敏,芦晓,晏妮
华中科技大学同济医学院附属协和医院检验科,武汉430022
宫颈癌是目前常见的女性恶性肿瘤之一,发病高峰年龄为35~55岁[1]。2012年国际癌症研究署发布的数据显示,全世界宫颈癌新发病例53万,死亡病例27.5万,其中85%的发病及死亡出现在发展中国家[2]。中国是世界上最大的发展中国家,且人口众多,宫颈癌给中国的医疗保健事业带来了沉重的负担[3]。因此,宫颈癌的防治工作是中国医疗卫生事业的重大挑战之一。胰岛素样生长因子(insulin-like growth factor 1,IGF1)具有调节细胞生长、增殖、代谢及分化的作用,在肿瘤的发生、发展中发挥着重要作用,但其与宫颈癌的相关性目前尚无相关定论[4]。基质金属蛋白酶9(matrix metal-loproteinase9,MMP9)可降解细胞外基质及基底膜的活性,促进肿瘤细胞转移[5]。本研究对宫颈癌患者血清IGF1及MMP9的水平进行分析,并探讨其临床意义,现报道如下。
1 对象与方法
1.1 研究对象
选取2016年5月至2019年5月华中科技大学附属协和医院收治的宫颈癌患者206例为宫颈癌组。纳入标准:①经病理学活检确诊为宫颈癌;②预计生存期超过6个月。排除标准:①合并其他妇科良恶性疾病,包括子宫内膜癌、卵巢良恶性肿瘤、多囊卵巢综合征、异位妊娠及子宫肌瘤等;②合并呼吸、循环、消化、泌尿及免疫等系统严重功能异常;③合并神经系统疾病,无法进行沟通及配合研究。另外,选取同期于华中科技大学同济医学院附属协和医院体检的健康女性100例作为对照组。宫颈癌组患者的年龄为39~75岁,平均年龄为(52.8±11.4)岁;2018年国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)宫颈癌分期[6]:Ⅰ期72例,Ⅱ期69例,Ⅲ期65例;肿瘤分化程度:高分化89例,中分化65例,低分化52例;有淋巴结转移者112例,无淋巴结转移者94例。对照组受试者年龄为40~75岁,平均年龄为(53.7±10.8)岁,所有受试者均未合并妇科良恶性疾病。本研究经医院伦理委员会审核审批,符合医学伦理学原则,所有受试者均自愿参与本研究并签署知情同意协议。
1.2 资料收集
收集宫颈癌组患者的年龄、临床分期、淋巴结转移情况、宫颈浸润深度及组织分化情况等。
1.3 检测方法
所有宫颈癌患者均于首次就诊时抽取清晨空腹静脉血5 ml,对照组受试者在体检时留取空腹静脉血5 ml。血液样本静置后,3000 r/min离心10 min,分离血清。采用酶联免疫吸附法检测血清IGF1、MMP9水平,实验步骤严格按照试剂盒说明书进行。
1.4 统计学分析
采用SPSS 18.0软件对数据进行分析,符合正态分布的计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组比较采用单因素方差分析;计数资料以例数表示;相关性分析采用Spearman相关性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 血清IGF1、MMP9水平的比较
宫颈癌组患者的血清IGF1、MMP9水平均明显高于对照组,差异均有统计学意义(P<0.01)。(表1)
表1 两组受试者血清IGF1、MMP9水平的比较(ng/ml,±s)
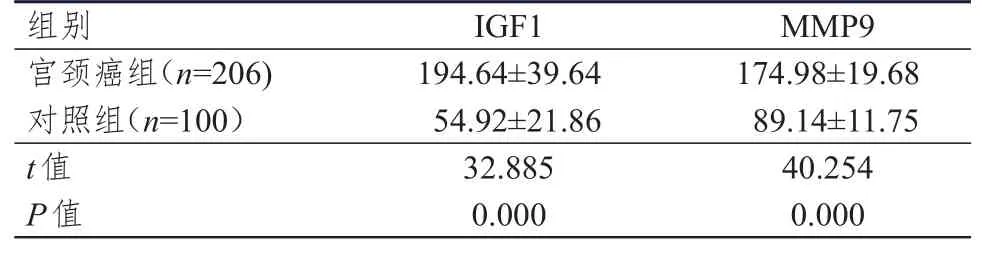
表1 两组受试者血清IGF1、MMP9水平的比较(ng/ml,±s)
组别IGF1 MMP9宫颈癌组(n=206)对照组(n=100)t值P值194.64±39.64 54.92±21.86 32.885 0.000 174.98±19.68 89.14±11.75 40.254 0.000
2.2 血清IGF1、MMP9水平与宫颈癌患者临床特征的关系
不同临床分期、分化程度、浸润深度、淋巴结转移情况宫颈癌患者的血清IGF1水平比较,差异均有统计学意义(t=206.326、324.241、24.651、25.929,P<0.01)。不同年龄、临床分期、分化程度、浸润深度、淋巴结转移情况宫颈癌患者的血清MMP9水平比较,差异均有统计学意义(t=3.580、20.424、23.111、22.540、29.966,P<0.01)。(表2)
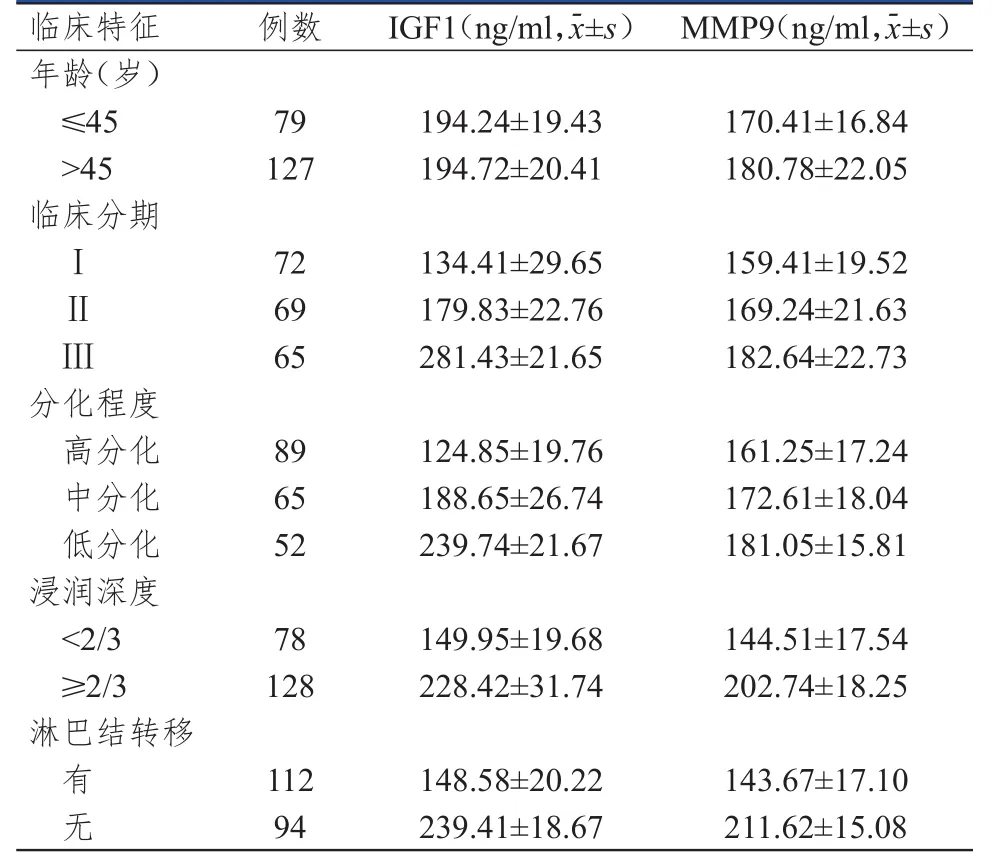
表2 不同临床特征宫颈癌患者的血清IGF 1、MMP 9水平(n=206)
2.3 血清I F1、MMP 9水平与宫颈癌患者临床特征的相关性分析
宫颈癌患者的血清IGF1水平与临床分期、分化程度、浸润深度、淋巴结转移情况及MMP9水平均呈正相关(P<0.05);宫颈癌患者的血清MMP9水平与浸润深度、淋巴结转移情况、IGF1水平均呈正相关(P<0.05)。(表3)

表3 血清IGF1、MMP9表达与宫颈癌患者临床特征的相关性分析
3 讨论
宫颈癌为临床常见的一种妇科恶性肿瘤,严重影响女性的生活质量及身心健康。临床阴道镜及宫颈刮片等为临床常用的宫颈癌诊断方法,但仅能反映局部病变,而近些年来,肿瘤标志物检测在宫颈癌病变评估中取得了一定的进展[7],本研究旨在分析血清IGF1、MMP9水平在宫颈癌中的临床意义。
IGF1属于IGF家族成员之一,主要发挥调控细胞代谢、生长、增殖及分化的作用。IGF1属于多肽类激素,由70个氨基酸残基组成,机体大多数细胞均可分泌及合成IGF1,外周血中的IGF1主要来源于肝细胞[8]。IGF1主要通过结合细胞表面相应的受体并激活下游信号通路发挥作用,促进细胞生长、抑制细胞凋亡并促进肿瘤的发生。相关研究表明,IGF1受体(insulin-like growth factors 1 receptor,IGF1R)在多种肿瘤中的表达水平明显升高,并与肿瘤的恶性程度及淋巴结转移有关[9]。IGF1R结合相关配体后激活下游的丝裂原激活蛋白激酶(mitogen-activation protein kinase,MAPK)途径、磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又称AKT)途径等信号通路,上调外周纤溶酶的表达,从而促进细胞外基质的降解,促进恶性肿瘤的侵袭和转移[10]。
IGF1与宫颈癌的关系较为复杂,研究表明,IGF1可以通过影响子宫颈正常上皮细胞的增殖,增加人乳头瘤病毒(human papilloma virus,HPV)相关宫颈癌的发生风险[11]。还有研究显示,IGF1表达水平与年轻女性(小于30岁)的宫颈上皮内瘤变分期呈负相关[12];IGF1与宫颈癌细胞表面的IGF1R结合后,可以通过激活下游信号通路,下调抑癌基因p53的表达,进而增加HPV相关肿瘤的发生风险[13]。既往关于IGF与肿瘤转移的相关研究发现,IGF2具有促进宫颈癌淋巴结转移的作用[14],已有研究证明,IGF2及其受体可能通过促进淋巴管新生引起肿瘤转移,但关于IGF1与肿瘤转移相关性的研究较少[15]。本研结果显示,宫颈癌组患者的血清IGF1水平明显高于对照组(P<0.01),不同临床分期、分化程度、浸润深度、淋巴结转移情况宫颈癌患者的血清IGF1水平比较,差异均有统计学意义(P<0.01),且宫颈癌患者的血清IGF1水平与临床分期、分化程度、浸润深度、淋巴结转移情况及MMP9水平均呈正相关(P<0.05)。还有研究表明,IGF1可能与宫颈癌患者的预后有关[16]。
侵袭和转移是恶性肿瘤的重要生理特征,也是影响肿瘤患者预后的重要因素,细胞外基质的降解是恶性肿瘤细胞侵袭、转移的重要步骤。MMP9属于MMP家族中的重要成员,由结缔组织及肿瘤组织分泌,能够参与包括血管基底层在内的所有细胞外基质成分的降解,促进肿瘤转移。研究表明,恶性肿瘤患者的MMP9水平明显升高,且与肿瘤的浸润深度及淋巴结转移有关[17-18]。已有研究表明,宫颈癌细胞可以合成和分泌MMP9,合成的MMP9进入循环系统后,可以在全身发挥降解基底膜及细胞外基质的作用,为宫颈癌细胞的浸润、转移创造条件。同时,MMP9是肿瘤新生血管生成的关键因素,在肿瘤的生长、转移中发挥重要的作用[19]。本研结果显示,宫颈癌组患者的血清MMP9水平明显高于对照组(P<0.01);不同年龄、临床分期、分化程度、浸润深度、淋巴结转移情况宫颈癌患者的血清MMP9水平比较,差异均有统计学意义(P<0.01),且宫颈癌患者的血清MMP9水平与浸润深度、淋巴结转移情况均呈正相关(P<0.05)。已有研究证实,IGF1/IGF1R通路对于下游信号通路及效应蛋白具有调节作用,肝癌细胞中IGF1通过活化PI3K/AKT信号通路上调MMP2、MMP9的表达,进而促进肿瘤细胞的侵袭及转移[20]。本研究结果显示,宫颈癌患者的血清IGF1与MMP9水平呈正相关,与上述研究结果相似。
综上所述,宫颈癌患者血清IGF1、MMP9水平均明显升高,且其与患者的临床分期、分化程度、浸润深度、淋巴结转移情况有关。

