宫颈鳞状细胞癌SiHa细胞中HIF-1α、survivin的表达及其与放射敏感性的关系
古力米热·布然江,阿衣西布卫·库尔班,李小文
新疆医科大学附属肿瘤医院妇科肿瘤放疗科,乌鲁木齐830011
宫颈癌是女性常见的恶性肿瘤,且病理类型多为鳞状细胞癌,发病早期缺乏典型性临床症状,导致多数患者确诊时已是中晚期,丧失了最佳诊疗时机[1]。临床研究表明,乏氧细胞的存在不仅是肿瘤放疗敏感性下降的重要原因之一,同时与肿瘤细胞的发生、侵袭、转移密切相关,细胞凋亡被抑制时,异常细胞分裂增殖,导致肿瘤的发生,故乏氧细胞的存在和凋亡过程受抑制是导致肿瘤难治愈、易复发、易转移的重要因素之一[2]。在乏氧条件下,低氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)可以与细胞核内出现乏氧反应的元件结合,增强HIF-1α表达水平,可促进肿瘤血管生成、增强肿瘤细胞侵袭能力、增强肿瘤对放化疗抵抗[3]。存活蛋白(survivin)是凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)家族的成员。survivin在分化成熟的组织中不表达或低表达,在胚胎组织中表达,而在大多数肿瘤中高表达,与肿瘤的发生、发展、预后密切相关[4]。survivin可以抑制细胞凋亡,同时调节细胞增殖,并与肿瘤细胞放疗或化疗敏感性有关,有望成为宫颈癌新的治疗靶点[5]。本研究以宫颈鳞状细胞癌SiHa细胞[6]作为研究对象,探讨在乏氧条件下,HIF-1α和survivin在宫颈鳞状细胞癌SiHa细胞中的表达,及两种基因沉默后与宫颈鳞状细胞癌SiHa细胞的放射敏感性的关系。
1 材料与方法
1.1 材料与试剂
人宫颈鳞状细胞癌SiHa细胞株购自中国科学院上海细胞所,稳定转染HIF-1α小干扰RNA(small inteferirng RNA,siRNA)的干扰细胞由实验室构建保存。羊抗兔二抗购自精美(北京)科技有限公司,辣根过氧化物酶(horse radish peroxidase,HRP)标记的羊抗鼠二抗购自Rockland公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒、聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜均购自上海罗氏制药公司;化学发光试剂盒购自Pierce公司。转染试剂选择ON-TARGETplusHIF-1αsiRNA、ON-TARGETplussurvivinsiRNA,阴性对照选择ON-TARGETplus Non-targeting Pool,转染指示剂选择DharmaFECT 1 Transfection Reagent,均购自上海帛龙生物科技有限公司。蛋白提取选用凯基蛋白提取试剂盒,购自美国SONICS公司。反转录试剂盒购自天根生化科技(北京)有限公司。苏木精-伊红(hematoxylin and eosin,HE)染色试剂盒购自上海碧云天生物技术有限公司。
1.2 宫颈鳞状细胞癌SiHa细胞的培养及乏氧状态建立
宫颈鳞状细胞癌SiHa细胞培养于含10%胎牛血清的RPMI 1640培养基中,放在孵育箱中以5%CO2、37℃培养,每1~2天换一次培养基。在细胞布满70%~80%瓶底时以0.25%胰蛋白酶消化传代。细胞状态稳定后使用二氯化钴模拟细胞缺氧环境,二氯化钴浓度选取200 μmol/L,细胞密度1×106/L,乏氧培育24 h后使用CCK-8法检测吸光度值,在96孔板边缘一圈培养箱中加入磷酸盐缓冲液(phosphate buffered saline,PBS)100 μl作为阴性对照,评估细胞活性。
1.3 蛋白表达情况检测
采用蛋白质印迹法(Western blot)对在二氯化钴模拟乏氧环境下培养的细胞株(阳性对照组)和未进行乏氧培养的细胞株(空白对照组)进行HIF-1α和survivin检测,蛋白提取选用凯基蛋白提取试剂盒,蛋白测定选用凯基蛋白测定试剂盒,HIF-1α抗体浓度为1∶1000,survivin抗体浓度为1∶5000,内参选用anti-β-actin ab8227,抗体浓度为1∶1000。按照常规Western blot电泳后记录电泳图像。
1.4 基因沉默细胞株的建立及鉴定
1.4.1 siRNA转染细胞株本研究采用靶向HIF-1α和survivin的siRNA真核表达载体,转染宫颈鳞状细胞癌SiHa细胞株,下调基因表达。转染siRNA 48 h后,在荧光显微镜下观察转染效率,并收集细胞,细胞数量为3×106个。镜下观察可确定siRNA转染是否有效。空白对照组:未进行乏氧培养的SiHa细胞;阴性对照组:乏氧培养后未进行转染的SiHa细胞;HIF-1αsiRNA组:乏氧培养后进行HIF-1αsiRNA转染的SiHa细胞;survivinsiRNA组:乏氧培养后进行survivinsiRNA转染的SiHa细胞。
1.4.2 反转录聚合酶链反应检测基因表达情况将siRNA转染后的SiHa细胞,在转染48 h后,采用RNA提取试剂盒提取总RNA,采用反转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)法检测HIF-1α、survivin基因表达情况。为防止RNA降解,反转录后的cDNA在-20℃保存。采用反转录试剂盒进行反转录,反转录体系:5×PrimeScript RT Master Mix 2 μl,总RNA最大量 500 ng,RNase free DH2O 10 μl;反转录条件:37℃15 min,85℃5 s,4℃保持。根据GeneBank查询基因序列号,设计基因引物序列。HIF-1α反义:5'-TGCAACATGGAAGGTATTGC-3',HIF-1α正义 :5'-GGTTCACAAATCAGCACCAA-3';survivin反义:5'-CCCTGCCTGGCAGCCCTTTC-3',survivin正义:5'-CTGGCTCCCAGCCTTCCA-3'。
RT-PCR反应体系:SYBR Premix Ex TaqⅡ(Tli RNaseH Plus)12.5 μl,PCR Forward Primer 10 μmol/L 1.0 μl,PCR Reverse Primer 10 μmol/L 1.0 μl,RT 反应液(cDNA)2 μl,DH2O 8.5 μl,总量 25 μl。RTPCR 条件:95℃ 5 min,95℃ 30 s,58℃30 s,72℃1 min,连续进行70个循环;72℃10 min。
1.5 细胞放射后状态变化及放射敏感性检测
采用经上述方法培养后的基因沉默细胞株进行照射。照射方法:直线加速器VARIAN,机架角度180°,6-MV射线,剂量率200 cGy/min,照射野10cm×10cm,垂直源皮距100cm,室温下照射。照射时选择厚度为2cm的有机玻璃板在细胞培养板下,在每组相同剂量点进行同野同时照射,对剂量点进行单次照射。分别对每组细胞进行照射,照射剂量根据实验设定为0、2、4 Gy 3组。
1.5.1 HE染色观察细胞形态按照预先设定的实验分组进行照射,照射后将细胞放回37℃、5%CO2恒温培养箱中静置培养24 h后进行HE染色。
1.5.2 细胞克隆形成实验检测放射敏感性细胞克隆形成率是指接种细胞后贴壁的细胞成活以及形成的克隆数量,可以表示细胞群体的依赖性、增殖能力。本实验采用放射增敏比(sensitivity enhanced ratio,SER)、集落形成率(plating efficiency,PE)、细胞的存活分数(survival fraction,SF)描述放射敏感性相关指标。SF=实验组集落形成数/阴性对照组集落形成数×100%。PE=形成集落数/细胞接种数×100%。SER=空白对照组SF/阴性对照组或基因处理组SF。分别对每组细胞进行检测,并检测0、2、4 Gy剂量照射后的情况。
1.6 统计学分析
采用SPSS 17.0统计软件进行数据分析。计数资料以例数表示,计量资料以均数±标准差(±s)表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 Westernblot法检测乏氧培养前后SiHa细胞中HIF-1 α、survivin表达情况
Western blot法检测乏氧培养后SiHa细胞中HIF-1α和survivin蛋白表达均升高,其中HIF-1α在未乏氧时明显低表达,乏氧后表达明显升高。(图1)
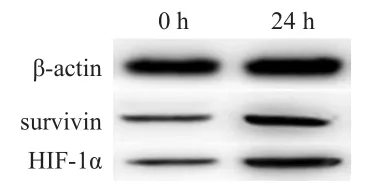
图1 Western blot法检测乏氧培养前和乏氧培养24h后HIF-1 α及survivin的表达情况
2.2 RT-PCR检测转染效果
在乏氧状态下,阴性对照组HIF-1α的相对表达量为(6.68±1.32),高于HIF-1αsiRNA 组的(0.58±0.13),差异有统计学意义(t=5.144,P<0.05);阴性对照组survivin相对表达量为(1.16±0.03),高于survivinsiRNA组的(0.10±0.01),差异有统计学意义(t=2.144,P<0.05)。
2.3 放射后细胞形态变化及放射敏感性比较
2.3.1 细胞形态观察HE染色结果显示,HIF-1αsiRNA组、survivinsiRNA组细胞放疗后形态发生明显改变。2 Gy剂量照射后细胞出现明显水肿样改变,即细胞体积明显增大,部分透明淡染呈气球样改变,少部分细胞出现脂肪样变性,即出现脂滴,HE染色可见空泡状;4 Gy剂量照射后细胞出现明显脂肪样变性,部分细胞出现核浓缩改变,细胞间隙可见点状红染提示发生纤维素样变性。而阴性对照组细胞在2 Gy和4 Gy剂量照射后细胞形态变化均不明显,仅部分细胞出现包浆淡染现象。(图 2)
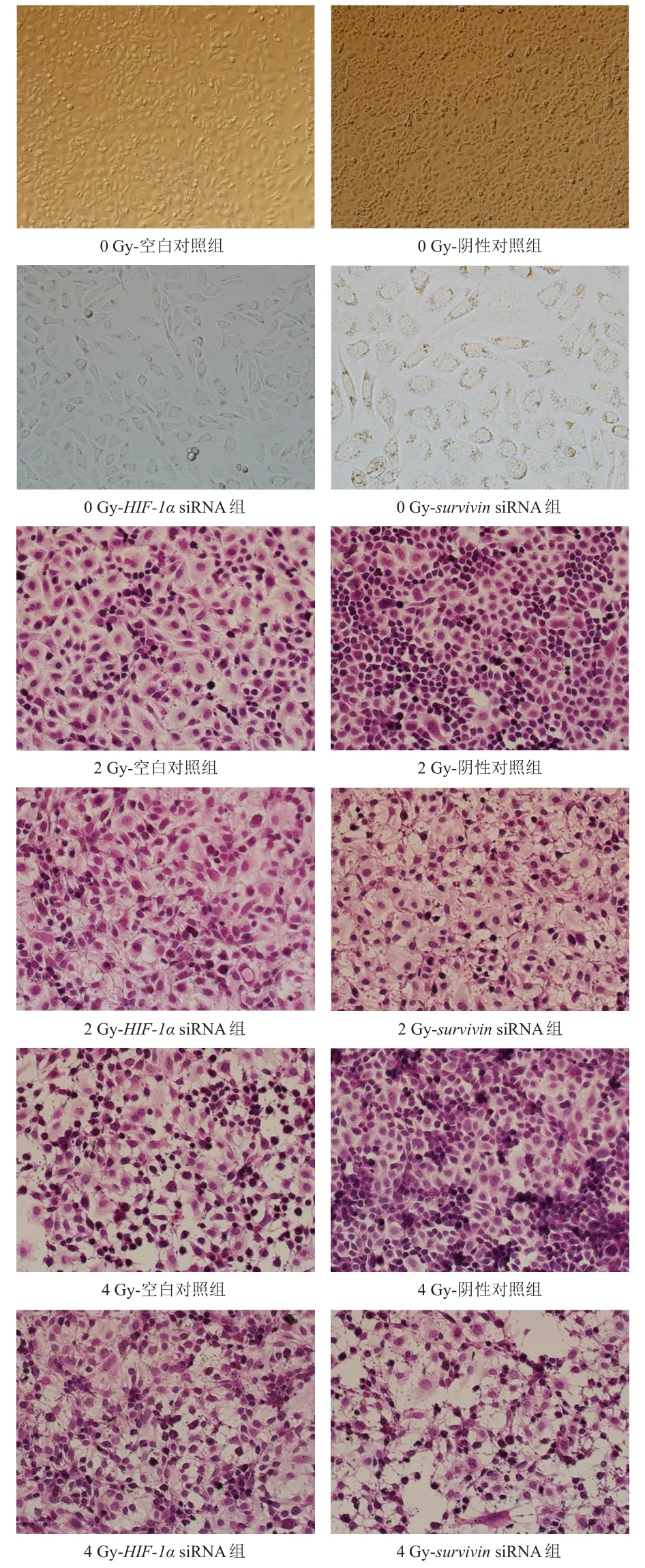
图2 不同剂量照射后各组细胞的形态观察(HE染色,×400)
2.3.2 细胞克隆形成实验检测PE、SF、SER 各组细胞随着照射剂量增加,PF、SF、SER值均下降。在放射剂量为2 Gy和4 Gy时,HIF-1αsiRNA组与survivinsiRNA组的SER均高于空白对照组和阴性对照组。(表1)
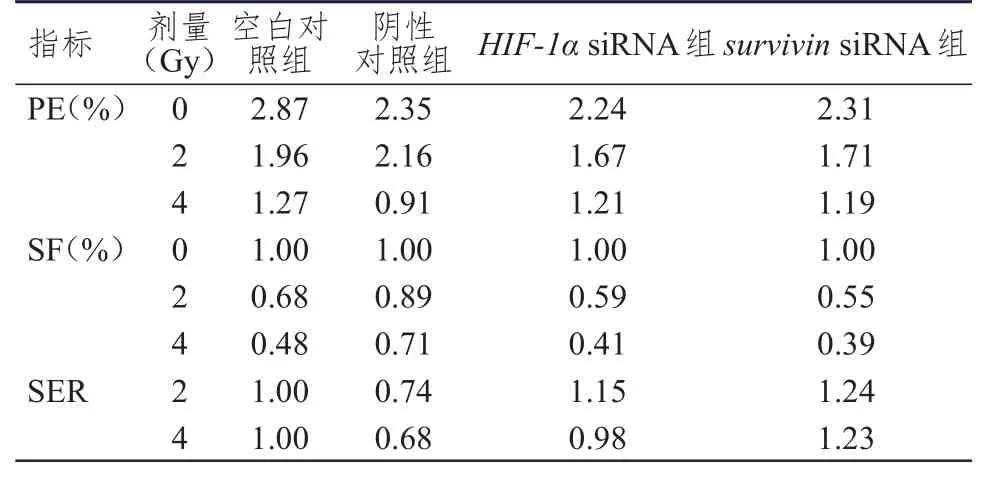
表1 4组细胞在不同剂量照射下的PF、SF、SER值
3 讨论
宫颈癌是妇女最常见的恶性肿瘤,而由于医疗条件限制,大部分患者发现时已是局部晚期,丧失手术机会,而放疗是中晚期宫颈癌最主要的治疗手段。但放疗后肿瘤消退及局部控制率明显不同,主要原因在于肿瘤放射敏感性存在很大的个体差异。随着研究的不断深入及研究方法的不断发展,从最初的大体组织细胞水平到目前的分子基因水平,人们认识到放射敏感性差异与细胞乏氧、细胞周期、增殖活性、DNA损伤修复和细胞凋亡等密切相关。
HIF-1能够激活多种低氧反应性基因的表达,由α、β两个亚基组成,HIF-1α为氧调节性蛋白。而乏氧条件下肿瘤细胞的放疗抵抗和细胞增殖与凋亡、损伤修复、周期分布等有很大的相关性。HIF-1α与肿瘤细胞放射治疗的敏感性也存在一定的联系,在氧含量的敏感性反应研究中是利用HIF-1α亚基完成的,它对细胞的损伤修复、肿瘤侵袭转移、增殖与凋亡、血管形成、细胞周期分布、能量代谢等方面也有影响[7]。survivin为凋亡抑制基因,只在肿瘤和胚胎组织中表达,具有显著的肿瘤特异性,与肿瘤细胞的浸润转移、分化增殖有着很大的关系,在G2/M期高表达,在G1期低表达,与肿瘤凋亡密切相关[8]。
RNA干扰(RNA interference,RNAi)技术是研究基因功能中非常重要的工具[9-11]。其主要原理:在哺乳动物细胞中体外导入siRNA模拟双链RNA的体内切割产物,使双链RNA发生特异性的降解,导致相应的基因沉默。本研究即采用siRNA转染方式,转染后基因沉默明显,可持续性传代。
在本研究中,未乏氧状态下HIF-1α及survivin处于低表达状态,乏氧是促进基因表达的原因之一,乏氧状态下二者表达均升高,这与survivin主要在肿瘤细胞中表达,乏氧可使其表达状态提高的结论相一致[12-13]。而HIF-1α基因表达下调后,survivin的表达亦下调,说明HIF-1α表达与survivin基因有关[14-15]。
作为HIF-1唯一的氧调节亚单位,在乏氧情况下,HIF-1α的表达增强,可以与细胞核内乏氧反应元件相互结合,对其下游基因的表达起到上调作用,包括转化生长因子、血管内皮生长因子等,增加肿瘤的血管生成率,增强肿瘤细胞的侵袭能力,增加放化疗抵抗。通过抑制其表达可以对恶性肿瘤细胞的有丝分裂产生干扰,影响肿瘤细胞的增殖。survivin是凋亡抑制蛋白家族中的成员,是凋亡抑制因子中最强的一种,在肿瘤细胞缺氧诱导调节中起到重要的参与作用。本研究通过HE染色可以直接观察细胞形态。对未进行基因转染的乏氧细胞进行放射干预24 h后,细胞变性程度不明显,提示乏氧环境可以促使细胞抵抗放射,而对HIF-1α、survivin基因干预后,细胞放射损伤反应明显增强。
综上所述,通过本研究可以证实乏氧环境可以提高宫颈癌SiHa细胞中HIF-1α和survivin的表达,通过siRNA转染技术可以下调乏氧SiHa细胞中HIF-1α和survivin的表达。乏氧后细胞SER较低,而抑制HIF-1α和survivin可以提高SER,可以认为HIF-1α和survivin基因是影响SER的关键基因。

