基于失效模式和效应分析的血液透析机风险分析
周兴朝,刘丽茹,杨红飞,段文清,周和良
(大理大学第一附属医院,云南大理 671000)
0 引言
据统计,中国需透析治疗的慢性肾衰竭患者数量达150万以上[1]。由于慢性肾衰竭患者已经纳入大病医保,整体报销比例提升为90%,未来几年透析人数的复合增长率约为20%,血液透析机保有量的年增长率约为20%,故每年的血液透析机需求量在2万余台[2]。随着血液透析机的使用越来越广泛,有关血液透析的安全事故、交叉感染事件和医疗器械不良事件时有发生。如机器接地不良引起电击,其电流可经透析液、患者体外循环血液管路流往患者体内。2013年云南某医院因血液透析交叉感染事件,导致59名患者感染丙肝[3]。
国际标准ISO 14971:2007中把失效模式和效应分析(failure modes and effect analysis,FMEA)[4]作为推荐的医疗器械风险分析方法之一。虽然FMEA已是非常成熟的风险分析方法,但应用于医疗风险管理仅有十多年[5]。2001年美国医疗机构联合评审委员会推荐FMEA作为前瞻性风险评估工具[6];Nichols等[7]利用FMEA降低了葡萄糖与血气即时检验(point-of-care testing,POCT)设备中存在的风险发生率;Mesut等[8]在FMEA中融入模糊逻辑法来分析医院采购流程,提高了采购效率;Zapanta等[9]利用FMEA分析电子人工心脏的耐受性并持续调整软件参数。
我国医院医疗器械管理普遍存在重采购轻质控的情况,风险管理观念滞后,使得医疗器械维护保养不全面,安全运行保障不力,且相关法规制定及监管方面也存在不足。目前,应用FMEA开展血液透析机风险管理主要集中于产品的设计、生产和制造阶段,临床使用阶段的研究还处于空白状态。本研究将应用FMEA方法定量评估血液透析机在使用过程中的潜在风险,提出整改措施,并进行实施效果分析。
1 资料与方法
1.1 资料
收集主流品牌血液透析机的技术资料,包含设备技术参数、水路图以及电路图等;收集我院血液净化中心的血液透析机近10 a的故障维修记录;收集血液透析机的日定修记录;同时,收集患者对血液透析机的满意度调查问卷。
1.2 FMEA评价方法
FMEA评价方法以血液透析机运行过程中的质控要求和问题为基础,预测其可能的失效模式,根据其安全性和可维护性,对严重度(S)、发生概率(O)和探测度(D)进行定量评价,计算出风险顺序数(risk priority number,RPN):RPN=O×D×S,根据 RPN 值的高低确定改进措施,以避免失效模式的再次发生。FMEA的具体分析流程如图1所示[10]。

图1 FMEA的分析流程
为评价FMEA实施后的效果,从患者对血液透析机质量、性能稳定性和故障恢复时间等方面设计问卷调查表,通过调查结果来分析实施FMEA改进措施1 a后的患者满意度。
为方便记录,对我院血透室所有血液透析机运行数据进行追踪观察。定义对照组为FMEA改进措施实施前1 a(即2017年度),血液透析机共31台,选定透析患者90人,透析频次为每人每月至少4次;实验组为FMEA改进措施实施后1 a(即2018年度),血液透析机共31台,选定透析患者90人,透析频次为每人每月至少4次。对照组和实验组患者均为随机选取。
1.3 统计学处理
本研究采用SPSS 19.0软件对血液透析机的透析用水、血液回路、透析液回路3个方面在FMEA改进控制措施实施前后分析得出的数据(失效模式的风险顺序数)进行样本t检验,P<0.05表示差异具有统计学意义;透析患者对血液透析机运行情况的满意度进行Z检验,P<0.05表示差异具有统计学意义。
2 FMEA的实施步骤
2.1 准备阶段
收集血液透析机相关资料,进行整理和统计,确定其功能特性。
2.2 确定潜在失效模式
首先,组建FMEA团队,由医院血透室兼职或专职技师、护士长、高年资护师、主管医师、厂家工程师以及部分透析患者或家属等组成。团队成员来自不同领域以保证FMEA团队能够熟知血液透析机的预期用途、操作使用、工作原理、可能的使用场合、使用环境、设计规格、质量体系和风险管理等多方面的理论与实践经验。
其次,依据YY/T 0316—2008《医疗器械 风险管理对医疗器械的应用》[4]附录C中医疗器械安全性特征的判定清单,FMEA团队可以从医疗器械的设计、开发、生产、使用、维修等多角度列举26个问题来判定血液透析机的可能失效模式。
最后,FMEA团队应当从正常使用和不正确使用2个方面识别血液透析机的失效模式,包括患者、操作者、维修人员、旁观者、财产或环境的危害,以及识别可能导致失效模式的合理可预见事件。
2.3 分析失效模式的潜在原因
根据收集的相关资料,结合血液透析机的使用流程对其故障进行分类,识别常见的失效模式及潜在原因。血液透析机的使用包括透析用水的制备、使用前消毒、自检、上机准备(预冲体外循环管路、透析器,设置透析参数,建立体外循环通路)、透析和下机(回血、拆除体外循环管路)。
2.4 计算RPN值
(1)严重度(S):评价血液透析机每个失效模式对应的后果,详见表1[11]。
(2)发生概率(O):导致同一失效模式发生的概率,详见表2。
(3)探测度(D):评估失效模式是否易被检测,详见表3。
(4)RPN:根据严重度(S)、发生概率(O)和探测度(D)的离散评判等级计算RPN值,再确定风险可接受的RPN值。
医疗器械风险可接受性评判标准详见表4,对31≤RPN≤80或S≥4或O=4的失效模式定义为不可接受风险,应从提升故障被检出的可能性、降低故障危害性、降低故障发生概率3个角度提出针对性的优化策略。当优化策略实施后,应重新评定RPN值,确保RPN值降低到可接受范围内。

表1 严重度(S)分级及其描述

表2 发生概率(O)分级及其描述

表3 探测度(D)分级及其描述
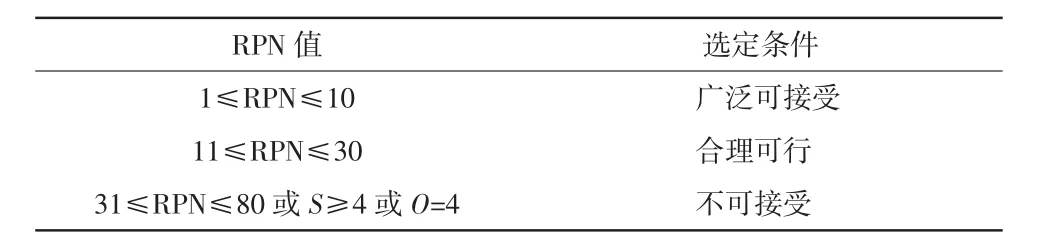
表4 医疗器械风险可接受性评判标准
3 结果
FMEA团队利用FMEA从透析用水、血液回路和透析液回路3个方面进行了风险分析。为方便比较,定义S1、S2,O1、O2,D1、D2和 RPN1、RPN2分别表示FMEA风险改进措施实施前、后的严重度、发生概率、探测度和风险顺序数。
3.1 透析用水
只考虑透析用水失效下对血液透析机的影响时,其FMEA分析结果详见表5。对透析用水的失效模式采取风险改进措施后,使用FMEA再评价,结果详见表6。RPN1与 RPN2比较,t=5.657,P<0.05。
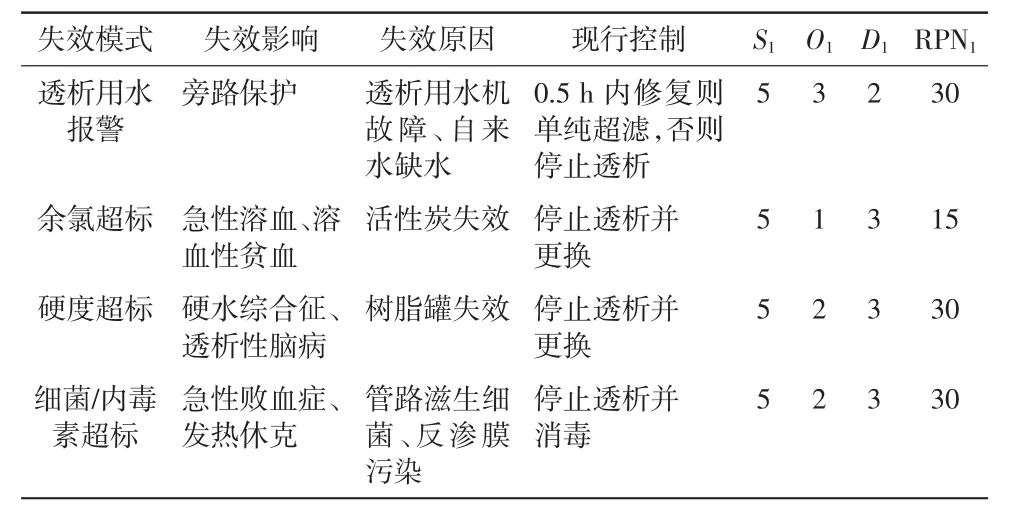
表5 透析用水RPN1评估

表6 透析用水RPN2评估
虽然透析用水供给系统是血液透析机的辅助设备,但是其出现故障往往会导致患者透析中断,存在严重的质量与安全隐患。因此,定期更换水处理系统的锰砂、活性炭、树脂、过滤器、反渗膜等耗材,定期消毒供水管路,可以大大减少水处理系统失效模式的发生。同时,为避免透析用水失效,最好使用双台透析用水处理系统协同工作。
3.2 血液回路
血液透析机中血液回路的FMEA分析结果详见表7。根据表7中RPN1值采取风险改进措施后,进行FMEA再评价,结果详见表8。RPN1与RPN2比较,t=22.822,P<0.05。

表7 血液回路RPN1评估
血液回路直接与患者接触,故其临床风险较高。而血液回路失效模式大多与护师的操作水平和质量控制观念相关。因此,规范护师操作和落实注意事项可避免大部分故障,同时仍需要维修工程师进行日常维护保养和定期校准。
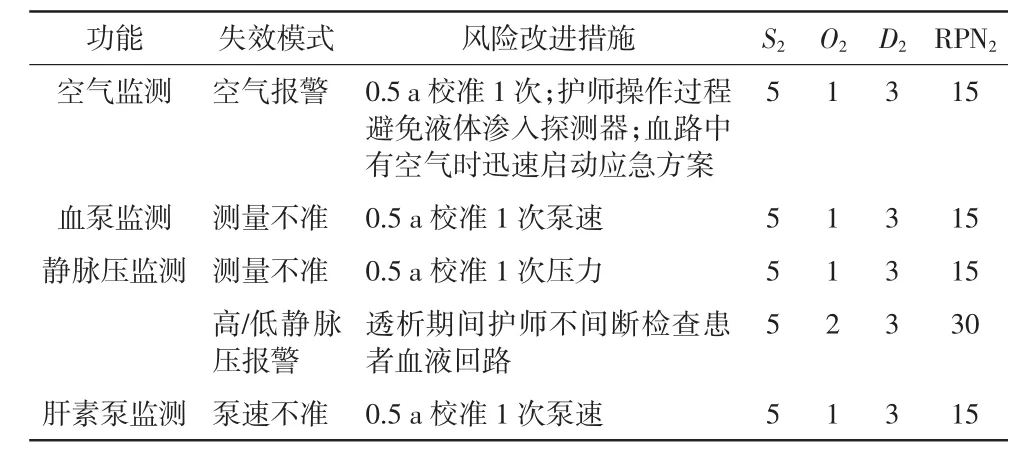
表8 血液回路RPN2评估
3.3 透析液回路
从血液透析机的透析液配制和运送等过程对血液透析机的透析液回路进行FMEA分析,详见表9。根据表9中RPN1值采取风险改进措施后,进行FMEA再评价,结果详见表10。RPN1与RPN2比较,t=35.644,P<0.05。
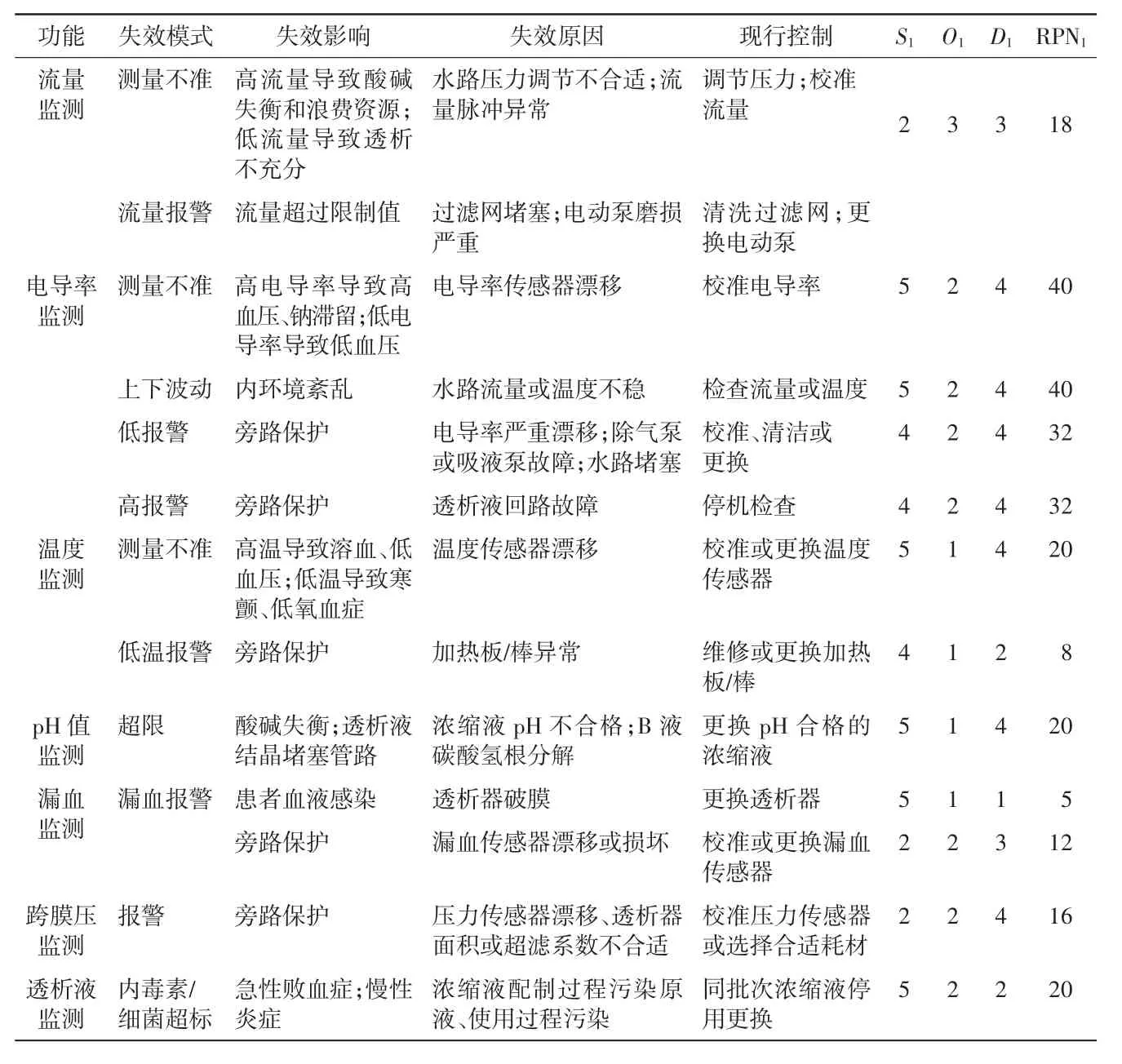
表9 透析液回路RPN1评估
由表10可知,多数失效模式的严重度虽然没有改变,但其发生概率得到了合理控制,部分失效模式的探测度得到提高,从而降低了失效模式的RPN值。透析液回路的失效模式相对于透析用水和血液回路来说,其失效模式多,且失效原因较复杂。因此,透析液回路的失效模式既是维修、维护人员学习的重点,也是故障排除和解决的难点。
综上所述,通过FMEA识别的血液透析机的12个主要功能、22个主要失效模式的平均RPN1值为26.6,采取风险改进措施后平均RPN2值为12.3,降低了14.3。
4 患者对血液透析机的满意度分析
透析患者对血液透析机运行情况的满意度分为3个等级,包括满意:质量很好,性能稳定,极少出问题,出现故障后工程师能及时修复;一般:质量一般,性能较稳定,很少出问题,出现故障后工程师修复时间在可接受范围内;不满意:质量差,性能不稳定,经常出现故障,出现故障后不能及时解决问题,延误透析。其满意度调查结果详见表11。
由表11可知,在引入FMEA改进措施后患者对血液透析机的满意度提高了11%,不满意度下降了3%。采用非参数秩和检验,Z=-2.034,P<0.05,对照组和实验组的满意度差异具有统计学意义。
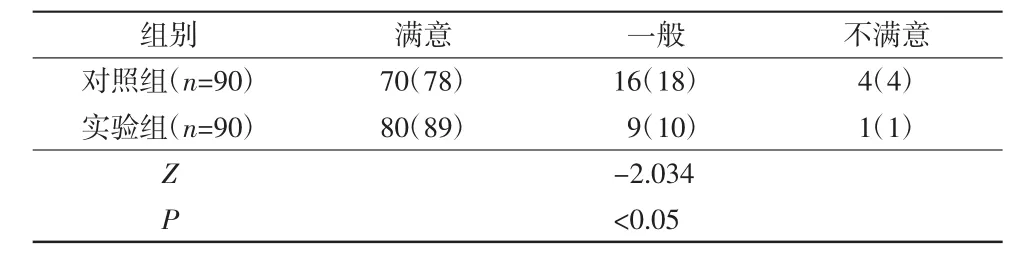
表11 透析患者对血液透析机运行情况的满意度调查[n(%)]
5 结语
利用FMEA方法首先要求对在用医疗器械有夯实的理论基础和深入研究,同时还应尽可能多地收集相关技术资料。在这一过程中专家的知识和经验非常重要,但是专家的知识和经验一般采用主观或定性的语言描述[12],而FMEA方法很难用语言变量准确判断,因此可利用模糊集理论来准确评估。其次FMEA方法通过计算发生概率(O)、严重度(S)和探测度(D)三者的乘积得出RPN值,以RPN值来评估医疗器械的风险顺序。同时还应注意三者之间的相对重要性,不同的O、S、D相乘可以得到相同的RPN值,而此时不同的失效模式对医疗器械的风险影响却不同[13-14],故可利用灰色关联理论先计算风险关联度,再对其排序来确定各失效模式的风险顺序。
本研究利用FMEA对血液透析机的透析用水、血液回路和透析液回路3个方面开展临床使用风险分析,结果表明FMEA改进措施的应用能明显降低血液透析机的临床使用风险,减少潜在失效模式的发生,提高患者满意度。
此外,不同类别的医疗器械由于工作原理、制造工艺和设备属性等不同,其评价标准和具体实施办法可能存在差异。因此,医院在推行FMEA时,一定要从所处的科室、医疗器械的特点出发,优先选择使用风险高、对患者或使用人员危害性大的医疗器械作为FMEA分析重点,并根据医疗器械类别制订合适的评价标准。

