基于Cyt b基因的雅鲁藏布江下游墨脱江段及察隅河墨脱裂腹鱼的遗传多样性及种群历史动态分析
俞 丹 张 智, 张 健, 林鹏程 熊淑蓉 唐芬莲 刘焕章
(1. 中国科学院水生生物研究所水生生物多样性与保护重点实验室, 武汉 430072;2. 中国科学院大学, 北京 100049; 3. 西华师范大学, 南充 637002)
生物多样性是地球上宝贵的生物资源[1], 包括遗传多样性(Genetic diversity)、功能多样性(Functional diversity)和系统发育多样性(Phylogenetic diversity)等不同的维度[2]。遗传多样性又称为基因多样性(Genes diversity), 广义上是指地球上所有生物携带的遗传信息的总和; 狭义上是指种内不同种群或同一种群内不同个体的遗传变异的总和。通常所讲的遗传多样性是指狭义的遗传多样性。生物的遗传多样性水平是生物长期进化的产物, 是评估生物资源现状的一个重要参数, 遗传多样性越高,即遗传变异越丰富, 表示对环境的适应能力就越强。反之, 在一些濒危物种或种群中, 由于生境恶化、过度捕捞以及生物入侵等影响, 会导致遗传多样性降低, 出现遗传衰退, 最终可能灭绝[3]。因此,对遗传多样性的研究不仅可以揭示物种或种群的起源时间、方式等进化历史, 还可以进一步分析其进化潜力和发展趋势。
雅鲁藏布江是青藏高原上的第一大河, 也是世界上海拔最高的大河之一, 它发源于喜马拉雅北麓的杰马央宗冰川, 由西向东横贯西藏南部, 绕过喜马拉雅山脉最东端的南迦巴瓦峰转向南流, 从巴昔卡进入印度境内后称布拉马普特拉河[4]。雅鲁藏布江下游从派镇到巴昔卡, 呈高山峡谷, 同时汇集了金珠藏布、西莫河、西贡河等众多支流, 孕育了丰富的鱼类资源, 据调查雅鲁藏布江下游分布有鱼类近 20 种[5]。
裂腹鱼类是适应高海拔冷水环境的一个重要类群, 是硬骨鱼纲(Osteichthyes)鲤形目(Cyprini-formes)鲤科(Cyprinidae)裂腹鱼亚科(Schizothoracinae)鱼类的统称, 其共同的外部态特征是具有臀鳞, 即在肛门和臀鳍基部的两侧各自排列着一行特化的大型鳞片, 形成了腹中线上的一条裂缝, 故称“裂腹”。曹文宣等[6]依据裂腹鱼类中体鳞退化程度、下咽齿行数以及触须数目等, 将裂腹鱼类分成适应高原不同环境的 3 个等级类群, 即原始类群、特化类群和高度特化类群。每一个等级分别代表了青藏高原在隆起过程中的特定的历史阶段。墨脱裂腹鱼(Schizothorax molesworthi)属于裂腹鱼3 种等级类群中的原始类群[7], 分布范围较广, 在我国境内主要分布于雅鲁藏布江下游及其支流和伊洛瓦底江上游支流, 国外也分布于印度、尼泊尔及缅甸。墨脱裂腹鱼主要栖息于湍急河流之中, 主要以硅藻为食[5]。目前对墨脱裂腹鱼的研究甚少, 仅见于少量的鱼类资源调查, 尚未见种群遗传多样性、种群结构方面的研究。
线粒体细胞色素b(Cytb)基因不仅能有效评估物种和种群的遗传多样性, 同时也能敏锐地检测出潜在的种群遗传分化问题[8,9]。本研究对采自雅鲁藏布江下游墨脱江段和察隅河的墨脱裂腹鱼种群进行Cytb基因测序, 分析墨脱裂腹鱼不同地理种群的遗传多样性、种群分化及种群历史动态等, 为雅鲁藏布江鱼类资源的保护提供科学的理论依据。
1 材料与方法
1.1 研究材料
本研究所用样本于2015—2016年采自雅鲁藏布江下游墨脱江段和察隅河, 共计167尾。对雅鲁藏布江下游墨脱江段的干流江段、5条重要支流(白马西路河、哈果河、金珠藏布、西贡河、西莫河)及察隅河进行采样, 根据其地理分布, 最终将其划分为 7个地理种群。所有干流采样点视为干流种群, 其他每个支流采样点视为一个地理种群, 即用支流名称对种群进行命名, 察隅河为单独一个地理种群。采集标本均用 95% 酒精固定, 保存于中国科学院水生生物研究所水生生物博物馆。样本详细信息及分布图见表 1和图 1。
1.2 基因组 DNA 的提取、PCR 扩增及测序
基因组DNA的提取采用高盐抽提法[10]。Cytb基因扩增和测序引物为L14724 (5′-GACTTGAA AAACCACCGTTG-3′)和H15915 (5′-CTCCGATCT CCGGATTACAAGAC-3′)[11]。PCR反应总体积为20 μL, 反应体系包括: 10×Buffer 2 μL, dNTPs 0.25 μL(10 mmol/L), 引物各0.5 μL (10 μmol/L),TaqDNA聚合酶 0.5 U, 基因组DNA模板1—2 μL, 加灭菌双蒸水至 20 μL。PCR反应条件为: 94℃预变性 3min;然后循环包括: 94℃ 变性 45s, 52—58℃退火 45s,72℃ 延伸1min, 共 35 个循环; 最后在 72℃ 延伸8min。PCR产物用 0.8% 琼脂糖凝胶检测目的片段, 成功后送上海生工生物工程股份有限公司完成纯化与测序。
1.3 数据分析
序列比对采用CLUSTALX 2.1软件[12]。采用MEGA 7.0 将碱基序列翻译成相应氨基酸序列进行序列校正。采用PAUP* 4.0b10[13]对序列进行初步分析。在MEGA中采用Kimura双参数模型进行遗传距离计算[14]。碱基替代模型选择采用Jmodeltest 2.0[15]。以弧唇裂腹鱼(Schizothorax curilabiatus)为外类群, 采用邻接法(Neighbor-joining, NJ)、贝叶斯法(Bayesian inferences, BI) 和最大似然法(Maximum likelihood, ML) 构建分子系统发育树。NJ分析在PAUP*软件中进行, BI分析在MrBayes 3.2 软件[16]中进行, ML分析在PhyML 3.0 软件[17]中进行。采用DnaSP v5.10 软件统计种群遗传多样性参数[18]。利用Network5.0 软件以中接法(Median-joining)构建单倍型网络关系图, 分析单倍型之间的进化关系[19]。使用Arlequin3.5软件中的分子方差分析(Analysis of Molecular Variance, AMOVA)[20]估算种群遗传结构和地理群体遗传变异的分布, 计算种群间遗传分化指数FST。种群扩张检验包括: 在Arlequin3.5 计算错配分布值, Tajima’sD和Fu’sFs值, 通过公式τ=2ut估算种群扩张发生时间 [t为种群扩张以来的时间,u为序列的变异速率;u= 2μk,μ为基因序列的突变率,k分析序列的碱基数(bp), 扩张时间T=t×世代时间], 进化速率采用 1.69% /百万年[21]。使用BEAST v1.8.2软件[22]进行种群历史动态的Bayesian skyline plot (BSP)分析, 最后在Tracer v 1.4软件中构图[23]。
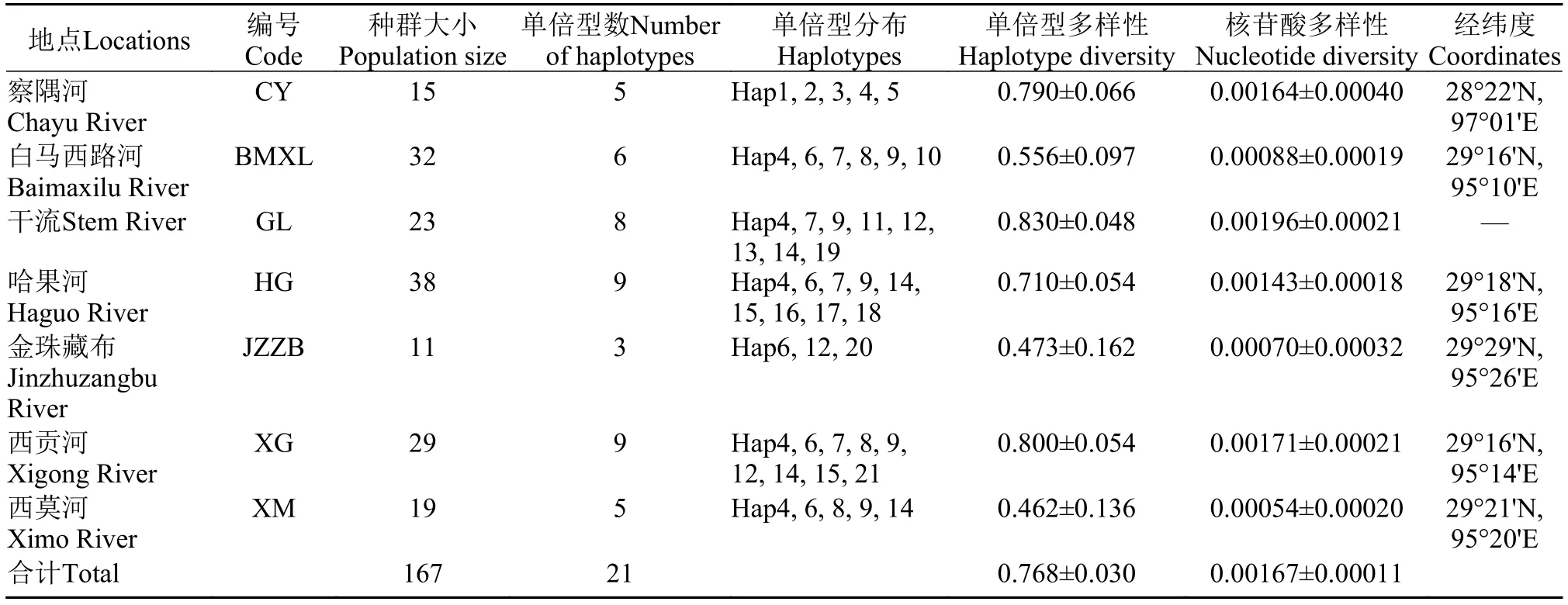
表 1 雅鲁藏布江下游墨脱江段和察隅河墨脱裂腹鱼的样本采集信息及遗传多样性信息Tab. 1 Genetic diversity for the Schizothorax molesworthi from the Motuo area of lower reaches of the Yarlung Zangbo River and Lohit River
2 结果
2.1 Cyt b基因序列变异分析
本研究共获得167尾墨脱裂腹鱼的线粒体Cytb基因序列。比对后得到序列长1140 bp, 变异位点18个, 其中包含12个简约信息位点。所有Cytb基因序列的转换和颠换均未达饱和, 转换数明显大于颠换数, 其平均Ti/Tv的值为2.94。所有个体平均碱基组成: A=27.30%、T=29.83%、C=26.68%、G=16.19%。A+T的含量(57.13%)高于G+C的含量(42.97%)。碱基组成存在强烈的偏倚, G的含量尤其在密码子第三位的含量最低(9.90%)。
2.2 单倍型多样性和核苷酸多样性
在167个墨脱裂腹鱼样本中, 共检测到21个单倍型, 单倍型多样性为0.768 (0.030), 核苷酸多样性为0.00167 (0.00011), 不同地理种群的单倍型多样性和核苷酸多样性见表 1。其中来自干流(GL)种群的单倍型多样性和核苷酸多样性最高, 分别为0.830(0.048)和0.00196 (0.00021); 西莫河(XM)种群的单倍型多样性和核苷酸多样性最低, 分别为0.462 (0.136)和0.00054 (0.00020)。从单倍型分布情况来看, 除了西莫河(XM)种群, 其他种群均含有特有单倍型,特有单倍型共有14个, 其中察隅河种群含有4个特有单倍型。另外, 不同种群之间具有共享单倍型,例如除了金珠藏布(JZZB)种群, 其他所有种群都共享单倍型Hap 4。
2.3 系统发育关系
利用NJ、BI和ML构建墨脱裂腹鱼21个单倍型之间的系统发育树。结果显示, 3种方法分析得到的系统树拓扑结构基本一致, 所有的单倍型可以聚为一个单系, 但在系统树上不按照地理分布聚类,各结点支持率较低, 存在多歧分支(图 2)。单倍型进化网络关系图显示, 单倍型的网络进化关系呈星状分布, 除了金珠藏布(JZZB), 其他所有种群共享单倍型Hap4, 属于原始单倍型和进化中心, 部分单倍型之间通过缺失的中间单倍型相互连接, 不存在显著的地理分布格局(图 3)。
2.4 种群间遗传分化与种群结构
基于Cytb基因序列两两群体之间的遗传分化指数(FST)范围为-0.014—0.771 (表 2)。由表 2可知, 金珠藏布(JZZB)种群与其他种群之间的FST最大(0.372—0.771,P<0.01), 干流和察隅种群与其他种群之间的FST次之(0.093—0.221,P<0.01), 剩余种群之间的FST较小。在不分组的情况下对所有种群进行AMOVA分析, 发现遗传变异主要来自于种群内的遗传差异(种群内的变异百分比占76.12%,P<0.01), 种群间的遗传变异相对较小(23.88%)。将所有墨脱裂腹鱼样品按地理分布划分为2—6个组,具有最大组间变异(FCT值)的划分方案被假定为最符合自然的群体结构模式。在所有分组方案中, 当所有群体划分为2个组时, 即金珠藏布(JZZB)种群为一组, 剩余6个种群为一组, 得到的组间遗传差异FCT最大, 组间变异占50.63% (P<0.01), 组内种群间变异仅占 6.13%, 种群内变异占43.25% (表 3)。这说明雅鲁藏布江下游墨脱江段和察隅河的墨脱裂腹鱼中存在较明显的种群遗传结构, 金珠藏布(JZZB)种群与其他种群具有显著分化。
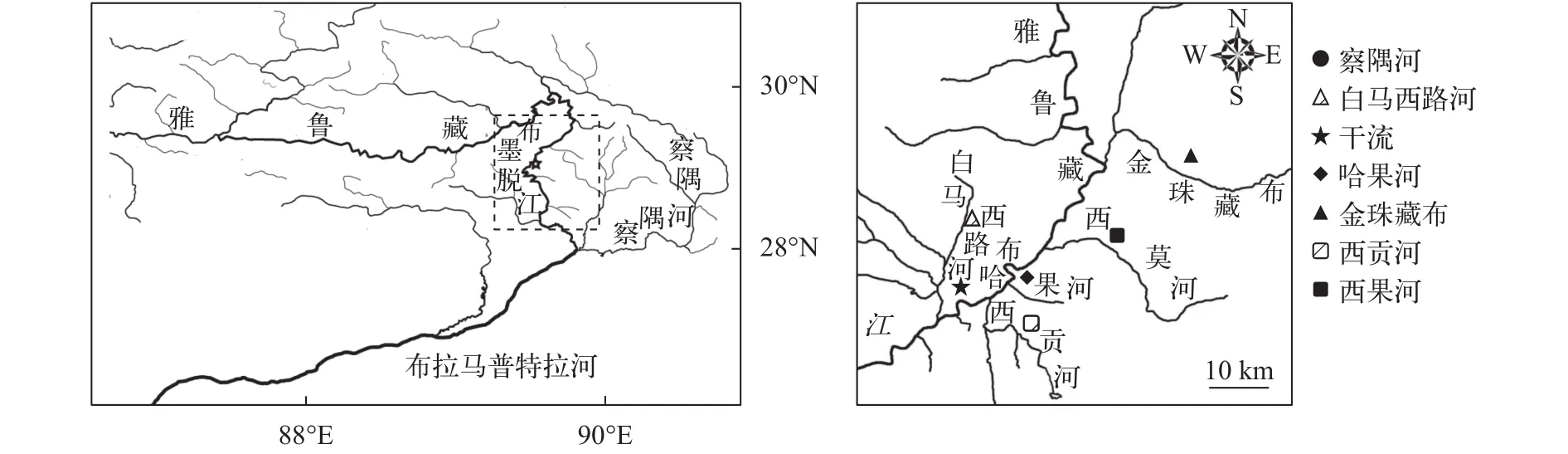
图 1 墨脱裂腹鱼样本采集地点Fig. 1 Sample locations for Schizothorax molesworthi
2.5 种群历史动态分析
核苷酸错配分析发现, 所有群体均呈现单峰分布, 表明这些群体经历了近期扩张; 而中性检验显示, 除了西莫河(XM)的Fu’sFs和Tajima’sD值呈现显著的负值, 其他群体均符合中性进化的假设, 未检测到种群扩张,SSD检验结果显示4个种群(CY、BMXL、HG和JZZB)显著偏离了种群扩张模型, 但是Hri检验结果显示所有墨脱裂腹鱼种群未显著偏离种群扩张模型, 根据1.69%/百万年的突变速率,推算出墨脱裂腹鱼不同地理种群发生扩张的大致时间为0.027—0.153 Ma (表 4)。BSP分析了有效种群大小随溯祖时间的动态变化曲线, 所有个体组成的种群在0—0.01 Ma期间存在种群扩张, 其他地理种群未检测到种群有明显的扩张与收缩(图 4)。
3 讨论
3.1 雅鲁藏布江下游墨脱江段和察隅河墨脱裂腹鱼的遗传多样性和种群分化
遗传多样性是生物多样性的基础, 也是物种长期生存和进化的前提。单倍型多样性(h)和核苷酸多样性(π)是衡量一个物种群体DNA变异程度的重要指标[24]。本研究在167个墨脱裂腹鱼样本中共检测到21个单倍型, 其整体单倍型多样性和核苷酸多样性分别为0.768和0.00167, 低于一些裂腹鱼类的遗传多样性, 例如怒江的怒江裂腹鱼(S.nukiangensis)的h和π分别为 0.965和 0.0024[25], 雅鲁藏布江中上游异齿裂腹鱼(S. oconnori)的h和π分别为 0.833—0.985 和 0.00311—0.01491[26], 但高于玛柯河齐口裂腹鱼(S. prenanti)的h和π (0.5606和0.0007)[27]。因此, 墨脱裂腹鱼呈现单倍型多样性高, 核苷酸多样性低的模式, 这可能是群体受到瓶颈效应后又发生了快速扩张, 在扩张过程中积累的遗传变异会增加群体的单倍型多样性, 但是核苷酸多样性依然较低[28,29]; 亦可能是墨脱裂腹鱼的种群进化历史较短的原因[30]。
遗传分化指数(F-statistic,FST)可在一定程度上指示种群间基因流和遗传漂变的程度, 是反映群体进化历史的重要参数。Wright等[31]认为, 若种群遗传分化指数FST值在0—0.05, 说明不存在分化;FST值在0.05—0.15, 为中度分化;FST值在0.15—0.25, 则为高度分化。本研究中FST和AMOVA分析结果显示不同地理种群间的遗传分化指数在-0.014—0.771。其中, 哈果河(HG)和西贡河(XG)、白马西路河(BMXL)和西莫河(XM)种群之间不存在种群分化; 察隅河(CY)和西贡河(XG)、干流(GL)和其他种群等存在具有中度分化(FST:0.099—0.221,P<0.01); 而金珠藏布(JZZB)与其他种群之间呈现高度分化(FST: 0.372—0.771,P<0.01),推测金珠藏布河口段的一个跌水造成了该种群与干流及其他种群的隔离, 长时间的隔离和生态适应是造成金珠藏布(JZZB)种群与其他种群分化的主要原因。此外, 单倍型分析发现除了金珠藏布(JZZB)种群, 其他所有种群都共享单倍型Hap 4, 出现这个结果的原因也可能是因为该种群取样数量较少(11个个体), 后期需要增加样本量确认。通常来说, 裂腹鱼类的种群分化程度相对较低[32,33], 但在怒江的怒江裂腹鱼中同样检测到了中等程度的分化[25], 与本研究结果相似。另外, 单倍型分析发现66.67%的单倍型为特有单倍型, 这也暗示了不同地理种群之间的基因交流较少, 分化较高。本研究结果中值得一提的是, 虽然察隅河与雅鲁藏布江下游地理距离较远, 但是察隅河与墨脱江段其他种群之间(除了JZZB)的FST为0.093—0.169 (P<0.01), 属于中等分化水平, 表明察隅河种群与雅鲁藏布江下游种群尚有少量的基因交流。
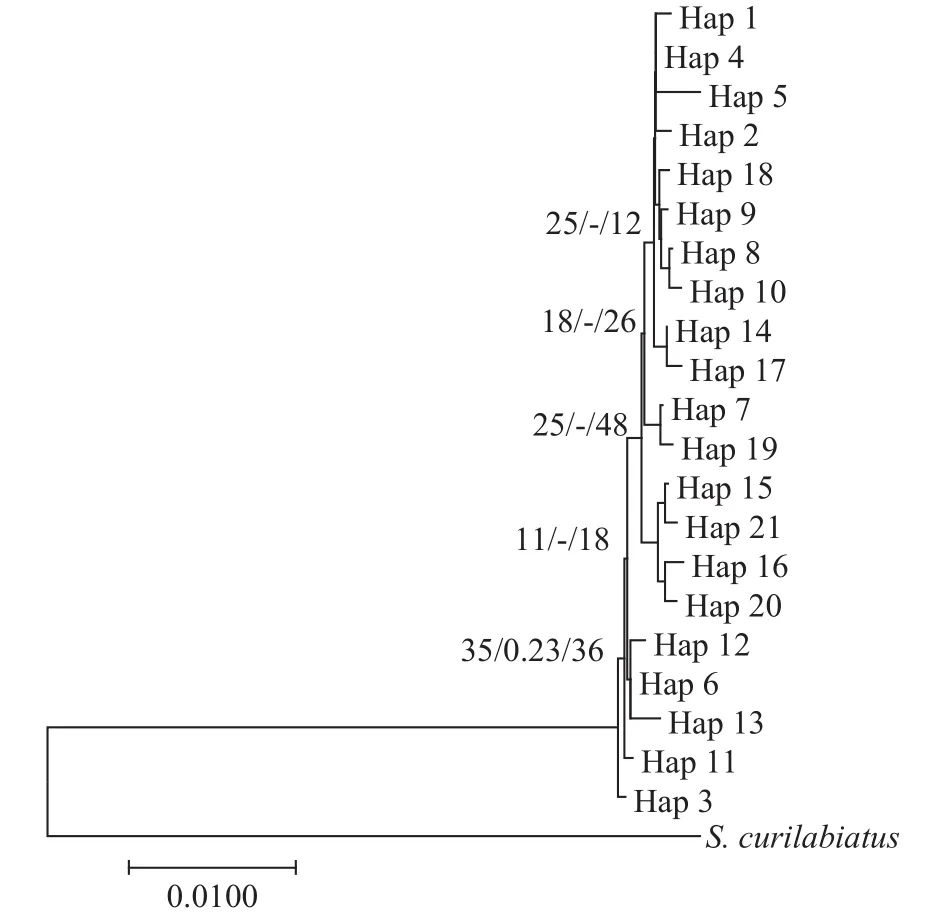
图 2 基于线粒体Cyt b基因单倍型构建的雅鲁藏布江下游墨脱江段和察隅河墨脱裂腹鱼的邻接法、贝叶斯法和最大似然法树Fig. 2 Neighbor-joining (NJ)/Bayesian inferences (BI)/maximum likelihood (ML) tree of Schizothorax molesworthi based on Cyt b gene from the Motuo area of lower reaches of the Yarlung Zangbo River and Lohit River节点处的数值代表NJ/BI/ML分析获得的支持率, “-”表示支持率低于10%, 表示枝长代表分歧度。“Hap”表示单倍型, 其后的序号为单倍型的编号Values at the node represent support values in NJ/BI/ML analysis respectively. “-” represent support values are less than 10%. The length of branch indicates the percentage of divergence. “Hap”denotes Haplotype, subsequent number means haplotype code
3.2 雅鲁藏布江下游墨脱江段和察隅河墨脱裂腹鱼的种群历史动态
对于本研究中发现的墨脱裂腹鱼部分地理种群核苷酸多样性较低的现象, 我们认为地质、冰期事件影响下的种群历史动态变化(如近期的种群扩张)可能是导致部分地理种群遗传多样性偏低的重要原因, 尤其是分布在青藏高原的裂腹鱼类, 属于冷水鱼类, 冰期与间冰期的旋回会对物种的遗传多样性和种群分化产生重要影响。在种群动态分析中, Tajima’sD和Fu’sFs值是两种比较常用的通过中性检验研究种群在历史上是否发生过扩张的参数。Tajima’sD值和Fu’sFs值接近零时表明种群处于稳定状态, 负的D值和Fs值以及差异显著的P值被认为种群在历史上有扩张迹象[34]。但相对而言,Fu’sFs检验对种群扩张更加敏感[35]。在本研究中,所有个体构成的种群Tajima’sD值为不显著负值(P>0.05), 而Fu’sFs值则为差异极显著负值(P<0.01),暗示雅鲁藏布江下游墨脱江段和察隅河的墨脱裂腹鱼可能在近期发生过种群扩张。西莫河(XM)的Tajima’sD和Fu’sFs值均呈现显著的负值, 表明西莫河种群经历了种群扩张。此外, 偏差平方和(SSD)及粗糙指数(Hri)的统计检验不显著时(P>0.05), 表明不能拒绝群体扩张的假说, 即符合群体扩张假说[36]。SSD检验结果显示4个种群(CY、BMXL、HG和JZZB)显著偏离了种群扩张模型, 但是Hri检验结果显示所有墨脱裂腹鱼群体未显著偏离种群扩张模型, 并估算获得不同地理种群的扩张时间约在0.004—0.153 Ma左右, 雅鲁藏布江下游墨脱江段和察隅河的所有墨脱裂腹鱼构成的群体扩张时间为0.137 Ma, 刚好与末次间冰期发生时间一致(MIS5: 78—140 Ka)[37,38]。最后, 墨脱裂腹鱼种群动态随时间变化的BSP图显示, 所有墨脱裂腹鱼组成的群体在0—0.01 Ma期间存在种群扩张, 与最后一次冰期结束时间一致(0.075—0.01 Ma)[37,38], 但BSP分析在其他地理种群未检测到种群有明显的扩张与收缩。上述结果进一步验证了末次冰期事件对雅鲁藏布江下游墨脱江段和察隅河墨脱裂腹鱼种群历史动态的影响。

图 3 基于线粒体Cyt b基因的雅鲁藏布江下游墨脱江段和察隅河墨脱裂腹鱼的单倍型网络图Fig. 3 The haplotype network of Schizothorax molesworthi based on Cyt b gene from the Motuo area of lower reaches of the Yarlung Zangbo River and Lohit River圆圈的大小表示单倍型包含的个体数多少; 中间白色圆圈代表缺失的单倍型The circle size represents the number of individual haplotypes. The white circle represents lacked haplotype
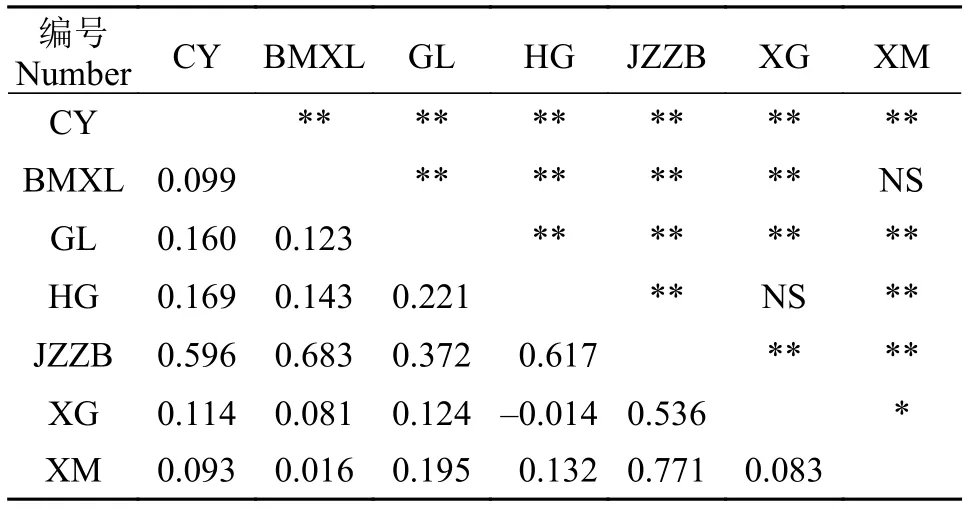
表 2 雅鲁藏布江下游墨脱江段和察隅河墨脱裂腹鱼不同地理种群的遗传分化系数(FST)Tab. 2 Pairwise FST values among different geographic populations of Schizothorax molesworthi from the Motuo area of lower reaches of the Yarlung Zangbo River and Lohit River

表 3 雅罗藏布江下游墨脱江段和察隅河墨脱裂腹鱼的分子方差分析Tab. 3 Analysis of molecular variance analysis among populations of Schizothorax molesworthi from the Motuo area of lower reaches of the Yarlung Zangbo River and Lohit River
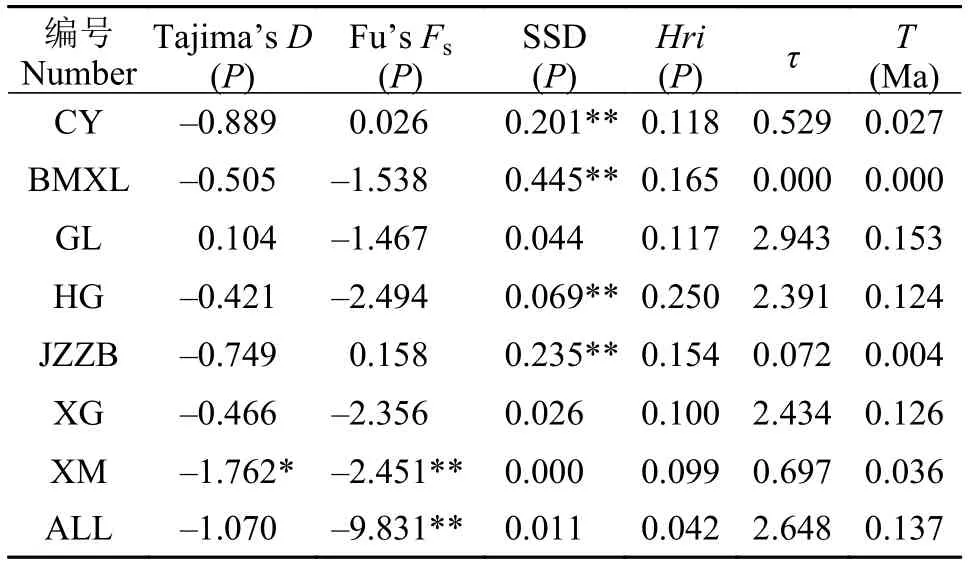
表 4 雅罗藏布江下游墨脱江段和察隅河墨脱裂腹鱼的中性检验和错配分析Tab. 4 Neutrality tests and mismatch distribution values for all populations of Schizothorax molesworthi from the Motuo area of lower reaches of the Yarlung Zangbo River and Lohit River
3.3 雅鲁藏布江墨脱裂腹鱼的保护
墨脱裂腹鱼作为雅鲁藏布江下游支流水生生态系统的重要组成部分, 对维系整个生态系统结构完整和功能的正常发挥具有重要作用。本研究结果显示墨脱裂腹鱼整体遗传多样性水平较低, 暗示墨脱裂腹鱼容易受到环境变化等因素的影响。此外, 种群动态历史分析也发现墨脱裂腹鱼在冰期受到了气候变化的影响。因此, 在全球气候变化的背景下, 墨脱裂腹鱼的物种保护工作尤为重要。在本研究中除了西莫河(XM)种群外, 其他种群均含有特有单倍型, 尤其是察隅河种群含有4个特有单倍型。因此, 为了防止遗传资源的丧失, 在遗传资源保护管理中应对察隅河资源加强保护。此外, 金珠藏布种群与其他6个地理种群出现了较高水平分化,这与金珠藏布河流沿线正好是波密到墨脱的公路有关, 地质条件复杂, 灾害频繁, 河道生境也履遭破坏, 建议加强金珠藏布的生境修复工作, 提高河流的生境适宜性, 保护种群资源。
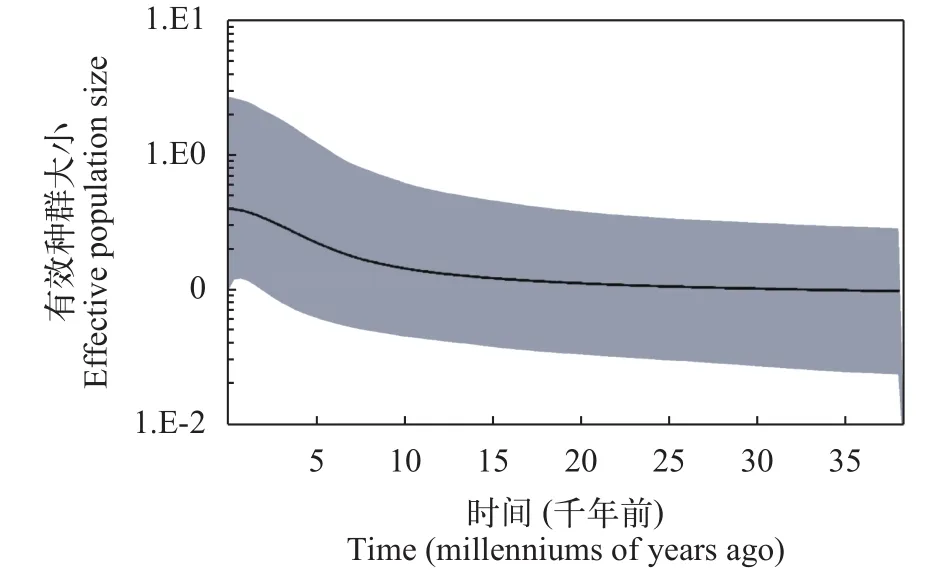
图 4 雅鲁藏布江下游墨脱江段和察隅河墨脱裂腹鱼种群动态随时间变化的BSP图Fig. 4 Bayesian skyline plots (BSP) for population dynamics with time of Schizothorax molesworthi from the Motuo area of lower reaches of the Yarlung Zangbo River and Lohit River黑色线表示中值, 阴影部分为95%的置信区间(HPD)The black line indicates the median; the shadow part shows the 95% highest probability density (HPD)
致谢:
感谢中国科学院水生生物研究所刘飞、黎明政、巩政、王健在采样方面给予的帮助。

