冷藏鲜切猕猴桃片微生物污染的近红外检测
闫思雨,寇婕妤,张 茜,张 敏,周媛媛,王若晨,孙宏民,王虎玄
(陕西科技大学 食品与生物工程学院,陕西 西安 710021)
0 引言
猕猴桃(奇异果)营养丰富,口感酸甜,具有降火通便、降低胆固醇、增强免疫系统等保健功效,是消费者喜爱的滋补水果之一[1].陕西省猕猴桃种植面积和产量居全国第一,以秦岭北麓(周至县、眉县以及武功县为主)为主产区,猕猴桃资源极其丰富[2].随着人们对高质量生活的追求和对服务水平要求的提高,鲜切果片市场不断壮大,“水果捞”、“水果沙拉”、“鲜果茶”等逐渐流行,发展势头迅猛.鲜切果片是以鲜果为原材料,经过清洗、去皮、切分、修整、包装、冷藏等加工过程制成的可供即食的水果加工品[3].由于猕猴桃的营养、保健价值,鲜切猕猴桃片备受消费者青睐.
然而,由于去皮、切分等工序造成果片裸露和汁液外渗,汁液中丰富的营养物质为微生物繁殖创造了有利条件,同时切片工序也增加了微生物对猕猴桃片的污染机率,微生物污染难以避免.猕猴桃片冷藏过程中,果实内部组织损伤不断加重,造成切片表面逐渐变成深褐色,汁液大量流失,微生物尤其是嗜冷菌大量繁殖引起腐烂变质.此外,猕猴桃是典型的呼吸跃变型水果[4],呼吸活性随着成熟度的升高不断增强[5],导致冷藏过程中鲜切猕猴桃片腐败变质速度不断加快.这些不良因素对猕猴桃片质量安全和国内外贸易造成负面影响,也对猕猴桃深加工产业的可持续发展形成阻碍[6].因此,对鲜切猕猴桃片冷藏过程中微生物污染水平进行快速检测具有重要的应用价值.
果蔬微生物污染传统检测方法主要基于微生物分离纯化后的形态观察、生理生化和分子鉴定,费时费力,所需样品量较大且对样品具有破坏性,同时由于操作因素和环境差异的影响导致检测结果误差较大[7].高效液相色谱、气相色谱质联用和酶联免疫法等微生物污染检测方法已经被广泛应用[8-10].但从检测时间、检测成本以及仪器操作要求方面考虑,上述方法并不适用于大量样品的快速检测.光谱技术具有简便快速、无破坏性、绿色无污染、智能操作、灵敏度高、误差较小等优点[11],近年来被证明是一种有效的微生物污染识别方法,在果蔬品质快速检测方面发展迅速[12].近红外光谱可对果片中含氢基团产生特征吸收,吸收光谱含有与果片微生物污染相关的内在信息[13].因此,可通过近红外光谱技术结合化学计量学方法建立冷藏条件下猕猴桃片微生物污染快速检测模型,实现冷藏条件下猕猴桃片品质的快速识别.目前针对鲜果及果汁(苹果[14]、橘子[15]、橙子[16]等)品质指标的近红外光谱快速检测报道较为常见,但对鲜切猕猴桃片冷藏过程中微生物污染水平快速检测仍缺乏系统研究.
本研究以陕西省周至县(猕猴桃产量第一大县)主栽品种(秦美猕猴桃)为原料,经过无菌切片处理后置于4 ℃冷藏,采用稀释平板法对冷藏过程中猕猴桃片微生物总数进行测定,通过傅里叶变换近红外光谱技术对冷藏过程中猕猴桃片进行光谱扫描,并基于偏最小二乘回归(PLSR)对冷藏过程中猕猴桃片微生物污染水平建立定量检测模型,以期实现冷藏条件下鲜切猕猴桃片微生物污染的无损、快速识别,为鲜切猕猴桃片冷藏过程中品质变化的实时动态监控提供技术支撑.
1 材料与方法
1.1 试验原材料与仪器
1.1.1 试验原材料
(1)猕猴桃
陕西省西安市周至县“秦美”猕猴桃,采摘后带至实验室进行无菌切片处理,置于4 ℃冷藏保存.
(2)主要试剂
氯化钠、胰蛋白胨、酵母浸膏、葡萄糖、琼脂等(西安科昊生物工程有限责任公司).
(3)培养基[17]
平板计数琼脂培养基:琼脂15.00 g,胰蛋白胨5.00 g,葡萄糖1.00 g,酵母浸膏2.50 g,蒸馏水1 000 mL;
营养培养液:氯化钠5.00 g,牛肉膏3.00 g,蛋白胨10.00 g,蒸馏水1 000 mL;
生理盐水:氯化钠8.50 g,蒸馏水1 000 mL.
1.1.2 主要仪器
VECTOR22/N型傅里叶近红外光谱仪(德国布鲁克公司);JM-B20001型电子天平(余姚市纪铭称重校验设备有限公司);HPX-9162MBE型油电两用恒温培养箱(常州润华电器有限公司);DXS-280B型手提式压力蒸汽灭菌器(杭州俊升科学器材有限公司);JH-2S型超净工作台(西安太康生物科技有限公司)等.
1.2 试验方法
1.2.1 鲜切猕猴桃样品制备
将新鲜猕猴桃用无菌水洗净,滤纸沥干,在超净工作台中进行去皮.无菌水对去皮果实冲洗2~3次,滤纸沥干.在超净工作台中用无菌小刀将猕猴桃切成约5 mm薄片(约10 g/片),装入无菌自封袋中(24片/包×10包=240片),置于4 ℃冷藏12天.每3天取2包进行近红外光谱扫描和菌落总数测定,共进行5次实验(第0、3、6、9、12天取样).
1.2.2 菌落总数测定
菌落总数是判断微生物污染水平的关键依据,因此,可通过测定鲜切猕猴桃片4 ℃冷藏过程中微生物总数的变化来衡量冷藏过程中的微生物污染水平[18].从两个自封袋中各取10 g样品分别置于盛有90 mL无菌生理盐水的烧杯中,摇动烧杯3~5分钟,制成1∶10样品均液,上述操作在超净工作台中进行.通过预实验得到微生物总数检测的样品稀释倍数分别为102和103(0d)、103和104(3d)、105和106(6d)、106和107(9d)、107和108(12d),取500μL稀释液于平皿内,摇匀,然后向平皿倾注琼脂培养基,待培养基凝固后将所有培养皿置于37 ℃下培养48 h后取出计数.每个稀释梯度样品作3次平行,测定结果以lg(CFU/g)表示.样品匀液稀释方法、测定步骤及计数方法均参照《食品卫生微生物学检验 菌落总数测定》(GB 4789.2-2016)进行[19].
1.2.3 近红外光谱采集
从两个无菌袋中各取12片猕猴桃直接进行近红外光谱扫描.采集近红外光谱的仪器参数如下:固定光纤探头;波数范围12 000~4 000 cm-1;分辨率8 cm-1;扫描次数64次[20].对每个猕猴桃片样品前、中、后位置分别进行扫描,对不同扫描位置的近红外光谱进行平均后得到每个样本的代表性近红外光谱图[21].
1.2.4 微生物污染水平定量检测模型建立及优化
为了利用近红外光谱检测信号对鲜切猕猴桃片4 ℃冷藏过程中微生物污染水平进行预测,采用PLSR方法将菌落总数对数值lg(CFU/g)与光谱检测信号值进行拟合.采用光谱分析软件OPUS 7.0(德国布鲁克公司),从中启动定量分析2软件包,按窗口指示添加样品组分为菌落总数,并添加近红外光谱数据及稀释平板法测定的菌落总数真实值,并将所有光谱随机分为校正集和检验集[22](校正集∶检验集=90∶30,各取样时间点24个重复样品中随机选取18个样品作为校正集(18×5)进行模型建立,剩余6个样品作为预测集(6×5)进行模型性能预测.为了提高所建模型的准确性与精度,通过留一交互验证法(LOOCV)对校正集进行建模).利用软件包的自动优化功能,对原始光谱分别进行了减去一条直线、矢量归一化、求导等11种预处理后得到优化光谱信息.选择最佳波段范围、最佳光谱预处理方式和最佳主成分维数,并剔除异常光谱数据[23],将这些优化值作为检验参数并不断调试,最后选择最优参数建立基于近红外光谱的4 ℃冷藏条件下鲜切猕猴桃片微生物污染水平快速检测模型.
1.2.5 检测模型预测性能评价
所建PLSR模型预测性能通过交互验证相关系数(RCV2)、校正均方根误差(RMSECV)、检验集检验相关系数(RP2)、检验均方根误差(RMSEP)、预测残差平方和(PRESS)以及预测相对分析误差(RPD)进行评价.RCV2越高、RMSECV越小,则近红外光谱校正模型预测值越接近于实测值,模型预测准确性越高;RP2越高、RMSEP越小、残差分布越均匀、PRESS越小,RPD大于3.0时,预测效果越好[21,22].
各评价指标的计算公式:
(1)
(2)
(3)
PRESS=∑(Xi-Yi)2
(4)
(5)
式(1)~(5)中:Di为第i个样品的交叉验证测定值;Yi为第i个样品的真值;Ym为所有样品真值的平均值;Xi为第i个样品的光谱预测值;SD为检验集标准差;n为的样品总数,R为维数.
2 结果与讨论
2.1 鲜切猕猴桃片冷藏过程中菌落总数测定结果与分析
图1为鲜切猕猴桃片4 ℃冷藏过程中菌落总数随冷藏时间延长的变化情况,可看出冷藏12天后猕猴桃片中菌落总数从2.969±0.016 lg(CFU/g)增加至7.357±0.214 lg(CFU/g).方差分析结果显示不同冷藏时间下鲜切猕猴桃片菌落总数差异显著(P<0.05),表明冷藏时间对鲜切猕猴桃片菌落总数有显著影响.多重比较结果进一步表明各冷藏天数间鲜切猕猴桃片菌落总数差异显著(P<0.05).鲜切猕猴桃片在4 ℃冷藏12天的过程中菌落总数随着冷藏时间持续呈现快速上升趋势,这可能是因为猕猴桃切片过程中污染的嗜温菌被低温抑制,而污染的嗜冷菌如李斯特菌、假单胞菌及耶氏菌等在4 ℃下仍能存活且在较短时间内调整新陈代谢途径以适应低温环境,并利用猕猴桃片营养成分快速繁殖,使菌落总数呈快速上升趋势[24].0~3天菌落总数增速较3~9天增速缓慢可能因为此时间阶段处在嗜冷菌的适应期.随着冷藏时间延长,鲜切猕猴桃片中嗜冷菌快速繁殖并分泌蛋白酶、脂肪酶等分解酶,通过酶解作用导致猕猴桃片组织腐烂程度加重,汁液流失增多,逐渐失去光泽[25].有研究指出新鲜果蔬菌落数应不超过5.0 lg(CFU/g)[26],故在本研究中,4 ℃冷藏6天后鲜切猕猴桃片开始腐败变质,失去食用价值.
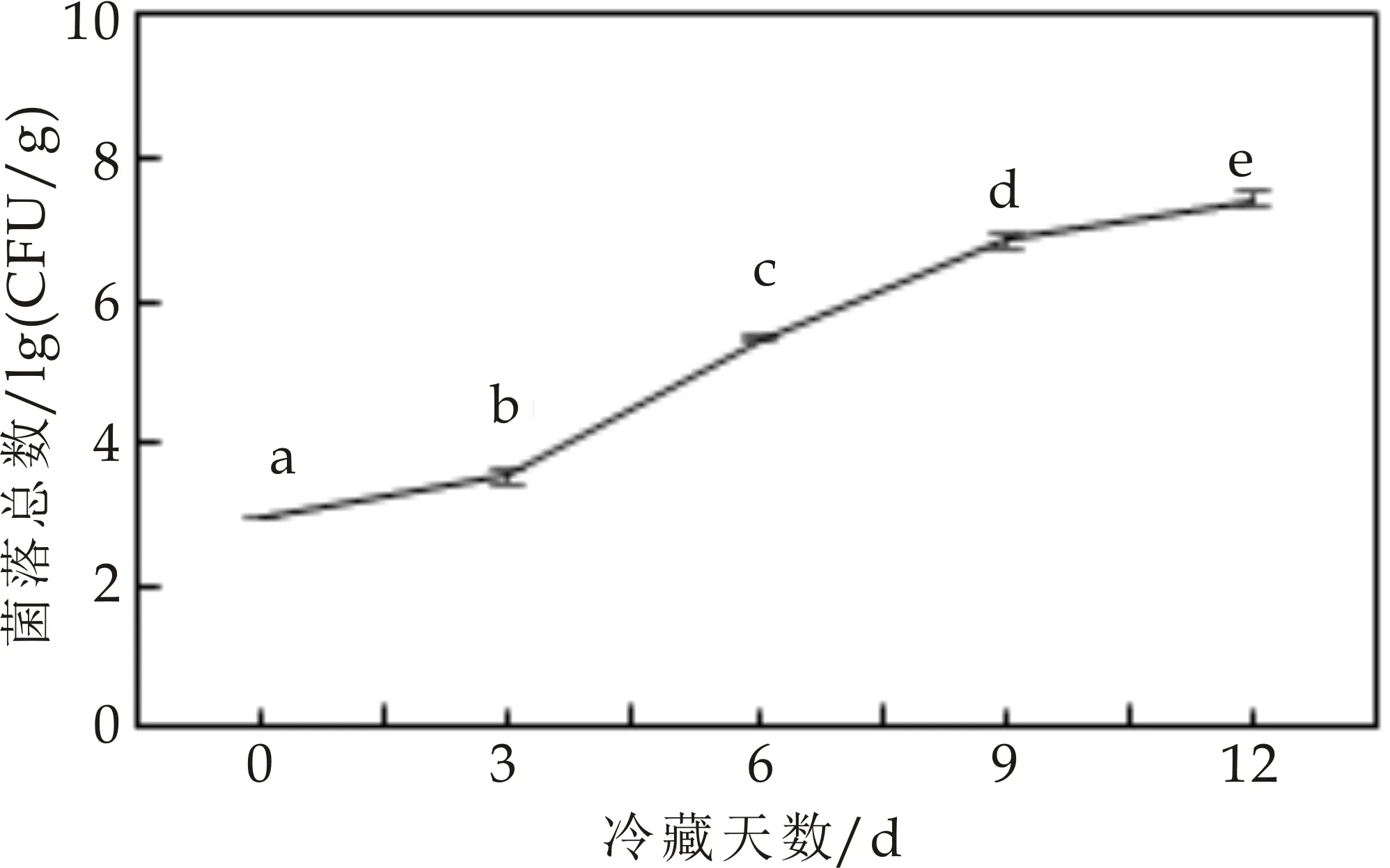
图1 鲜切猕猴桃片冷藏过程中菌落总数真值分布
2.2 近红外原始吸收图谱分析
图2为4 ℃冷藏条件下鲜切猕猴桃片样品全波数范围(4 000~12 000 cm-1)内的近红外原始吸收光谱图.可以看出,鲜切猕猴桃片在各检测时间的光谱峰形大致相同,整体趋势类似,可能是因为所制备的鲜切猕猴桃片均为同品种、同批次.在扫描波数范围4 000~12 000 cm-1内包含非常丰富的光谱吸收信息,在10 220 cm-1、9 340 cm-1、8 375 cm-1、7 900 cm-1、6 945 cm-1、5 940 cm-1、5 160 cm-1等处可观察到明显的波谷或波峰形成.随着光谱曲线的增多,不同冷藏时间鲜切猕猴桃片的近红外光谱重合交叉比较严重,较难直接从光谱曲线中区分不同冷藏时间的猕猴桃片.

图2 猕猴桃片冷藏过程中的原始吸收光谱
图3和4分别为鲜切猕猴桃片冷藏0天和12天的原始吸收光谱图.除冷藏时间不同,其他环境条件均相同,可以看到在5 500~5 000 cm-1、7 000~6 500 cm-1、8 000~7 500 cm-1处两光谱图存在明显差异.这可能是由于猕猴桃片冷藏过程中,微生物生长繁殖,生化酶解,果片呼吸代谢等活动致使果片品质尤其是总酸含量、pH值、总糖含量、Vc含量、可溶性固形物含量、硬度等理化品质产生明显变化,导致不同贮藏时间猕猴桃片在波峰或波谷处的吸收强度不同,初步推断基于近红外光谱技术可对不同冷藏时间的鲜切猕猴桃片进行区分,建立冷藏过程中鲜切猕猴桃片微生物污染水平的近红外模型是可行的.
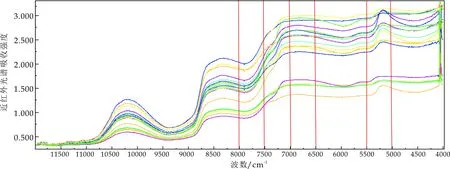
图3 猕猴桃片冷藏0天的原始吸收光谱
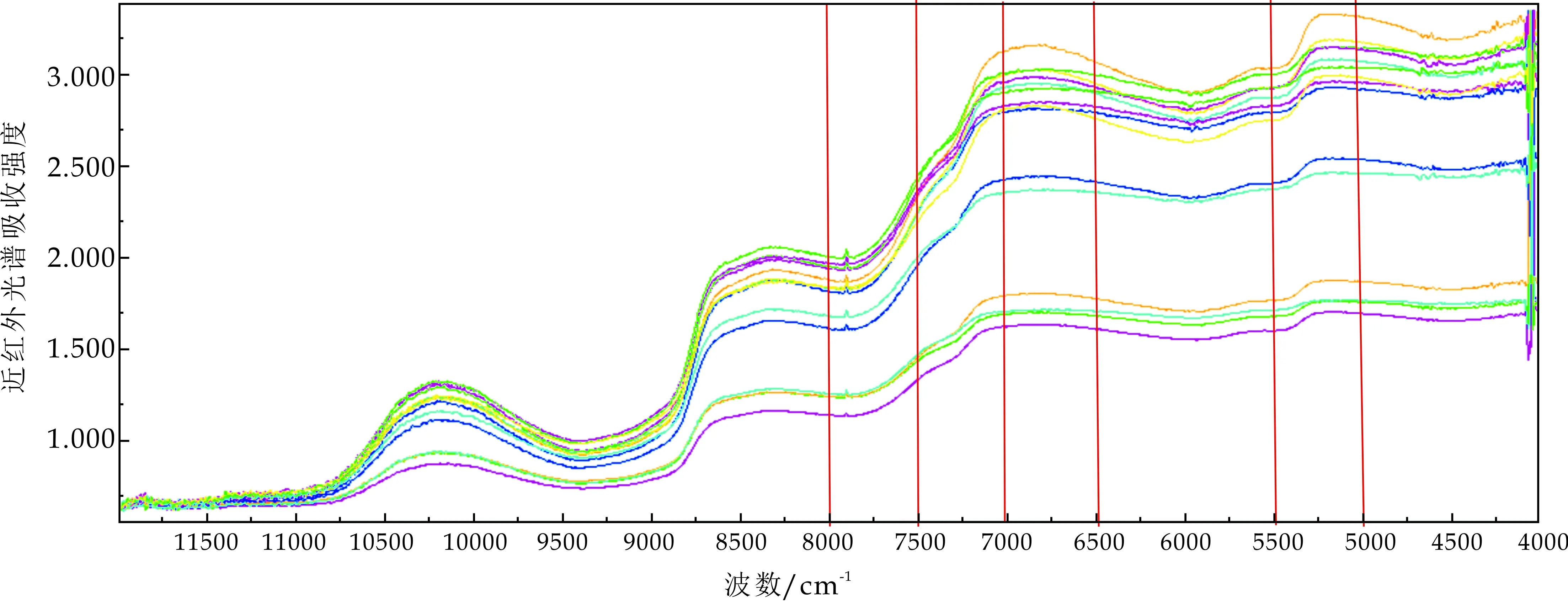
图4 猕猴桃片冷藏12天的原始吸收光谱
2.3 鲜切猕猴桃片冷藏过程中微生物污染水平近红外模型建立
2.3.1 光谱预处理和光谱区间选择
采用PLSR方法建模,利用OPUS 7.0软件探究不同光谱预处理方法对PLSR模型性能的影响,从而找到最优预处理方法以及对应最佳建模光谱区间.不同光谱预处理的冷藏条件下鲜切猕猴桃片菌落总数的PLSR建模结果如表1所示,图5为最佳预处理(减去一条直线)优选波段光谱图.一般来说,较优的模型有较高的R2、较低的RMSECV和RMSEP、RMSECV与RMSEP比值越接近1 越好.可以看出采用“减去一条直线”的预处理方法得到的RMSECV值最小,误差最小,即通过减去一条直线预处理在9 403.2~4 246.5 cm-1波段所建立的模型最佳.
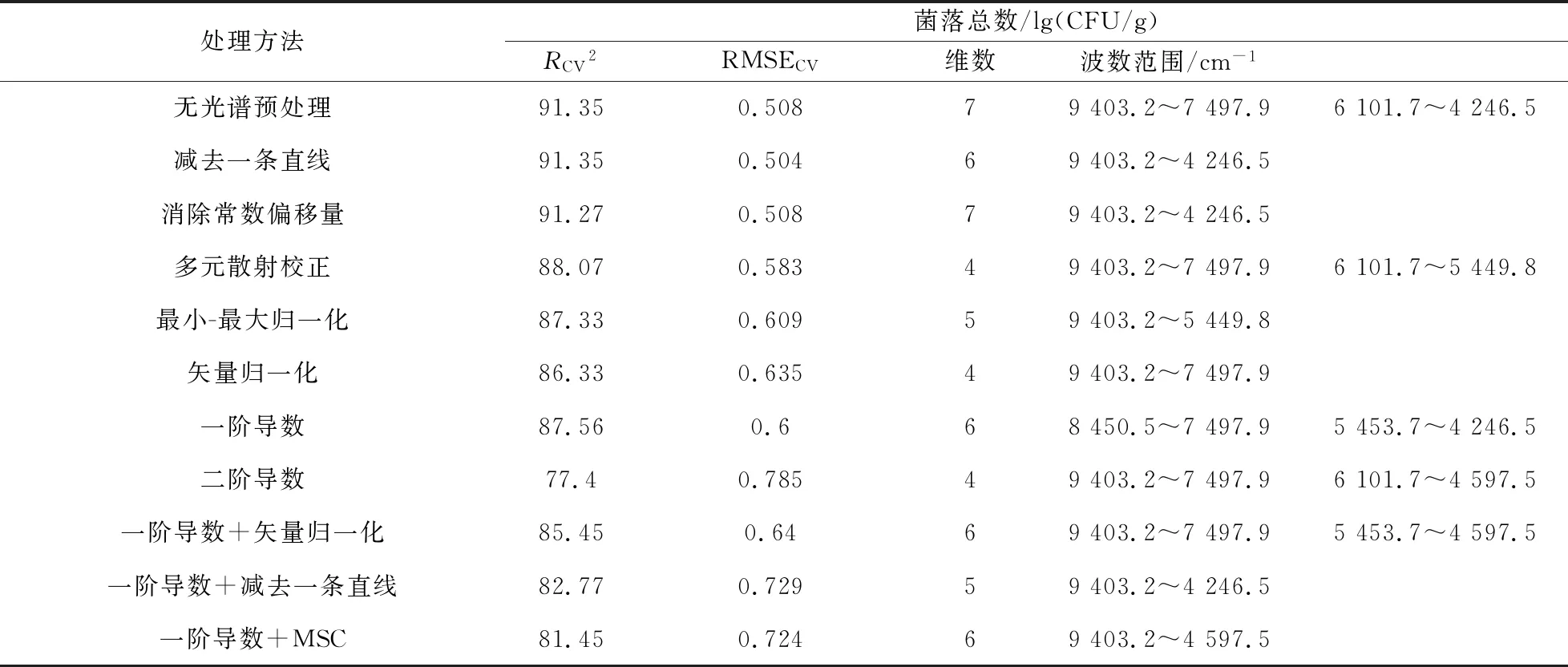
表1 不同预处理对菌落总数校正结果及优选波长范围
2.3.2 校正集和检验集样品划分
表2为校正集和检验集样品随机划分结果.可以看出,校正集和检验集猕猴桃片样品菌落总数真值分布范围广,代表性强,并且样品检验集菌落总数范围包含在校正集范围内,用该校正集所建立的PLSR模型可以适用于检验集进行外部检验,以便分析模型的预测性能.
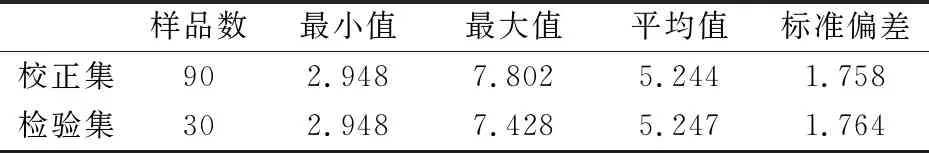
表2 样品集划分结果
2.3.3 留一交互验证法建立PLSR校正模型
经过交互验证,去除1条异常数据后得到优化参数.通过所得优化参数再次进行“留一法” 交互验证得到优化PLSR校正模型.模型性能评价指标值:RMSECV=0.473,RCV2=92.86,RPD=3.74.图6为校正集中猕猴桃片菌落总数PLSR模型预测值和稀释平板法测定真实值拟合图.可以看出,菌落总数模型预测值与真实值拟合性好,相关性高,模型预测可靠性强.
2.3.4 检验集检验PLSR模型
模型预测性能不能仅取决于校正过程的内部交互验证,还得通过未参与建模的未知(外部)样品进行验证.为了更好的评价PLSR校正模型的预测性能,利用已建立的近红外校正模型对检验集未知样品菌落总数进行预测分析.检验集检验校正模型调整模数并剔除3个校正集异常数据后使模型RMSEE进一步降低至0.413,RE2=95.07,模型预测更准确,结果如图7所示.

图7 菌落总数校正模型拟合值与真值散点图
将调整优化后的模型继续进行检验集检验,发现3个检验集异常数据,剔除后得到最佳PLSR模型.检验结果显示:预测值与真值拟合较好,RMSEP=0.389,误差范围合理,RP2=95.81,表明该模型预测效果极佳,结果如图8所示.
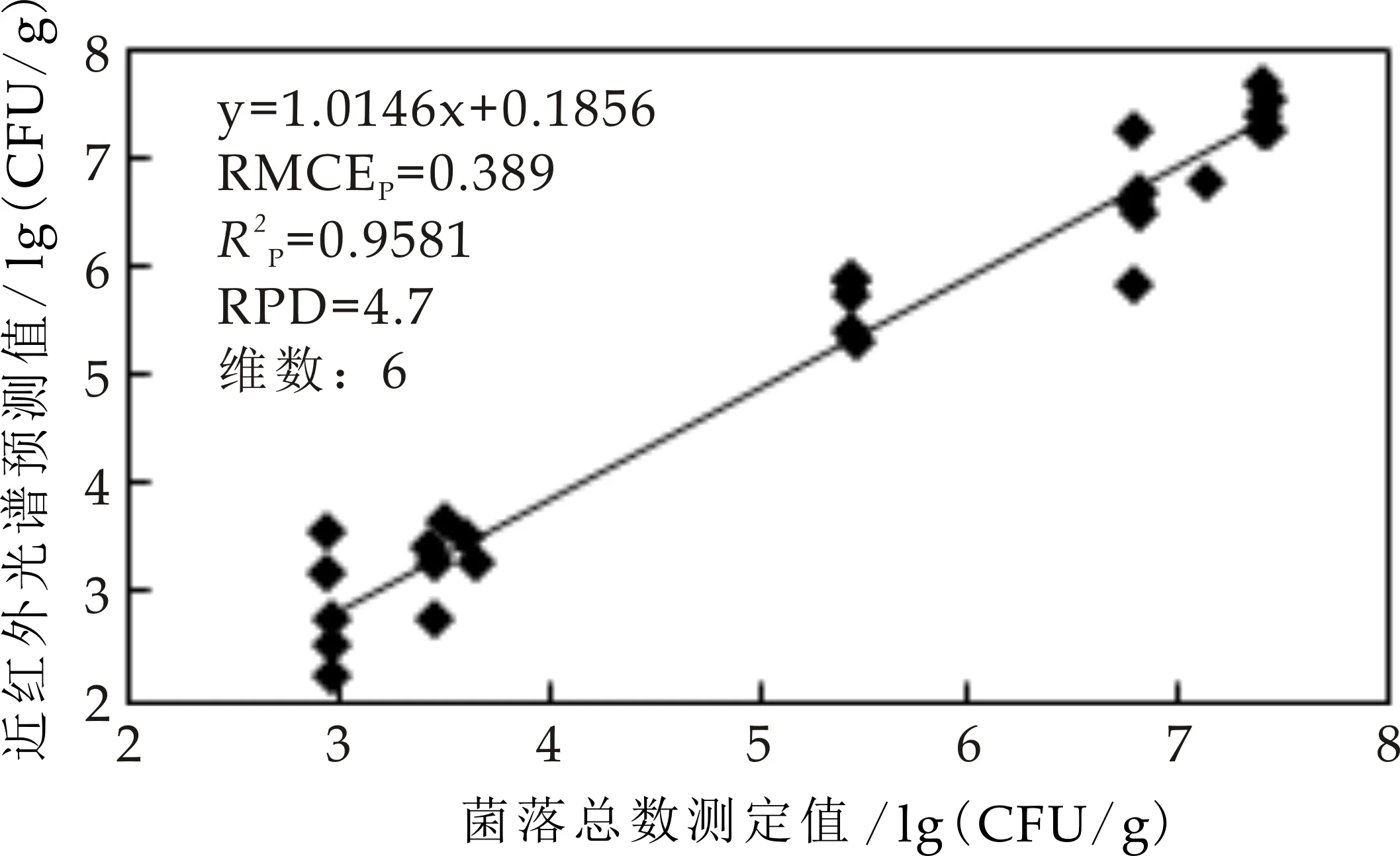
图8 菌落总数检验集检验预测值与真值散点图
对检验集近红外光谱预测值进行残差分析如图9所示.光谱残差值均小于0.15,PRESS小于0.2,残差分布较为均匀,模型预测较稳定,可以得到很好的预测分析效果.综上分析可知,基于近红外光谱技术所建立的鲜切猕猴桃片4 ℃冷藏过程菌落总数PLSR模型预测准确、稳定,可用于鲜切猕猴桃片4 ℃冷藏过程中微生物污染水平变化的实时动态监控.
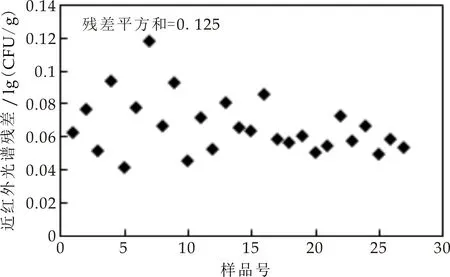
图9 菌落总数近红外光谱残差分布
3 结论
本研究基于傅里叶变换近红外光谱技术与偏最小二乘回归建模方法的结合,对鲜切猕猴桃片4 ℃冷藏过程中微生物污染水平变化进行定量分析,同时建立鲜切猕猴桃片4 ℃冷藏过程中微生物污染水平变化近红外快速检测模型.建立模型的最佳预处理方法为减去一条直线,最佳波数范围为9 403.2~4 246.5 cm-1.最佳模型验证结果显示:RP2=95.81,预测值与真值相关性高;RMSEP=0.389,误差在可接受范围;RPD=4.7(>3),验证模型可靠,可用该模型进行预测;残差分布均匀,检验集光谱残差平方和为0.125(<0.2),预测性能强.所得模型可对鲜切猕猴桃片4 ℃冷藏过程中微生物污染水平变化进行有效识别.该模型可用于鲜切猕猴桃片4 ℃冷藏过程中微生物污染水平变化无损、快速检测,实现对鲜切猕猴桃片4 ℃冷藏过程中品质变化进行可靠的实时动态监控,但由于模型对样品的品种、批次等高要求,在实际应用中仍需针对具体情况对模型进行不断的调试以达到检测目的.

