血清miR-497联合TLR4及Lp-PLA2在缺血性脑卒中诊断及预后中的相关性研究
罗南友,陈明友
(隆昌市人民医院检验科,四川内江 642150)
缺血性脑卒中(IS)是脑卒中中最为常见的一类,占60%~70%[1-2]。近年来,微小RNA与心血管病之间关系的研究逐渐增多。其中,微小RNA-497 (miR-497)被证实能够通过促进血管内皮细胞凋亡、炎症和血管生成等过程的调控在IS病变中发挥作用[3]。Toll-样受体4(TLR4)是参与机体天然免疫的重要炎症分子,其可以诱导促炎症基因、炎性细胞因子等的表达,并在血管内皮炎症损害中发挥作用[4]。脂蛋白相关磷脂酶A2(Lp-PLA2)同样具有血管特异性的炎症标志物,已被证实是心血管疾病的危险因素[5]。本研究通过比较IS患者、出血性脑卒中与健康人群血清miR-497、TLR4及Lp-PLA2水平,旨在探究三者对IS的临床价值。
1 资料与方法
1.1一般资料 收集本院2016年6月到2017年12月确诊的IS患者160例作为IS组,其中男103例,女57例,平均年龄为(60.2±6.1)岁。IS患者均符合《中国急性缺血性脑卒中诊治指南(2014)》[6]中的诊断标准,均为首次发病且经计算机断层扫描(CT)或核磁共振成像(MRI)检查证实。所有患者于入院后依据国立卫生院卒中量表(NIHSS)进行评分[7]。选取出血性脑卒中患者80例作为出血性脑卒中组,其中男47例,女33例,平均年龄为(57.8±6.3)岁。出血性脑卒中患者均符合《中国脑梗死中西医结合诊治指南(2017)》[8]中的诊断标准。同期纳入前来本院体检中心体检的健康者160例作为健康对照组,其中男99例,女61例,平均年龄为(58.9±5.6)岁。排除标准:(1)既往有其他心脑血管疾病史者;(2)排除老年痴呆等神经系统疾病导致的无法采集相关信息和精神分裂症的患者;(3)急性或慢性感染或炎症性疾病。从患者入院开始对纳入的160例IS患者进行6个月的电话随访。本研究的开展经医院伦理委员会批准。
1.2样本例数计算 诊断试验样本例数计算公式为n=(μα2/δ)2(1-P)P,其中α定为0.05,则μα为1.96;δ一般定在0.10;P值的确定:P灵敏度=90%。将μα=1.96,δ=0.10,P灵敏度=90%代入公式计算后可得病例数n≈133例,即本研究需要至少133例患者。本次研究共纳入160例患者,符合统计学要求。
1.3临床资料与样本采集 由研究人员对研究对象的年龄、性别、体质量指数(BMI)、吸烟史、饮酒史、高血压、糖尿病、高胆固醇血症(空腹胆固醇大于240 mg/dL)等基本资料进行采集,BMI计算公式为:体质量(kg)/身高2(m2)。采用促凝采血管采集IS患者、出血性脑卒中患者(入院48 h内采集)与健康体检者外周静脉血2 mL,并于2 h内分离血清后放置于-80 ℃冰箱保存备检测。
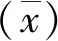
1.5血清miR-497表达水平检测 按照血清RNA提取试剂盒说明书步骤进行总RNA提取。取上述提取的RNA,使用去除基因组逆转录试剂盒逆转录为cDNA,进行实时荧光定量PCR(qPCR),仪器为CFX96(美国Bio-Rad公司)。RT-PCR按照SYBR GREEN说明书进行,反应体系为:Mix 10 μL,上下游引物各0.8 μL,cDNA 2 μL,DEPC水6.4 μL。qPCR循环条件:95 ℃变性5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,45个循环,每组设置3个复孔。使用的miR-497与甘油醛-3-磷酸脱氢酶(GAPDH)引物序列见表1。采用2-ΔΔCt法计算miR-497的相对表达量。

表1 miR-497和GAPDH的引物序列
2 结 果
2.1研究对象基本信息比较 3组间在年龄、性别、吸烟史、饮酒史、高血压、糖尿病、高胆固醇血症和BMI比较,差异均无统计学意义(P>0.05),见表2。
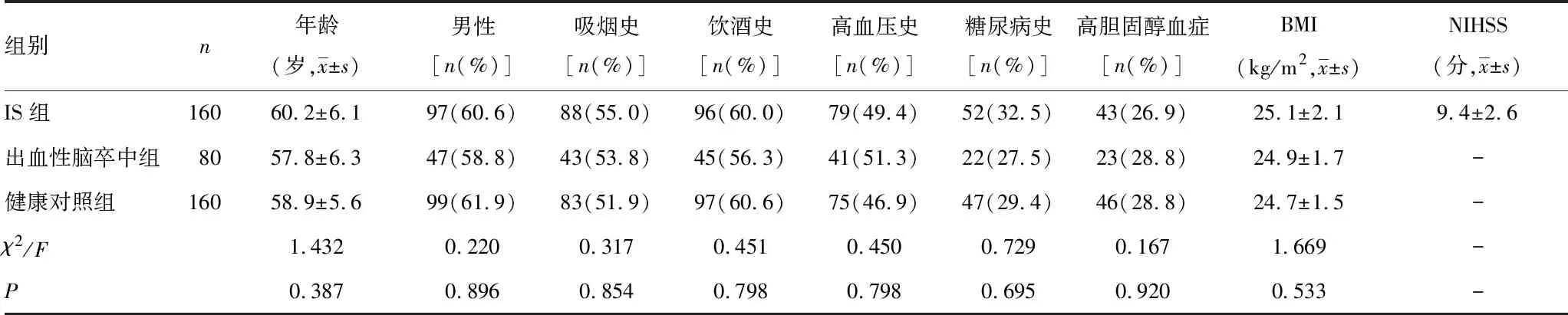
表2 研究对象基本信息比较
注:-表示无数据
2.23组研究对象血清miR-497、TLR4及Lp-PLA2水平比较 血清miR-497、TLR4及Lp-PLA2检测的批内CV值分别为2.4%、2.9%和2.2%,批间CV值分别为2.6%、3.7%和2.8%,均小于5.0%,提示实验结果具有良好的重复性和精确度。与出血性脑卒中组和健康对照组相比,IS组患者血清miR-497、TLR4及Lp-PLA2水平显著升高,差异均具有统计学意义(P<0.05),见表3。
2.3血清miR-497、TLR4及Lp-PLA2水平与IS临床特征间的关系 血清miR-497、TLR4及Lp-PLA2水平与IS患者年龄、性别、吸烟史、饮酒史、高血压、糖尿病、高胆固醇血症和BMI等因素均无相关性(P>0.05),血清miR-497、TLR4及Lp-PLA2水平与IS患者NIHSS评分(miR-497:r=0.545,P=0.001;TLR4:r=0.538,P=0.002;Lp-PLA2:r=0.566,P=0.001)呈正相关,见表4。
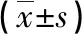
表3 各组研究对象血清miR-497、TLR4及Lp-PLA2水平比较
注:与出血性脑卒中组相比,*P<0.05;与健康对照组相比,#P<0.05
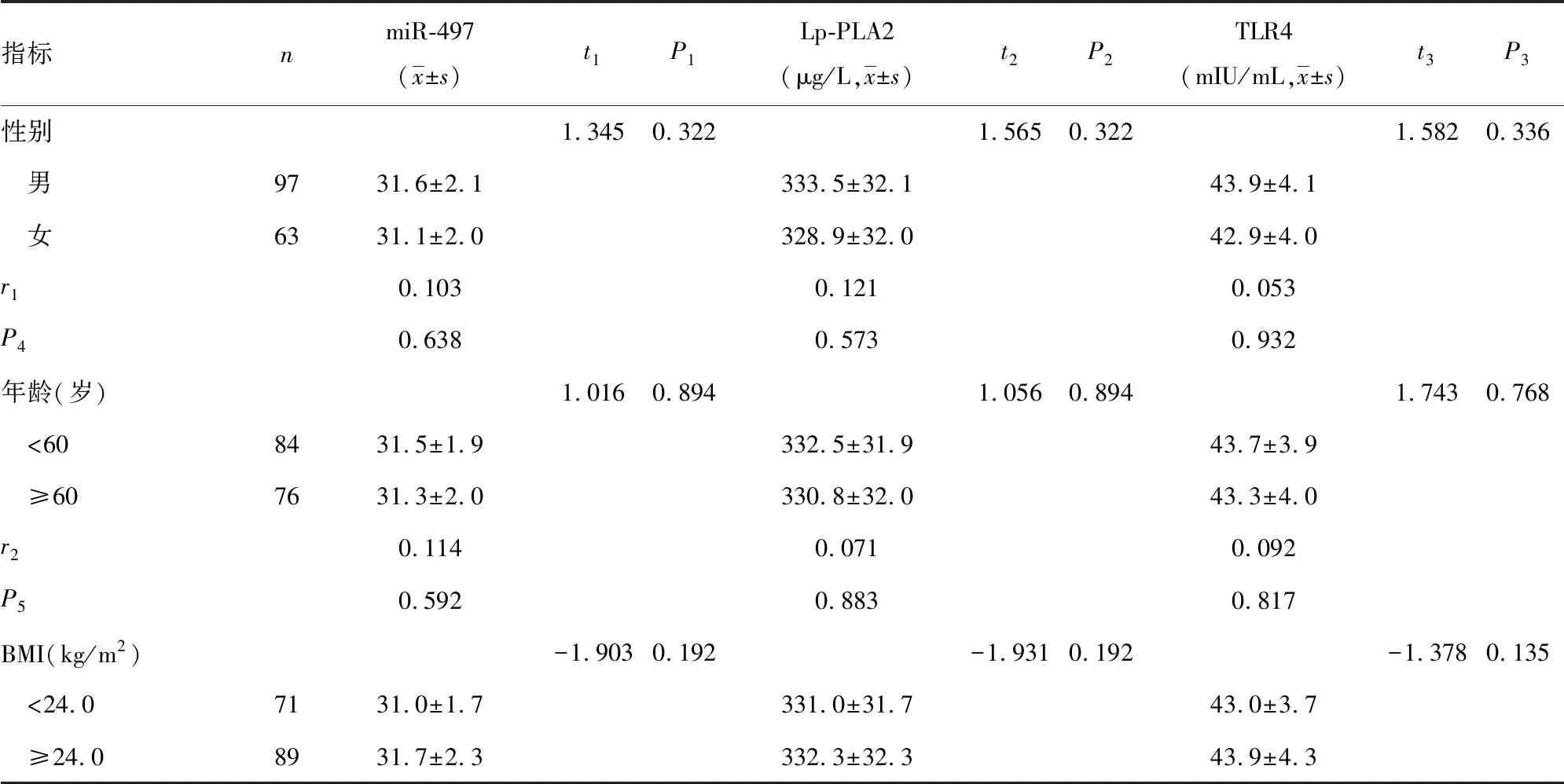
表4 血清miR-497、TLR4及Lp-PLA2水平与IS临床特征的关系(n=160)
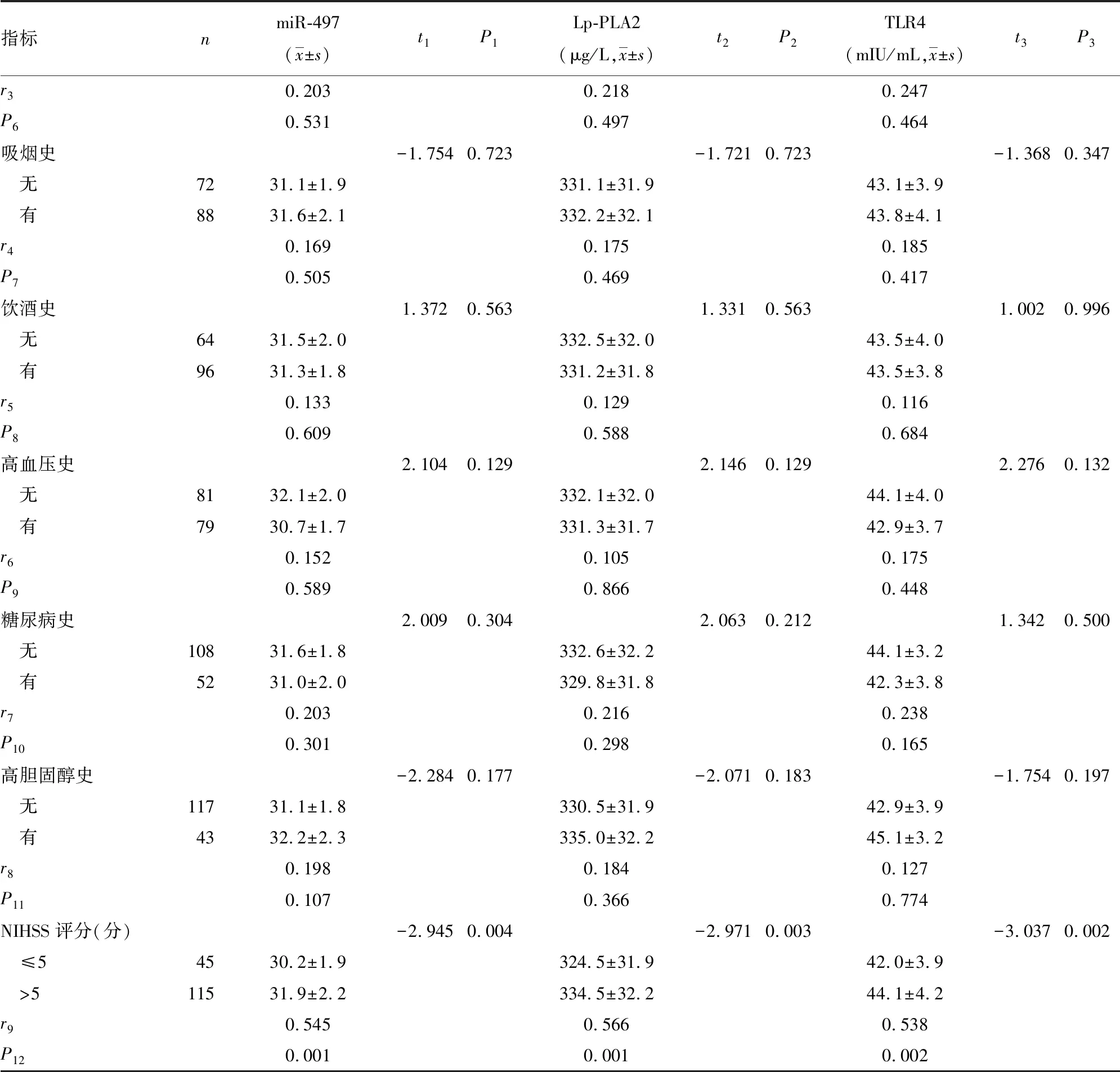
续表4 血清miR-497、TLR4及Lp-PLA2水平与IS临床特征的关系(n=160)
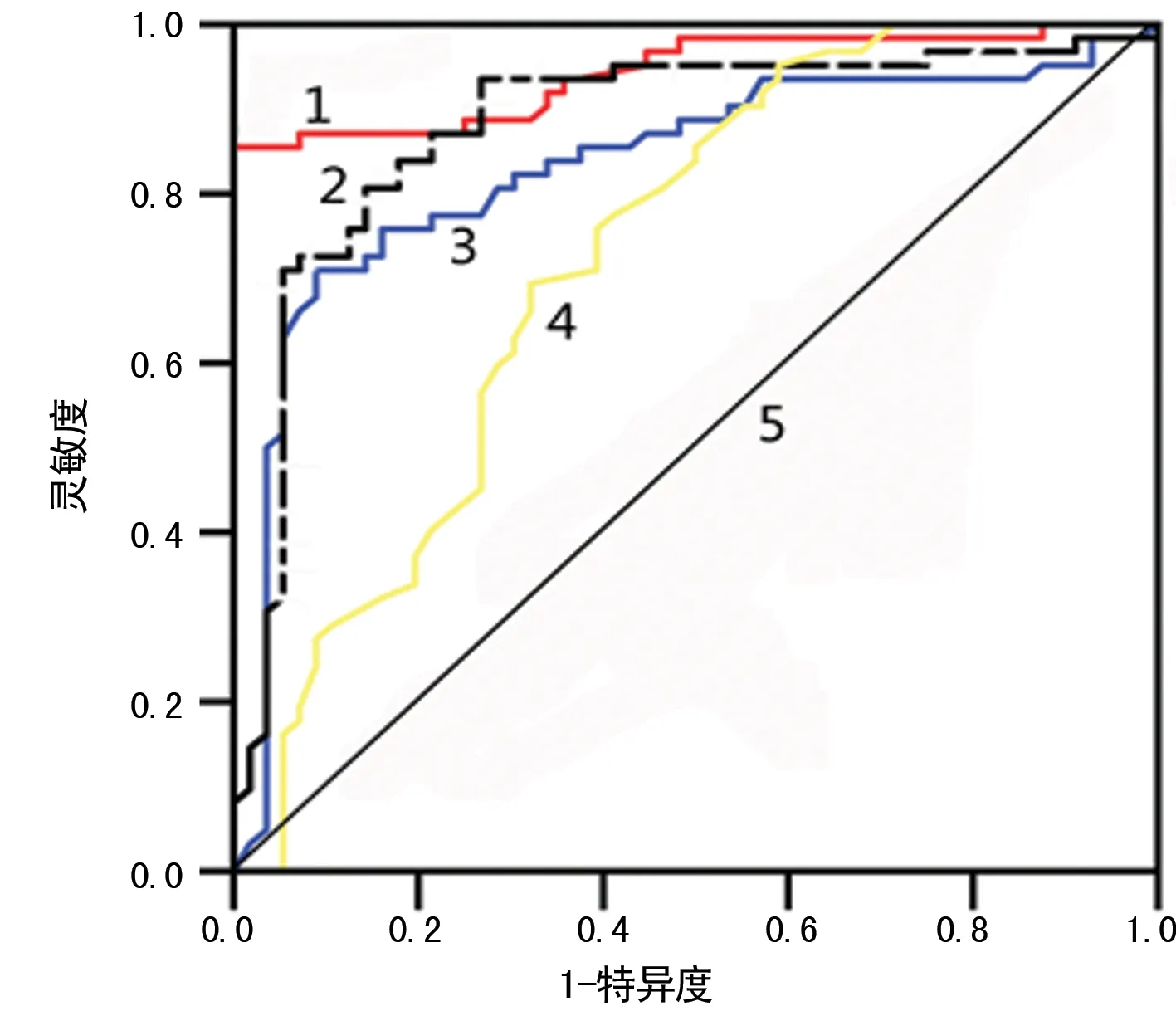
注:1表示联合检测;2表示miR-497;3表示Lp-PLA2;4表示TLR4;5表示参考线
图1各指标单一检测及并联检测鉴别IS的ROC曲线分析
2.4血清miR-497、TLR4及Lp-PLA2鉴别IS的ROC曲线分析 血清miR-497、TLR4及Lp-PLA2区分IS组患者与出血性脑卒中组和健康对照组的AUC分别为:0.904(95%CI:0.833~0.977,P<0.05)、0.764(95%CI:0.688~0.887,P<0.05)和0.844(95%CI:0.800~0.929,P<0.05);对应的灵敏度及特异度分别为78.3%、94.8%,77.0%、78.5%和70.8%、92.8%;对应的临界值分别为16.6、32.2 mIU/mL和214.5 μg/L。当联合血清miR-497、TLR4及Lp-PLA2时,3种指标在区分IS组与出血性脑卒中组和健康对照组的AUC为0.975(95%CI:0.932~0.998,P<0.05),灵敏度为94.2%,特异度为74.3%,见图1。
2.5血清miR-497、TLR4及Lp-PLA2水平对IS患者的生存分析和Cox比例回归模型分析 截至随访完成,160例IS患者中死亡38例,无患者失访。IS患者依据miR-497、TLR4及Lp-PLA2水平的中位数[miR-497:30.8(-log);TLR4:318.6 μg/L;Lp-PLA2:40.1 mIU/mL]分别被分为高miR-497与低miR-497组、高TLR4与低TLR4组和高Lp-PLA2与低Lp-PLA2组。相比低miR-497组,高miR-497组患者的生存时间显著缩短(χ2=8.405,P=0.004),见图2A;相比低TLR4组,高TLR4组患者的生存时间显著缩短(χ2=5.171,P=0.023),见图2B;相比低Lp-PLA2组,高Lp-PLA2组患者的生存时间显著缩短(χ2=11.417,P=0.001),见图2C。Cox比例回归模型分析结果提示,高miR-497、高TLR4、高Lp-PLA2和高血压等因素均是提高IS患者死亡风险的重要因素;而年龄、性别、吸烟史、饮酒史、糖尿病、高胆固醇血症和BMI等因素不能显著提高IS患者死亡风险,见表5。
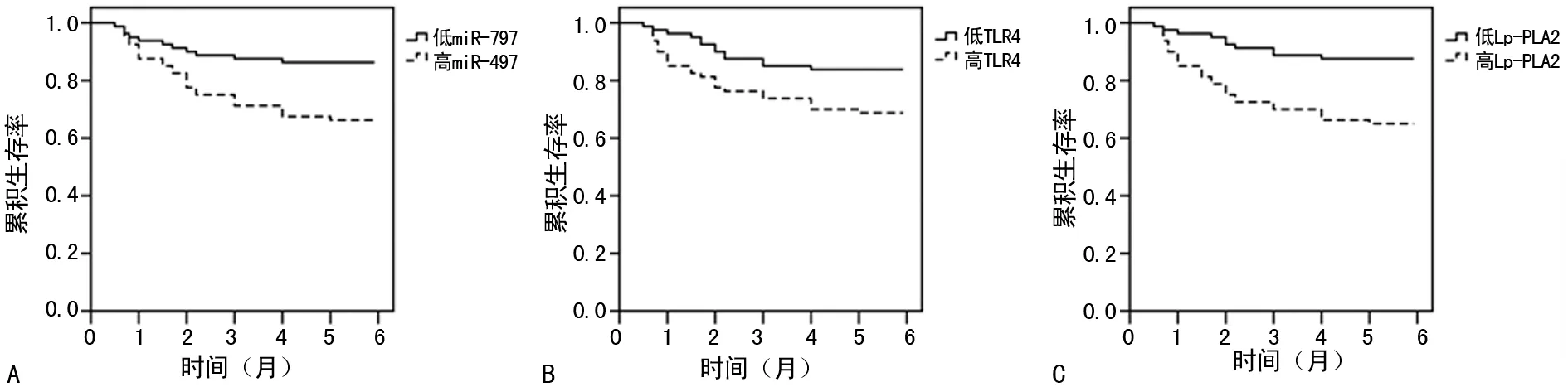
注:A为高miR-497与低miR-497组;B为高TLR4与低TLR4组;C为高Lp-PLA2与低Lp-PLA2组
图2血清miR-497、TLR4及Lp-PLA2水平与IS患者的生存分析
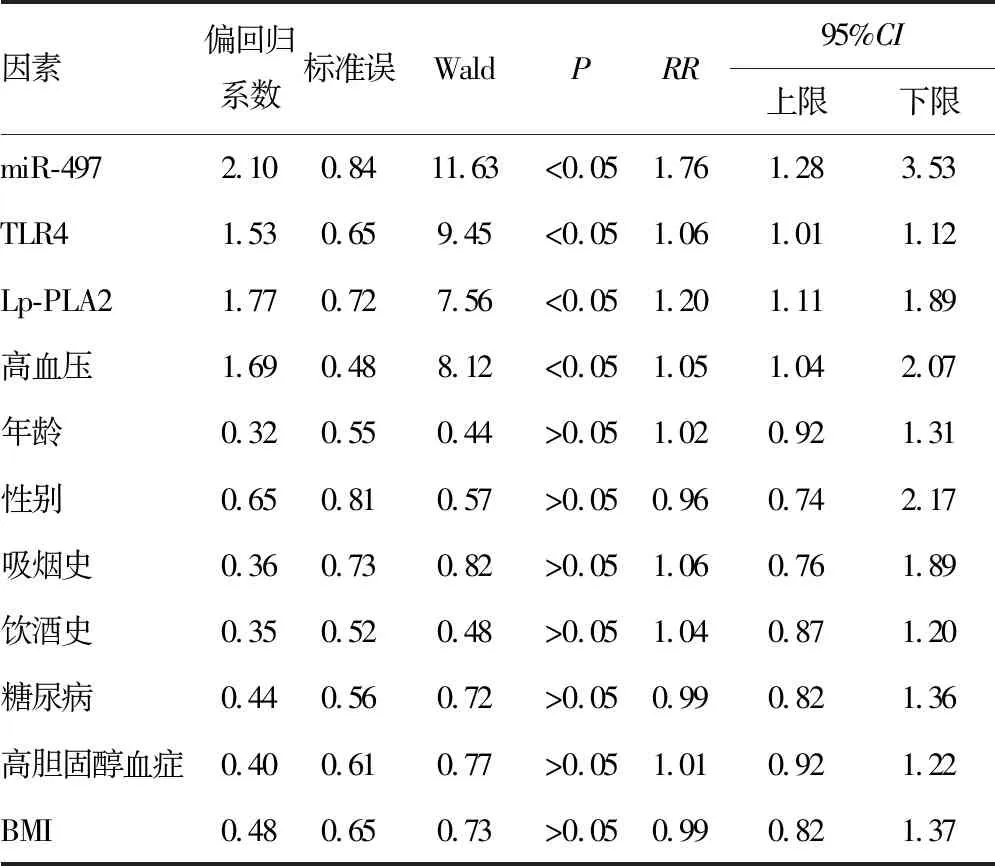
表5 影响IS患者生存的Cox比例回归模型分析
3 讨 论
近年来,越来越多的证据表明miR-497和心肌梗死、视网膜病炎性病变等关系密切[9-10]。LI[10]发现miR-497表达水平的增高可以促进微血管炎性反应等的发生,而降低miR-497的表达可提高视觉功能并能降低糖尿病诱导的促炎症蛋白的表达,从而减轻视网膜血管的损伤。进一步的研究证实,miR-497可以通过调节细胞内p53的水平发挥细胞毒性功能,进而促进炎症因子磷脂酶A2-IVA的作用,提高磷脂酶A2-IVA的表达水平,促进炎症因子的释放[3]。血管内皮细胞炎症导致的动脉粥样斑块形成是IS的重要病理基础,本研究通过临床样本检测出IS患者高水平血清miR-497的表达,且与患者NIHSS评分呈正相关(r=0.545,P=0.001),与前期的基础研究结果相一致[3,9-10]。这些研究表明,IS患者血清中miR-497水平的增高可能参与了机体的炎性反应。
Lp-PLA2又称血小板活化因子乙酰水解酶,主要由成熟的巨噬细胞和淋巴细胞进行合成和分泌,是磷脂酶超家族的一员。Lp-PLA2能够有效使血小板活化因子水解和丧失活性,同时可以水解氧化卵磷脂并促进并介导炎性反应,导致血管内皮细胞损伤,引起大量的单核细胞浸润,继而增强粥样硬化的形成和降低粥样硬化斑块的稳定性[11-12]。本研究结果表明,与健康对照组相比,IS患者血清Lp-PLA2水平显著上升,且与NIHSS评分相关。主要是因为患者出现IS后,Lp-PLA2参与了动脉粥样硬化的主要形成过程,脑梗死后脑脊液中Lp-PLA2的通过血脑屏障进入血清,导致血清Lp-PLA2水平升高。此外,脑梗死可导致急性脑水肿,颅内压增高,通过神经内分泌紊乱机制使肾功能异常,血管紧张素和抗利尿激素分泌增加,肾小球滤过率降低,血液中Lp-PLA2清除率降低,是造成血清Lp-PLA2水平增高的另一个重要原因。
TLR4是参与机体天然免疫的重要炎症分子,同时他也是连接天然免疫与特异性免疫的重要物质。目前已经发现TLR4可以诱导机体产生IL-12、IL-8、IL-23 等可溶性细胞因子,这些细胞因子可促进T辅助细胞参与机体的细胞核体液免疫应答[13]。此外,TLR4还可以诱导促炎症基因、炎性细胞因子等的表达,并在血管内皮炎症损害中发挥作用[14]。血管内皮细胞炎症与氧化应激是动脉粥样斑块形成重要的发生基础。早前报道也指出,IS患者体内血管内皮细胞处于高炎症状态。本研究通过临床样本检测出IS患者高水平血清TLR4的表达,与前期的基础研究结果相呼应[13-14]。
ROC曲线分析显示,血清miR-497、TLR4及Lp-PLA2区分IS组与出血性脑卒中组和健康对照组时具有一定的价值,当联合miR-497、TLR4及Lp-PLA2等指标时在区分IS组患者与出血性脑卒中组和健康对照组的灵敏度达到94.2%,提示联合上述3种标志物具有较高的临床应用价值。进一步的生存分析也提示,高miR-497、高TLR4与高Lp-PLA2水平患者的预后较低水平者更差,Cox比例回归模型分析结果提示,高miR-497、高TLR4、高Lp-PLA2和高血压等因素均是提高IS患者死亡风险的重要因素。上述研究提示,血清miR-497、TLR4及Lp-PLA2在IS诊断及预后警示中具有重要临床价值。然而,本研究仍有如下不足:(1)本研究纳入160例IS患者,病例数仍然有限,后期需要更大样本量的研究来证实血清miR-497、TLR4及Lp-PLA2在我国IS患者中的临床价值;(2)本研究中采用的miR-497、TLR4及Lp-PLA2多个指标的联合模型虽然较各单独指标有较高的临床价值,但该模型的应用仍有待进一步的验证。
4 结 论
本研究发现血清miR-497、TLR4及Lp-PLA2对IS具有潜在的诊断及预后价值,联合应用这3个指标有望成为IS临床诊疗的途径。

