WISP2在非小细胞肺癌中的表达情况及对肺癌A549细胞周期分布和凋亡情况的影响
董兵,刘晓隗,王苏,陈秀军
解放军第三〇五医院心胸外科,北京100017
近年来,肺癌的发病率逐步升高,严重威胁人类的身体健康,是临床常见的恶性肿瘤[1]。相关研究显示,吸烟、职业、环境、电流辐射、遗传等因素均可引起非小细胞肺癌(non-small cell lung cancer,NSCLC)[2],早期临床症状包括胸部胀痛、痰血等,晚期可出现疲乏、体重减轻、食欲下降和呼吸困难等[3]。研究发现,肿瘤组织中异常表达的WNT1诱导信号通路蛋白2(WNT1 inducible signaling pathway protein 2,WISP2)可能与肿瘤的发生、发展密切相关[4],但WISP2蛋白的具体作用机制尚未明确且其与生物学特征关系的报道较少。相关数据显示,WISP2基因具有多功能调节的作用,是肿瘤细胞增殖的负性调节因子,WISP2的缺失可能是导致肿瘤细胞增长失控的原因[5-7],因此,WISP2成为近年来临床的主要研究热点[6]。本研究主要探讨WISP2在NSCLC中的表达情况及对肺癌A549细胞生物学行为的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年1月至2019年3月解放军第三〇五医院收治的NSCLC患者。纳入标准:①均经病理学确诊为NSCLC;②生存时间>3个月;③临床分期为Ⅰ~Ⅲ期;④临床资料完整。排除标准:术前未接受放化疗及其他抗肿瘤治疗;合并其他系统继发性恶性肿瘤。依据纳入和排除标准,本研究共纳入60例NSCLC患者,其中男37例,女23例;年龄44~75岁,平均年龄为(55.38±6.77)岁,<60岁21例,≥60岁39例;病理类型:鳞状细胞癌35例,腺癌21例,其他4例;临床分期:Ⅰ~Ⅱ期24例,Ⅲ期36例;分化程度:低分化31例,中分化26例,高分化3例;吸烟35例,不吸烟25例;淋巴结转移38例,无淋巴结转移22例。同时取60例NSCLC患者的NSCLC组织和相应的癌旁正常组织。
1.2 免疫组化法检测WISP 2蛋白的阳性表达情况
取NSCLC组织和相应的癌旁正常组织制成4 μm的切片,脱蜡、水化、修复等。采用链霉抗生物素蛋白-过氧化物酶(streptavidin-peroxidase,SP)法检测WISP2蛋白的阳性表达情况,具体步骤按照说明书进行。抗原修复后,滴加山羊非免疫血清工作液封闭,加入一抗,3℃孵育过夜,磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗后,加入二抗,二氨基联苯胺(diaminobenzidine,DAB)显色,苏木素复染。SP免疫组化法检测NSCLC组织和癌旁正常组织中WISP2的表达情况。在光镜下观察WISP2蛋白的染色情况,选取PBS代替一抗作为阴性对照,用已知阳性表达的石蜡切片作为阳性对照。
1.3 细胞实验方法
1.3.1 细胞、主要试剂及仪器顺铂耐药的肺癌A549细胞株购自美国BD公司。膜联蛋白V(Annexin V)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)试剂盒购自美国Sigma公司,巴比妥钠孵育缓冲液购自美国ABI公司,RPMI 1640培养基购自美国Corning公司,恒温培养箱购自德国Thermo Fisher Scientific公司。
1.3.2 细胞转染和分组取肺癌A549细胞接种于含10%胎牛血清的RPMI1640培养基,置于37℃、5%CO2饱和湿度的细胞培养箱中培养。取对数生长期的肺癌A549细胞接种于6孔板,每孔1×105/ml。待细胞贴壁,按照试剂盒说明书将WISP2蛋白过表达的载体转染至肺癌A549细胞,作为观察组,未转染的肺癌A549细胞作为对照组。
1.3.3 流式细胞仪检测细胞周期分布情况取NSCLC组和对照组肺癌A549细胞,胰蛋白酶消化后,乙醇洗涤,1000 r/min离心15 min后,300 μl胎牛血清重悬细胞,加入预冷的70%乙醇5 ml,4℃固定过夜,收集细胞,加入PI染色液500 μl,4℃避光孵育30 min后,过300目筛网,采用200 μl的胎牛血清再次重悬细胞,流式细胞仪检测细胞周期分布情况。
1.3.4 流式细胞仪检测细胞凋亡情况采用Annexin V-FITC/PI双染法,将NSCLC组和对照组肺癌A549细胞转移至离心管,胰蛋白酶消化后,1000 r/min,离心5 min,除去上清液。加入1 ml预冷的胎牛血清重悬细胞,加入1 ml预冷的巴比妥钠孵育缓冲液和5 μl的Annexin V-FITC混匀,室温避光孵育10 min,再加入10 μl的PI染色液,4℃避光孵育30 min后,过300目筛网,采用200 μl孵育缓冲液重悬细胞,流式细胞仪检测细胞凋亡情况。
1.4 统计学方法
采用SPSS 19.0软件对所有数据进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;等级资料的比较采用Mann-WhitneyU检验;以P<0.05为差异有统计学意义。
2 结果
2.1 WISP 2蛋白表达情况的比较
NSCLC组织中WISP2蛋白的阳性表达率为51.67%(31/60),低于癌旁正常组织的70.00%(42/60),差异有统计学意义(χ2=4.232,P<0.05)。
2.2 不同临床特征NSCLC患者NSCLC组织中WISP 2蛋白表达情况
不同年龄、性别NSCLC患者NSCLC组织中WISP2蛋白阳性表达率比较,差异均无统计学意义(P>0.05)。不同吸烟情况、病理类型、临床分期、分化程度、淋巴结转移情况NSCLC患者NSCLC组织中WISP2蛋白阳性表达率比较,差异均有统计学意义(P<0.05)。(表1)
2.3 细胞周期分布情况的比较
观察组肺癌A549细胞G1期细胞比例明显高于对照组细胞,S期和G2期细胞比例均明显低于对照组细胞,差异均有统计意义(P<0.01)。(表2)
2.4 细胞凋亡情况的比较
观察组肺癌A549细胞的凋亡率为(5.55±0.69)%,明显高于对照组细胞的(3.05±0.43)%,差异有统计意义(t=19.026,P<0.01)。
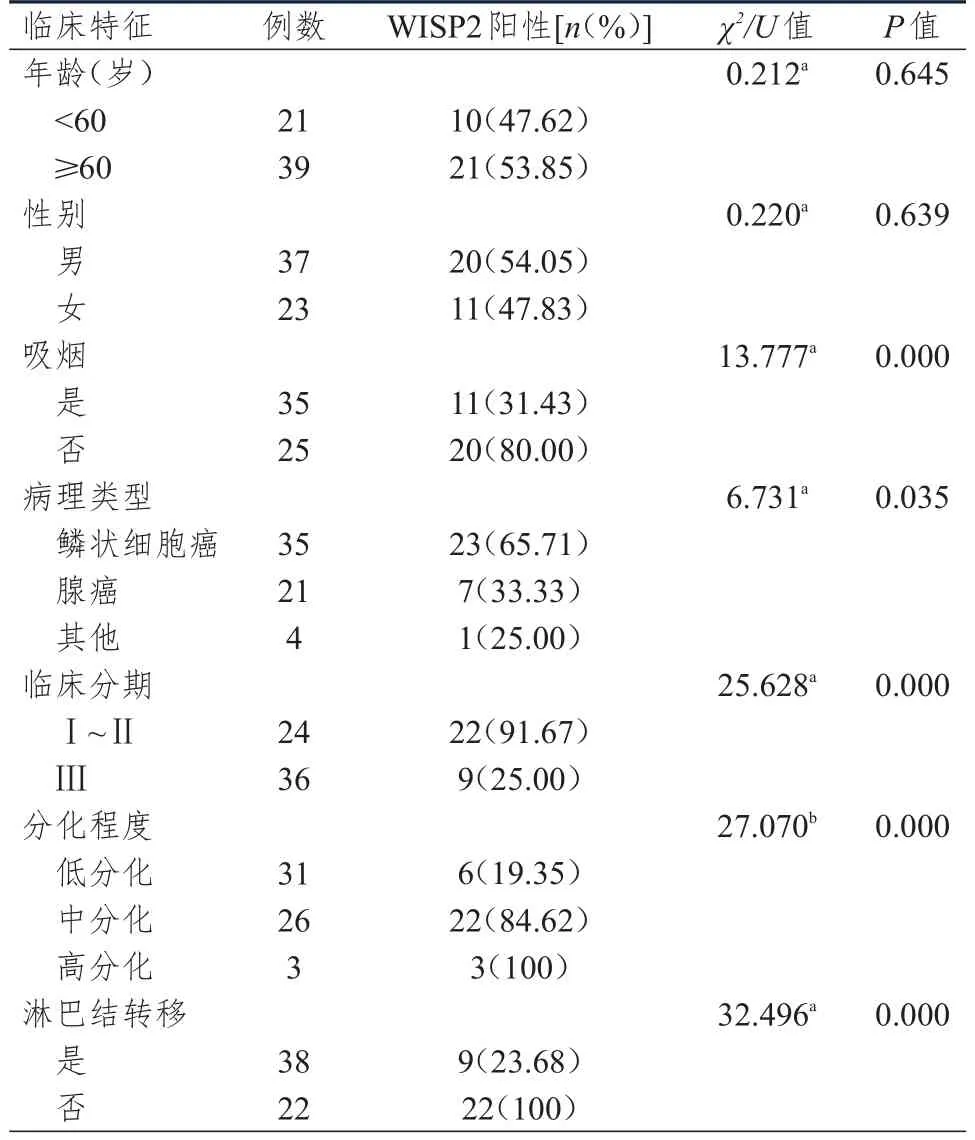
表1 不同临床特征NSCLC患者NSCLC组织中WISP 2蛋白表达情况(n=60)
表2 两组肺癌 A549细胞周期分布情况的比较(±s)
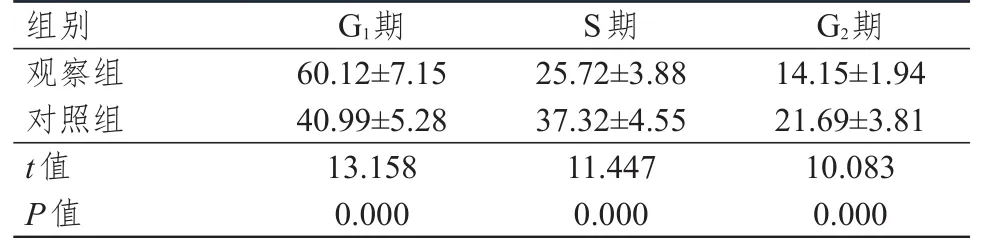
表2 两组肺癌 A549细胞周期分布情况的比较(±s)
组别G1期S期G2期观察组对照组t值P值60.12±7.15 40.99±5.28 13.158 0.000 25.72±3.88 37.32±4.55 11.447 0.000 14.15±1.94 21.69±3.81 10.083 0.000
3 讨论
相关研究显示,恶性肿瘤的发展过程由多种因素、多个步骤共同作用,正常细胞在与外界接触或自身因素的刺激下,逐渐恶性增殖、分化,最终进展为恶性肿瘤细胞[8-10]。肿瘤细胞与肿瘤基质成分可共同参与肿瘤细胞的浸润和转移过程,在此过程中,细胞表面黏附分子的改变也发挥了重要作用,与肿瘤细胞的生物学行为密切相关[10-11]。表明肿瘤细胞的形成过程较为复杂,其特异性生物学行为随肿瘤类型的不同而产生变化[12]。相关研究显示,NSCLC早期症状不明显,多数患者就诊时已处于晚期,失去了最佳的手术时机,导致肺癌患者的生存率较低、病死率较高[13-14]。因此,早期诊断NSCLC,研究其发病机制,并对其肿瘤细胞的生物学行为进行探讨,对提高NSCLC患者的生存率具有重要临床意义。相关研究显示,WISP2蛋白可抑制肺癌A549细胞的增殖[15],具有一定临床价值,本研究主要探讨WISP2在NSCLC中的表达情况及对肺癌细胞生物学行为的影响,现报道如下。
研究显示,WISP2是一种抑癌基因,可编码多种细胞外基质蛋白,调控细胞增殖、分化和凋亡过程,对骨骼、神经及血管的发育具有抑制作用[16-18]。WISP2含有28个半胱氨基酸,可参与多种重要的生物学过程。研究显示,WISP2在NSCLC的发生发展中发挥重要作用,WISP2可作为临床治疗NSCLC的重要靶蛋白[19]。临床探讨WISP2在NSCLC中的表达情况及相应的生物学行为对NSCLC的早期诊断、治疗和预防提供了理论依据[20-21]。
本研究结果显示,NSCLC组织中WISP2蛋白的阳性表达率为51.67%,低于癌旁正常组织的70.00%,差异有统计学意义(P<0.05)。推测WISP2蛋白的表达情况与NSCLC的发生发展可能有关。本研究结果显示,不同吸烟情况、病理类型、临床分期、分化程度、淋巴结转移情况NSCLC患者NSCLC组织中WISP2蛋白阳性表达率比较,差异均有统计学意义(P<0.05);观察组肺癌A549细胞G1期细胞比例明显高于对照组细胞,S期和G2期细胞比例均明显低于对照组细胞,观察组细胞的凋亡率也明显高于对照组细胞。表明WISP2可对肿瘤细胞的周期分布和凋亡进行调控,有助于NSCLC的早期诊断并对其恶性程度进行评估,为NSCLC的治疗提供参考。
综上所述,WISP2在NSCLC组织中表达水平较低,其在NSCLC的发生发展过程中发挥重要作用。

