淋巴结切除术对低危Ⅰa期子宫内膜癌患者疗效及预后的影响
张玉瑾,吴楠,张文晶
解放军陆军总医院妇产科,北京100007
子宫内膜癌在全球女性最常见癌症中居第6位,是常见的女性生殖系统恶性肿瘤之一,且发病率呈逐年上升趋势,严重威胁着女性身心健康[1]。根据Ⅰ期子宫内膜癌危险分度,可分为高危型和低危型2种,符合以下任一项即为高危型子宫内膜癌:国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)手术分期为Ⅰa期且病理分级为G3级,子宫内膜浆液性乳头状透明癌或透明细胞癌,肌层浸润深度≥1/2,肿瘤直径≥2 cm;同时满足以下条件即为低危型子宫内膜癌:FIGO手术分期为Ⅰ期,病理分级为G1或G2级,子宫内膜样腺癌,肌层浸润深度<1/2,肿瘤直径<2 cm[2-3]。目前,对于高危早期子宫内膜癌患者行全子宫+双侧附件+淋巴结切除术可改善患者的预后及生存质量已达成共识,但对于低危Ⅰa期子宫内膜癌患者是否需要进行淋巴结切除术尚存在争议。有学者认为,Ⅰ期子宫内膜癌患者盆腔淋巴结转移率约为9%,腹主动脉旁淋巴结转移率为6%~7%,术中行盆腔淋巴结切除+腹主动脉旁淋巴结切除可进一步明确分期,对术后是否行辅助治疗具有一定指导意义[2];但也有学者持不同意见,一项纳入961例子宫内膜癌患者的回顾性分析研究中包括Ⅰa期患者639例,该研究结果显示接受和未接受淋巴结切除术患者的5年生存率无明显差异[4]。对此,本研究观察淋巴结切除术对低危Ⅰa期子宫内膜癌患者疗效及预后的影响,现报道如下。
1 资料与方法
1.1 一般资料
收集2012年3月至2016年3月解放军陆军总医院收治的低危Ⅰa期子宫内膜癌患者的病历资料。纳入标准:①术前分段诊刮病理和术后病理均证实为子宫内膜癌,临床分期为Ⅰa期[5];②低危型子宫内膜癌患者,即病理组织类型为子宫内膜样腺癌,肿瘤局限于子宫体,病理分级为G1或G2级,肌层浸润深度<1/2肌层,肿瘤直径<2 cm;③术前经磁共振成像(MRI)、宫腔镜等检查显示无子宫体、宫颈间质侵犯;④自愿接受子宫全切除+双侧附件切除术,必要时联合盆腔淋巴结切除术和(或)腹主动脉旁淋巴结切除术;⑤初次手术治疗,且术前未接受放化疗、激素治疗等;⑥未合并远处转移或其他恶性肿瘤;⑦临床资料及随访资料完整。排除标准:①合并卵巢、输卵管及其他子宫内膜相关肿瘤;②同时诊断存在其他恶性肿瘤;③合并心肺功能异常、凝血功能障碍、血液系统疾病等。根据纳入、排除标准,共纳入80例低危Ⅰa期子宫内膜癌患者,按术中是否进行系统性淋巴结切除术分为切除组(48例)和未切除组(32例),两组患者临床特征比较,差异均无统计学意义(P>0.05)(表1),具有可比性。

表1 两组患者的临床特征
1.2 手术方法
所有患者均接受全子宫切除+双侧附件切除术,均由同一经验丰富的医师进行手术操作。未切除组32例患者仅行全子宫切除+双侧附件切除术,切除组48例患者行全子宫切除+双侧附件切除+盆腔淋巴结和腹主动脉旁淋巴结切除术。所有患者术后均仅随访观察,未给予术后辅助治疗。
1.3 观察指标
记录两组患者手术时间、术中出血量、尿管留置时间、住院时间及下肢血栓性静脉炎、输尿管损伤、肠梗阻、淋巴囊肿形成、下肢淋巴水肿等术后并发症发生情况。比较手术前后两组患者血清肿瘤标志物糖类抗原125(carbohydrate antigen 125,CA125)水平,采用全自动免疫发光检测仪检测,试剂盒由美国雅培公司生产。
1.4 随访
术后采用门诊、电话方式进行随访,术后2年内,妇科检查、血清肿瘤标志物CA125检测、盆腔彩超每3个月1次,MRI或X线胸片检查每6个月1次;术后3~5年,妇科检查、血清肿瘤标志物CA125检测、盆腔彩超每6个月1次,MRI或X线胸片检查每1年1次。随访截止日期为2018年5月,随访24~56个月。统计两组患者的无进展生存率和总生存率。无进展生存期:随机化开始至疾病复发或由于疾病进展导致患者死亡的时间;总生存期:随机化开始至因任何原因引起死亡的时间。
1.5 统计学分析
采用SPSS 18.0统计软件进行数据分析,计数资料以例数及率(%)表示,组间比较采用χ2检验;计量资料以均数±标准差(±s)表示,两组比较采用配对t检验,组内不同时间点比较采用重复测量方差分析,组内不同时间点两两比较采用Bonferroni检验;采用Log-rank法比较生存情况;以P<0.05为差异有统计学意义。
2 结果
2.1 手术情况及术后恢复情况的比较
切除组患者手术时间、尿管留置时间、住院时间均明显长于未切除组,术中出血量明显多于未切除组,差异均有统计学意义(P<0.01)。(表2)
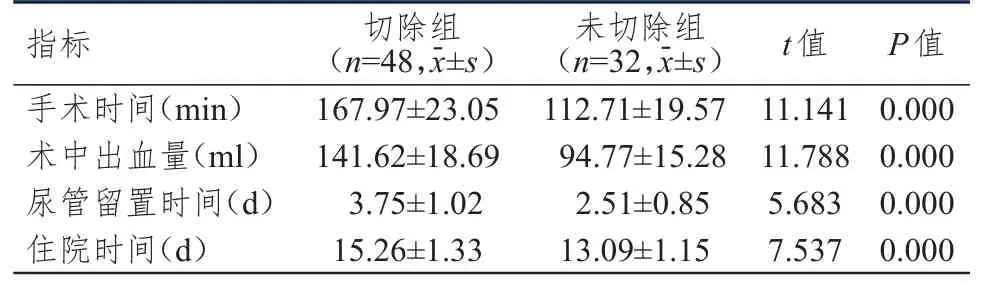
表2 两组患者手术情况及术后恢复情况的比较
2.2 术后并发症发生情况的比较
切除组患者术后并发症总发生率为22.92%(11/48),高于未切除组的6.25%(2/32),差异有统计学意义(χ2=3.919,P<0.05)。(表3)
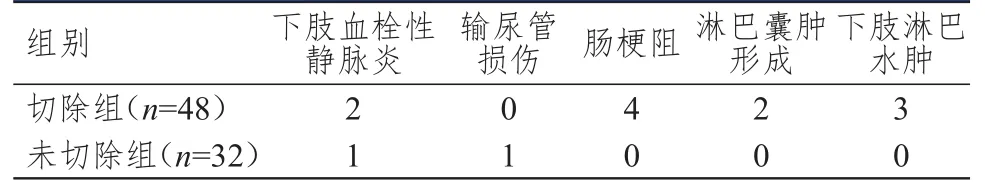
表3 两组患者术后并发症发生情况
2.3 手术前后CA125水平的比较
术前、术后7天、术后2年,两组患者血清CA125水平比较,差异均无统计学意义(P>0.05);术后7天、术后2年,两组患者血清CA125水平均低于本组术前,差异均有统计学意义(P<0.05)。(表4)
表4 两组患者手术前后CA125水平的比较(U/ml,±s)
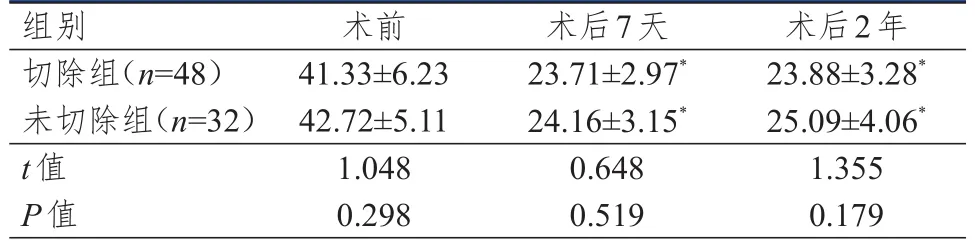
表4 两组患者手术前后CA125水平的比较(U/ml,±s)
注:*与本组术前比较,P<0.05
组别切除组(n=48)未切除组(n=32)t值P值术前41.33±6.23 42.72±5.11 1.048 0.298术后7天23.71±2.97*24.16±3.15*0.648 0.519术后2年23.88±3.28*25.09±4.06*1.355 0.179
2.4 生存情况的比较
术后2年,切除组无复发或死亡患者,2年无进展生存率和总生存率均为100%;未切除组中2例复发,复发部位包括盆腔(1例)、直肠(1例),其中1例于术后22个月化疗无效死亡,另1例于术后18个月复发经放化疗治疗后生存至今,2年无进展生存率为93.75%(30/32),2年总生存率为96.88%(31/32);两组患者2年无进展生存率和总生存率比较,差异均无统计学意义(P>0.05)。
3 讨论
有报道显示,子宫内膜癌预后与临床分期密切相关,Ⅰ~Ⅱ期子宫内膜癌患者5年生存率高达88.1%,Ⅲ~Ⅳ期患者给予手术及综合治疗后远期预后较差,5年生存率仅为30%左右[6]。子宫内膜癌早期存在不规则阴道出血、异常阴道排液等症状,75%左右的患者在肿瘤病变局限于子宫内时就诊,早期手术的预后较好[7]。
1988年FIGO采用手术病理分期将淋巴结转移和肌层浸润深度纳入分期依据以来,为执行该分期,2006年以前的美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南要求对所有Ⅰ期患者均进行系统性淋巴结清扫,随着临床诊治的深入,子宫内膜癌临床分期不断变化,术式也不断发生改变[8]。2016年NCCN建议Ⅰ期子宫内膜癌患者的手术方案为全子宫+双侧附件切除,对于合并高危因素的患者,则术中同时切除盆腔及腹主动脉旁淋巴结,而低危子宫内膜癌患者未推荐包括盆腔及腹主动脉旁淋巴结切除的全面分期手术[9]。有学者认为,盆腔和腹主动脉旁淋巴结切除可提供准确的分期依据,Ⅰ期子宫内膜癌不行淋巴结切除,可能造成手术病理分期漏诊,影响术后辅助治疗,进而增加疾病的复发率和远处转移率[10]。而另一些学者认为,低危Ⅰa期子宫内膜癌患者行淋巴结切除并未使患者生存获益[11]。王新宇[12]指出,低危Ⅰa型子宫内膜癌病变相对局限,术后发现或真正出现淋巴结转移的概率较低(2%~5%),行淋巴结切除术可能存在过度治疗的现象,会加重患者经济负担。
本研究选择低危Ⅰa期子宫内膜癌患者,探讨是否行淋巴结切除术对患者疗效及预后的影响,发现未切除组患者手术时间明显短于切除组,术中出血量明显少于切除组,且术后恢复时间明显短于切除组,结果表明低危Ⅰa期子宫内膜癌术中行系统性淋巴结切除会增加手术创伤,延长术后恢复时间。在并发症方面,未切除组患者的并发症总发生率低于切除组(P<0.05),说明低危Ⅰa期子宫内膜癌行系统性淋巴结切除会提高术后并发症发生率。Zahl等[13]指出,系统性淋巴结切除会提高术后并发症发生率。Biglia等[14]研究指出,因妇科肿瘤行系统性淋巴结切除术患者下肢水肿发生率为36%左右。蒋芳和向阳[15]研究报道,盆腔及腹主动脉旁淋巴结切除可造成输尿管损伤、下肢淋巴水肿、淋巴囊肿形成。
CA125是一种糖蛋白性肿瘤相关抗原,广泛存在于体腔上皮起源的各种组织中,子宫内膜癌、卵巢癌、宫颈癌患者均会伴随血清CA125水平升高。Aivazian 等[16]指出,以 CA125≥35 U/ml为阳性,其中G1级子宫内膜癌患者CA125阳性率为20%左右,随着病理分级升高,肿瘤负荷程度增加,CA125阳性率也随之升高,除此之外,其也与肿瘤分期、肌层浸润深度、宫颈浸润程度、淋巴结转移有关。既往研究指出,血清CA125水平对恶性肿瘤患者淋巴结转移有一定预测价值[17]。李华等[18]指出,CA125水平升高对术后淋巴结转移有一定预测价值(OR=3.46,95%CI=1.59~7.67)。故本研究对低危Ⅰa期子宫内膜癌患者的CA125水平进行随访分析,发现两组患者术前、术后7天、术后2年的CA125水平比较,差异均无统计学意义(P>0.05),说明低危Ⅰa期子宫内膜癌是否系统行淋巴结切除对随访期间CA125水平无明显影响,可能与术后淋巴结转移率低有一定关系。本研究中两组患者2年无进展生存率和总生存率也证实了这一点。魏丽惠等[19]针对子宫内膜癌腹主动脉旁淋巴结切除的相关问题进行讨论,认为低危Ⅰ期子宫内膜癌患者切除淋巴结后对预后无明显改善作用。
综上所述,与全子宫切除+双侧附件切除术相比,行全子宫+双侧附件+盆腔淋巴结+腹主动脉旁淋巴结切除术的低危Ⅰa期子宫内膜癌患者术中出血量增加,术后恢复时间延长,并发症发生率提高,但不会进一步提高2年无进展生存率和总生存率。本文为回顾性分析,且纳入病例数较少,有待扩大样本量,进行大范围、多中心、前瞻性研究,提高研究结果的客观性。

