不同肥胖类型患者血清代谢指标与内脏脂肪指数的相关性分析 *
毛维维,伊桂叶
(上海市第一康复医院内分泌与肾脏功能代谢科,上海 200090)
肥胖作为一种慢性代谢性疾病,近年来在我国的患病率呈明显上升趋势,现已证实是糖尿病、高血压及冠心病等心血管疾病的独立危险因素[1]。最近有研究表明,不同肥胖类型患者的机体炎症状态与代谢异常程度不一,导致预后存在一定差异,其中中心型肥胖(即腹型肥胖)与代谢异常的关系尤为密切,该领域也愈发引起学者的关注[2-3]。体质量指数(body mass index,BMI)、腰围(waist circumference,WC)及腰臀比(waist-to-hip ratio,WHR)等均是以往反映肥胖情况常用指标,但均存在局限性。内脏脂肪指数(visceral adiposity index,VAI)是一种综合BMI,WC,WHR及血脂等的新型指标,能够全面反映内脏脂肪分布及功能,但其与代谢指标的关系研究仍鲜有报道[4]。本研究拟通过检测不同肥胖类型患者的血脂、尿酸等代谢指标,探讨其VAI的相关性,为肥胖的早期干预提供参考依据。
1 材料与方法
1.1 研究对象 回顾性分析2017年1~12月在上海市第一康复医院内分泌科接受治疗的肥胖患者,共110例。入组标准:①均符合2006年原卫生部颁布的《中国成人超重和肥胖症预防控制指南》[5]中的肥胖诊断及标准;②年龄≥18岁;③排除免疫性疾病、恶性肿瘤、严重心肝肾等重要器官功能障碍。其中男性58例,女性52例;年龄18~68岁,平均年龄48.5±5.3岁;同时选择本院同期健康体检者50例作为对照组,男性25例,女性25例,年龄18~70岁,平均年龄41.7±4.8岁。两组研究对象在年龄、性别等基本资料方面比较,差异均无统计学意义(P>0.05)。
1.2 试剂和仪器 固定身高尺、数字式体重计、罗氏Cobas c 311全自动生化分析仪及配套试剂盒。
1.3 方法
1.3.1 体格检查:测量所有研究对象的身高、体重、WC等指标;BMI(kg/m2)=体重/身高2。调查前均对医务人员进行严格培训,统一方法、标准,并进行现场督导和质控。按照《中国成人超重和肥胖症预防控制指南》标准,依据BMI诊断肥胖,其中正常为18.5~23.9 kg/m2,超重为24.0~27.9 kg/m2,肥胖为≥28.0 kg/m2。按照《成人体重判定》(WS/T428-2013)[7]判定中心性肥胖。腰围男性≥90 cm,女性≥85 cm诊断为中心性肥胖。中心性肥胖74例,非中心性肥胖36例。
1.3.2 代谢指标检测:抽取所有对象的空腹静脉血5 ml,3 000 r/min高速离心10 min,离心半径8 cm,取上层血清置于-20℃保存备检。采用全自动生化分析仪及配套试剂盒进行检测,血糖指标包括空腹血糖(fasting plasma glucose,FPG)、餐后2 h血糖(2h postprandial blood glucose,2h PG),血脂指标包括总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein,LDL-C)和血尿酸(uric acid,UA)。所有操作均严格按照说明书严格执行。
1.3.3 VAI计算:计算公式为[6]:

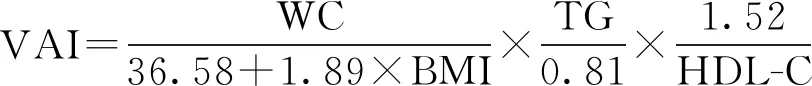
1.4 统计学分析 采用EXCEL 2003,SPSS 18.0版软件包进行整理和统计分析。计量资料比较采用单因素方差分析或t检验,采用Spearman秩相关和多元线性回归分析进行相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 不同肥胖类型和对照组各代谢指标比较 见表1。 与非中心性肥胖组比较,中心性肥胖组WC,TG,TC,LDL-C,FPG,2h PG,UA及VAL水平明显升高,HDL-C明显降低,差异均有统计学意义(均P<0.05)。
2.2 VAI与各代谢指标之间的相关性 见表2。Spearman秩相关显示,中心性肥胖患者VAI与BMI,WC,血糖、血脂及UA呈显著正相关(均P<0.05);非中心性肥胖患者VAI与BMI,WC及TC呈显著正相关,与HDL-C呈显著负相关(均P<0.05)。
2.3 VAI影响因素的多元线性回归分析 见表3。以VAI为因变量,将BMI,WC及各代谢指标作为自变量,引入多元线性回归分析,结果显示,WC,TG,肥胖类型(中心性),UA是VAI的危险因素,HDL-C则是保护因素(P<0.05)。

表1 不同肥胖类型和对照组各代谢指标比较
注:t1,P1非中心性肥胖组与对照组比较;t2,P2中心性肥胖组与对照组比较;t3,P3中心性肥胖组与非中心性肥胖组比较。
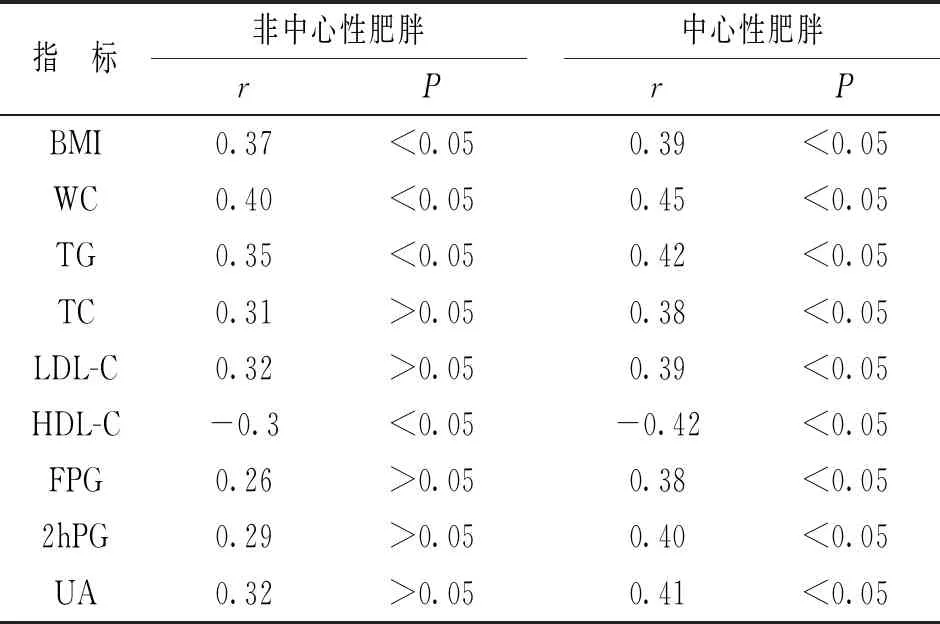
表2 VAI与各代谢指标之间的相关性
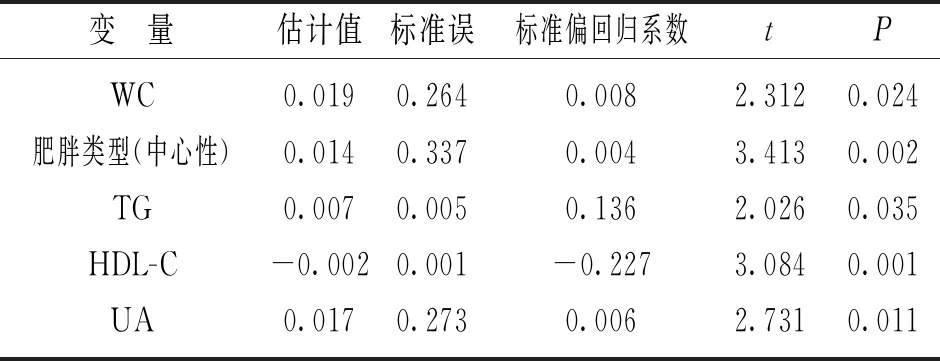
表3 VAI影响因素的多元线性回归分析
3 讨论
肥胖患者多并发血糖、血脂等代谢功能紊乱,多个研究指出脂肪分布位置与心血管代谢异常具有一定相关性,肥胖患者发展为糖尿病的重要原因并非皮下脂肪,而是内脏脂肪过度蓄积[8]。与脂肪蓄积量相比,脂肪分布位置对代谢的影响更大,内脏脂肪组织可通过IL-6,TNF-α和脂联素等脂肪细胞因子促进代谢综合征的发生、发展,进而诱发心血管疾病[9]。BMI,WC是评价肥胖的人体测量学指标,但不同肥胖类型代谢指标之间差别不大[10]。CT,MRI被视为评价腹型肥胖的金标准,能够定量测量内脏脂肪的分布与含量,但费用与辐射损伤均限制了其临床应用。因此,探寻一种敏感的内脏脂肪指标,分析其与不同肥胖类型患者代谢指标的关系具有重要的临床意义。
与BMI,WC等传统体脂指标比较,VAI不仅是内脏脂肪功能、胰岛素抵抗的间接反映指标,还可反映脂肪细胞因子、游离脂肪酸水平等非典型的危险因素的变化。研究报道称,VAI增高对于亚临床动脉粥样硬化、心血管疾病的风险预测具有重要临床价值[11],但亦有研究持不同观点,认为VAI对心血管疾病的预测能力与BMI,WC等指标无明显差异[12]。本研究结果显示,肥胖患者的代谢指标异常情况较正常人群明显增多,且不同肥胖类型患者之间存在明显差异,中心性肥胖患者血糖、血脂、血UA及VAI明显升高,进一步说明中心性肥胖患者与代谢异常的关系更为密切,脂肪的分布位置与内脏脂肪的蓄积程度在心血管疾病、代谢性疾病的发生、发展进程中发挥重要作用,考虑其可能原因是此类人群因内脏脂肪过度蓄积,IL-6,TNF-α等促炎因子分泌增多,抗炎因子降低,从而造成代谢紊乱及胰岛素抵抗的发生[13]。
相关性分析显示,中心性肥胖患者VAI与BMI,WC等传统指标、血糖、血脂及UA等代谢指标呈显著相关(P<0.05),密切程度明显大于非中心性肥胖患者,同时多因素分析发现,WC,TG,肥胖类型(中心性)、UA是VAI的危险因素,HDL-C则是保护因素(P<0.05),进一步说明中心性肥胖患者VAI可在一定程度上反映代谢性疾病的风险。ALDAGHRI等[14]研究认为,与低指数组(VAI 0.4~1.6)比较,中指数组(VAI 1.7~3.4)、高指数组(VAI>3.4)BMI,血压、血脂及代谢综合征的患病率均明显升高,与WC,WHR等其他腹型肥胖指标的变化趋势基本一致。李庆等[15]对WC,血糖、血压、血脂、VAI进行ROC曲线分析,发现VAI诊断代谢综合征的AUC最大,由此推测其对代谢异常的诊断能力明显强于其他指标。
综上所述,中心性肥胖较非中心性肥胖患者更容易出现代谢功能异常,VAI与代谢指标密切相关,可反映不同类型肥胖患者代谢状态,且测量方法简单易行,适用于大规模筛查。

