替格瑞洛对STEMI患者PCI术后近期动脉血管内皮细胞功能的影响
安玉英,张风林,卓凤巧,王秋芬
0 引言
经皮冠状动脉介入(Percutaneous coronary interventions,PCI)是急性冠脉综合征(Acute coronary syndromes,ACS)患者最主要的一线治疗手段,旨在促使梗死相关动脉再通,恢复心肌灌注[1]。但急诊PCI术具有慢血流和无复流风险[2],是导致患者左心室功能下降、治疗失败的主要原因。目前在我国双联抗血小板药物对于ACS和(或)行PCI术的患者具有不可取代的地位。由于氯吡格雷代谢反应弱、起效慢、易受遗传因素干扰等,所以,并不建议部分患者选择氯吡格雷治疗[3]。替格瑞洛作为一类新型可逆的ADP受体P2Y12抑制剂,可快速阻断ADP途径,抑制血小板聚集[4-6],但是其作用机制和治疗优势并不完全明确。快速血运重建、抗血小板聚集以及恢复内皮功能是目前ACS的三大核心治疗原则[7]。内皮功能障碍是导致管壁炎症、脂质浸润和血管弹性降低的起始和焦点环节,在心血管事件的发生和发展过程中发挥着关键作用[8],因此在开通急性闭塞冠脉的前提下改善血管内皮细胞的功能与抗血小板抗血栓治疗同样重要。本研究拟通过比较替格瑞洛和氯吡格雷两大不同类型P2Y12抑制剂对ST段抬高型心肌梗死(ST-elevation myocardial infarction,STEMI)患者行PCI术后近期动脉血管内皮细胞功能的影响,探讨替格瑞洛对内皮损伤修复的作用机制,为临床治疗提供更多的证据支持。
1 资料和方法
1.1 研究对象 选取2015年1月至2017年5月期间在我院成功完成急诊PCI术的患者128例。按数字表法分为替格瑞洛组(T组,68例)和氯吡格雷组(C组,60例),其中男87例,女41例,年龄42~80岁,平均年龄(64.82±12.68)岁。详细记录所有受试者的一般临床资料。该实验的所有过程均遵从赫尔辛基宣言标准,报经医院伦理委员会审核通过,并告知患者及其家属实验过程中可能承担的一切风险与获益,获得患者或患者家属的知情同意,并且声明患者可自由退出研究,并不妨碍其进一步治疗。入选标准:①由2位介入专家进行冠状动脉造影(Coronary angiography,CAG),确诊为ACS,并符合《急性ST段抬高型心肌梗死诊断和治疗指南》[9]关于STEMI的诊断标准;②冠状动脉造影显示左冠状动脉的左前降支、右回旋支、右冠状动脉及其主要分支中至少有1支血管腔狭窄程度≥50%,符合PCI指征;③发病(持续性胸痛)至急诊PCI术时间≤12 h,首次发病。排除标准:①长期服用免疫抑制剂或P2Y12抑制剂者;②治疗前出现严重的意识障碍、心力衰竭、伴有严重的肝肾功能不全、恶性肿瘤、血液系统疾病、急慢性感染或伴有严重出血倾向者;③除STEMI以外的其他严重的心血管类疾病患者;④对氯吡格雷或替格瑞洛有禁忌证者。
1.2 方法
1.2.1 CAG 由2位介入专家进行操作。患者在检查前,适度放松手腕,自桡骨茎突上2 cm处进行穿刺,经鞘管注射3 000~6 000 U肝素,对左右冠状动脉进行全方位拍片检查,采用DSA图像处理系统定量分析冠状动脉病变支数和狭窄程度。
1.2.2 治疗 所有患者视自身病情PCI术后规律给予抗血小板药物,未服用过阿司匹林的患者术前给予阿司匹林肠溶片(沈阳奥吉娜药业有限公司,国药准字H20065051)负荷剂量300 mg,已服用过阿司匹林的患者口服100~300 mg,qd。C组患者给予氯吡格雷片(赛诺菲杭州有限公司,国药准字:J20130083)负荷剂量300 mg嚼服,随后75 mg、qd维持治疗。T组患者给予替格瑞洛片(阿斯利康医药公司,国药准字J20171077)负荷剂量180 mg嚼服,随后90 mg、qd维持治疗。持续用药12个月。定期对两组患者给予血压、血脂及心电图等临床检查以及相应的临床护理。
1.3 随访 患者出院后每月复诊1次,记录该月用药情况,并进行常规体格检查。于治疗前及用药后1、3、6、12个月时分别进行肱动脉超声检查。两组患者治疗前及治疗后1、3、6、12个月时,采用T3000型超声检测仪测定血流介导的肱动脉内皮依赖性舒张(Flow-mediated dilation,FMD)和硝酸甘油介导的非内皮依赖性血管舒张(Nitroglycerin-mediated dilation,NMD)反应变化率;采用ELISA试剂盒检测患者一氧化氮(Nitric oxide,NO)、血清细胞间黏附因子(Serum intercellular cell adhesion molecule-1,sICAM-1)、血管性假性血友病因子(von willebrand factor,vWF)水平。
1.4 观察指标
1.4.1 血液样本集 两组患者入院后立即采集外周静脉全血5 ml置于肝素钠真空采血管(美国BD公司)中,4 ℃静置30 min,3 000 r/min离心5 min,离心半径为10 cm;取上清,标记好后置于-80 ℃低温保存。所有检验均由本院检验科完成。
1.4.2 肱动脉超声 肱动脉超声需要患者在PCI术后基本脱离危险期后采用Terason T3000型超声仪检测,并且在受测前24 h暂停血管活性药物(包括β受体阻滞剂、硝酸酯类、钙拮抗剂、血管紧张素转化酶抑制剂等),探头频率5~12 mHz,并同步记录心电图。患者取仰卧位,用二维超声成像显示肘横纹至肘上2~5 cm处的肱动脉纵切面。在血管舒张末期(即同步ECG显示R波时)测量肱动脉前后内膜之间的距离,计算%FMD。间隔10 min后,给予舌下含服硝酸甘油0.5 mg,测定肱动脉内径,计算%NMD。
1.4.3 NO检测 采用Griess比色法检测NO浓度。K412-500型一氧化氮比色分析试剂盒购自美国Biovision公司。
1.4.4 sICAM-1和vWF检测 采用双抗体夹心酶联免疫吸附测定法检测sICAM-1和vWF水平。试剂盒购自上海康朗生物科技有限公司。
1.4.5 血清学指标检测 采用DXC800全自动生化分析仪(美国Beckman公司)检测所有患者术前总胆固醇(Total cholesterol,TC)、三酰甘油(Triglyceride,TG)、丙氨酸氨基转移酶(Alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(Aspartate aminotransferase,AST)、尿素氮(Blood urea nitrogen,BUN)、血清肌酐(Serum creatinine,SCr)等。另外,采用Cobas H232型心肌标志物床旁快速检测仪检测心肌肌钙蛋白(Cardiac troponin I,cTnI)。
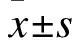
2 结果
2.1 两组患者一般临床资料比较 两组患者年龄、性别组成、体重指数(Body mass index,BMI)、风险因素、术前血清学指标、NYHA心功能分级情况比较,差异无统计学意义(P>0.05)。提示两组患者具有可比性。见表1。
2.2 两组患者%FMD和%NMD比较 术前,两组患者经肱动脉超声检查的各项指标比较,差异无统计学意义(P>0.05)。而经重复测量的方差分析结果表明,术前及术后1、3、6、12个月患者静息血流速度和%FMD比较差异有统计学意义[静息血流速度:F(3,316)=44.81,P<0.001;%FMD:F(3,316)=28.55,P<0.001]。排除时间因素,T组患者静息血流速度和%FMD高于C组,差异有统计学意义[静息血流速度:F(1,316)=21.91,P<0.001;%FMD:F(1,316)=8.50,P<0.05]。治疗时间与组别之间存在交互作用[静息血流速度:F(3,316)=12.84,P<0.05;%FMD:F(3,316)=3.75,P<0.05]。尤其是术后3个月后,T组患者静息血流速度和%FMD均高于C组,差异有统计学意义(P<0.05)。见表2。

表1 两组患者基本临床资料比较(例,%)
2.3 两组患者血清NO、sICAM-1和vWF比较 术前,两组患者NO、sICAM-1、vWF水平比较,差异无统计学意义(P>0.05)。而经重复测量的方差分析结果表明,术前及术后1、3、6、12个月患者NO、sICAM-1、vWF水平比较差异有统计学意义[NO:F(3,316)=46.97,P<0.001;sICAM-1:F(3,316)=79.89,P<0.001;vWF:F(3,316)=115.60,P<0.001]。排除时间因素,T组患者NO水平高于C组,差异有统计学意义[NO:F(1,316)=10.85,P<0.05;sICAM-1:F(1,316)=18.97,P<0.001;vWF:F(1,316)=65.73,P<0.001]。治疗时间与组别之间存在交互作用[NO:F(3,316)=6.67,P<0.05;sICAM-1:F(3,316)=9.95,P<0.05;vWF:F(3,316)=20.24,P<0.001]。术后1、6个月时,T组患者NO、sICAM-1、vWF水平与C组比较差异均有统计学意义(P<0.05)。另外,术后12个月时,T组和C组患者NO、sICAM-1水平比较,差异无统计学意义,但T组vWF水平低于C组,差异有统计学意义(P<0.05)。见表3。

表2 两组患者肱动脉超声检查结果比较
3 讨论
急性心肌梗死是目前临床上死亡率较高的危急重症之一,包括不稳定型心绞痛、STEMI和非ST段抬高型心肌梗死。患者表现出心肌缺血症状且心电图至少2个相邻导联ST段持续升高则可诊断为STEMI。STEMI的基本病理生理机制是动脉粥样硬化不稳定斑块破裂、表面受侵蚀的斑块逐渐增多、斑块内自发性或继发性出血等,迅速形成血栓,最终导致冠脉部分或完全急性堵塞[10]。而血管内皮功能障碍是上述各个环节的始动因素。抗血小板治疗是ACS患者尤其是行急诊PCI术的患者综合治疗方案中不可或缺的组成部分。PCI术后内皮功能障碍仍然存在,再加上机体对支架的免疫排斥反应,导致局部炎症反应持续增强,血小板持续活化,易引发支架内再狭窄以及再发心肌梗死等[11]。而P2Y12受体激活在血小板活化过程中发挥着关键作用[12]。因此,血小板P2Y12受体拮抗剂是目前临床应用最广泛的抗血小板药物之一。替格瑞洛和氯吡格雷是2种不同类型的P2Y12受体抑制剂。氯吡格雷本身并不具有生物活性,需要经细胞色素P450酶系转化后形成抗血小板聚集的代谢物质。替格瑞洛可以迅速阻断血小板P2Y12受体的活性,不受CYP2C19等代谢基因的影响[13-15]。相较于氯吡格雷,替格瑞洛起效快、干扰因素少,患者临床获益更理想。有学者提出,替格瑞洛有望成为更理想的治疗药物[16],但是相关证据并不充分,部分学者对于替格瑞洛和氯吡格雷的作用比较存有争议[17]。

表3 两组患者NO、sICAM-1、vWF水平比较
内皮细胞作为保护冠脉血管的第一道防线,其结构完整性和功能稳定性是冠脉血管正常的前提和保障。在本项研究中,静息状态下外周血管扩张增加血流量并不依赖于扩血管物质,而是通过肱动脉短暂性缺血诱发充血性反应所致,属于机体自我保护机制。替格瑞洛和氯吡格雷两组患者基线血流速度一致,而且对%FMD和静息血流速度都有明显改善作用,但是替格瑞洛的作用更明显。而两种药物对于%NMD的影响不突出。FMD是血管在某些内源性或外源性刺激下释放NO等物质引发血管舒张;NMD是依赖药物提供外源性NO导致血管舒张的反应,并不能反映血管内皮功能的恢复情况。NO属于典型的舒血管物质,生物学效应复杂,可促使局部炎性因子分泌,对抗低密度脂蛋白-胆固醇的氧化作用,并且与细胞黏附能力的降低有关[18]。在本研究中,PCI术前,两组患者NO水平均不高,而治疗1个月后,替格瑞洛可明显增加血液中NO水平,说明内皮细胞分泌扩血管物质能力增强。而氯吡格雷组NO水平变化不明显,可能与部分患者对氯吡格雷无反应或反应较弱有关。
除此之外,ICAM-1和vWF也是公认的反映血管内皮功能的重要指标[19]。ICAM-1分布于多种炎性细胞、血管内皮细胞表面,可介导血管内皮细胞与淋巴细胞、单核细胞以及血管内皮细胞之间的黏附作用。正常情况下,血清中ICAM-1的含量极低,只有受到炎症因子的刺激时才会大量分泌。替格瑞洛组术后1个月sICAM-1水平明显低于氯吡格雷组,但是术后1年,氯吡格雷组患者NO和sICAM-1水平与替格瑞洛组基本趋于一致,说明替格瑞洛可迅速改善患者PCI术后内皮功能障碍,短期内对NO和sICAM-1等因子的调控作用更加明显,但是从长期来看,两者都可以促进NO等血管活性物质的合成,减少ICAM-1等炎性因子的分泌[20]。另外,在某些炎性介质的影响下,血小板也具有释放vWF的作用。有研究显示,STEMI患者急性发作时血清vWF迅速升高,且与患者预后有关[21]。PCI术后患者vWF水平会出现一个小高峰,这可能与支架导致机体排斥反应有关。但是术后1个月时,替格瑞洛组vWF水平明显低于术前和氯吡格雷组,说明替格瑞洛可在术后迅速恢复冠脉血流量,降低局部缺血刺激和炎症刺激对内皮功能的影响,并且对vWF的作用一直持续到术后1年,优于氯吡格雷。替格瑞洛可能具有直接保护细胞内皮的作用[22]。
综上所述,本项研究证实,替格瑞洛和氯吡格雷对STEMI患者行急诊PCI术后内皮功能障碍都有一定的改善作用,但是替格瑞洛在短期改善NO、sICAM-1、vWF、FMD方面效果更理想。随着治疗时间的延长,替格瑞洛在改善内皮损伤方面的优势可能逐渐减弱。替格瑞洛在我国上市时间短,相关研究尚少,本项研究为替格瑞洛的临床治疗提供了一定的证据支持。

