腹腔镜下保脾治疗胰体尾部良、交界性病变的临床研究
陈垚宇,史俊芬,王 喆,张 强
(内蒙古医科大学附属医院,内蒙古 呼和浩特,010000)
胰腺位于腹上区及左季肋区,居胃与腹膜后方,分头、颈、体、尾4部分。其体尾部隔小网膜囊与胃后壁相邻,传统开腹手术需打开多层结构、韧带才能到达胰腺体尾部进行切除,而且其供血与脾脏关系复杂,既往在胰腺体尾部良性、交界性病变的外科手术治疗上主张联合脾脏一并切除。近年,随着对脾脏功能的深入了解及脾切除术后并发症报道的增多,越来越多的人意识到保留脾脏的重要性,并对保留脾脏胰体尾切除术作出推广。而且由于微创观念、技术的进一步普及,腹腔镜下保留脾脏胰体尾部切除术及腹腔镜下不保留脾脏胰体尾部切除术陆续开展。本文回顾性分析腹腔镜手术与传统开腹手术,以及保脾与切脾情况下的相关临床指标、术后恢复情况、术后并发症等,探讨腹腔镜手术在胰腺良、交界性病变中的应用价值及保留脾脏的意义。
1 资料与方法
1.1 临床资料 2010~2018年内蒙古医科大学附属第一医院行胰体尾切除术34例,手术方式分别为腹腔镜下保留脾脏胰体尾切除术(A组,n=8)、腹腔镜下不保留脾脏胰体尾切除术(B组,n=8)、保留脾脏胰体尾切除术(C组,n=8)与不保留脾脏胰体尾切除术(D组,n=10)。平均(50.05±8.26)岁,14例患者有腹部或腰背部疼痛,2例伴低血糖,6例因皮肤巩膜黄染入院,3例近期体重明显下降,9例无明显不适均在体检时发现。患者术前通过腹部彩超、CT或MRI检查排除恶性肿瘤,且胰腺周围无明显粘连、浸润,远处淋巴结未见转移。
1.2 手术方法 本文仅简述腹腔镜胰体尾切除术的方法。采用全身麻醉,患者取头高足低位,双腿适当分开。主刀立于患者右侧,助手立于患者左侧。脐下做10 mm弧形切口,常规建立气腹,压力维持在14 mmHg,置入腹腔镜探查。分别于右锁骨中线平脐偏上方及左侧对称位置穿刺12 mm、5 mm Trocar,作为主操作孔、辅助操作孔;分别于右腋前线肋缘下及左侧对称位置穿刺5 mm Trocar,作为助手操作孔。按顺序探查肝脏、腹膜、胃肠等器官,排除肿瘤转移情况。用超声刀离断胃结肠韧带,游离胃大弯,小心保留胃网膜左血管及胃短血管,充分显露胰腺体尾部。仔细探查胰腺肿物位置、大小及毗邻关系。游离胰腺下缘,充分显露肠系膜上静脉、脾静脉及门静脉。在脾静脉前方游离胰后间隙,建立胰后隧道,导尿管悬吊胰腺,然后用Endo-GIA切割器横向穿过离断胰腺,提起胰腺远端,仔细分离脾动静脉与胰腺的间隙,并根据胰体尾病变与脾动、静脉的粘连情况,选择保留脾动、静脉(Kimura法)或不保留脾动、静脉(Warshaw法),(1)保留脾动、静脉(Kimura法),见图1:当脾动、静脉可完整解剖游离时,将汇入胰腺的脾动、静脉分支分别夹闭或用超声刀离断,直至完全切除胰体尾及肿物。(2)不保留脾动、静脉(Warshaw法),见图2~图5:如果胰体尾或病灶处与脾动静脉粘连致密,难以分离,直接剥离脾动静脉主干容易导致其管壁破裂出血。此时,应夹闭离断脾血管,然后用抓钳提起胰体尾与肿瘤,沿胰腺及脾动静脉后方向脾门处分离血管,应注意远离脾门离断脾血管,完全保留胃短血管、胃网膜左血管,否则影响脾脏血供。观察脾脏颜色变化,如果血供良好则保留脾脏,反之则切除脾脏。两种方法均于取出标本后,确切止血、冲洗、留置腹腔引流管。不保留脾脏胰体尾切除亦采取相同方法,但先结扎脾动、静脉,然后切除胰体尾、脾脏。不论哪种术式,术后均留置引流管,如果术后引流液中淀粉酶明显增多,需警惕胰瘘的发生。开腹不保留脾脏胰体尾切除术中脾静脉的处理见图6、图7。
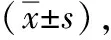
2 结 果
在保脾情况下,A组手术时间较C组长(P<0.05),但术中出血、术后并发症少,术后康复快(P<0.05),见表1。在不保留脾脏的情况下,B组较D组术中出血量、术后并发症少(P<0.05),但两组手术时间、术后恢复指标差异无统计学意义(P>0.05),见表2。在使用腹腔镜的情况下,A、B两组手术时间、术后恢复指标差异无统计学意义(P>0.05),但A组术后并发症更少(P<0.05),见表3。在开腹手术的情况下,C、D两组手术时间、术后恢复指标差异无统计学意义(P>0.05),但C组术后并发症少(P<0.05),见表4。四组术后并发症发生率差异有统计学意义,D组发生率最高,A组最低,见表5。34例患者术后随访3年,均未见复发或二次住院。
3 讨 论
胰腺肿瘤发病隐匿,临床症状并不典型,除了常见腹痛、黄疸、体重下降等体征外,部分患者无明显症状,仅在体检情况下发现胰腺占位,其中胰体尾占位因早期无明显典型症状,较胰头占位更难以发现。由于胰腺肿瘤对放化疗不敏感,临床上以手术切除为主[1]。既往人们对脾脏功能的认识不深,而且脾脏与胰体尾部位置密切相邻[2],其血管贴及胰腺后上缘,数个分支分布在体尾部,更有少数分支置入胰腺实质内,出于安全考虑,既往手术主张胰体尾联合脾脏切除[3]。但随着学者对脾脏功能的深入研究,发现脾脏具有造血、储血、调节免疫、参与内分泌等功能[4-6],因此保脾胰体尾切除得到越来越多的认可。临床上亦不断开展保留脾脏的胰体尾切除术,其中以腹腔镜下保留脾动静脉的胰体尾切除术最为精深[7]。
对于围手术期使用生长抑素可为患者带来获益,因其可抑制胰酶分泌,使Oddi括约肌舒张,并通过细胞通路减少粘多糖合成,减少术后粘连。而且有抑制细胞因子、炎症因子的作用,从而减轻炎症反应,降低术后胰瘘等并发症发生率[8]。
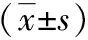
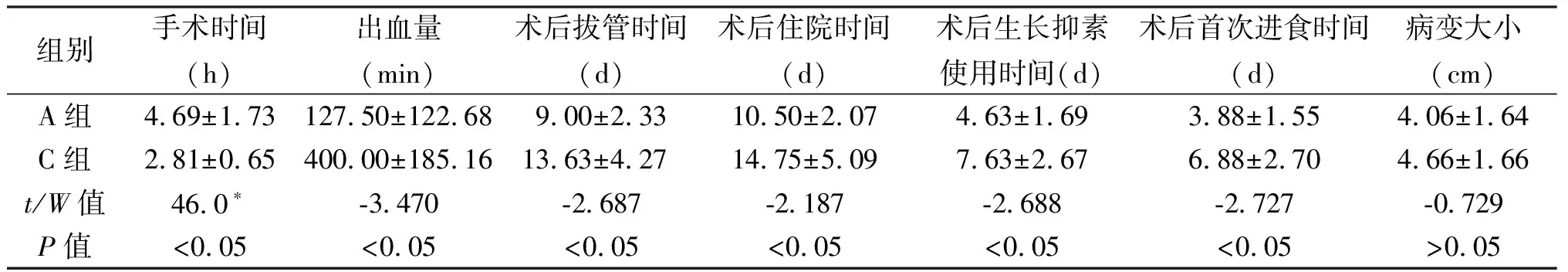
组别手术时间(h)出血量(min)术后拔管时间(d)术后住院时间(d)术后生长抑素使用时间(d)术后首次进食时间(d)病变大小(cm)A组4.69±1.73127.50±122.689.00±2.3310.50±2.074.63±1.693.88±1.554.06±1.64C组2.81±0.65400.00±185.1613.63±4.2714.75±5.097.63±2.676.88±2.704.66±1.66t/W值46.0∗-3.470-2.687-2.187-2.688-2.727-0.729P值<0.05<0.05<0.05<0.05<0.05<0.05>0.05
*W值为Wicolxon值


组别手术时间(h)出血量(min)术后拔管时间(d)术后住院时间(d)术后生长抑素使用时间(d)术后首次进食时间(d)病变大小(cm)B组4.19±1.60218.75±119.3417.13±14.7417.38±14.645.38±1.304.88±2.034.94±2.10D组3.65±1.331 060.00±914.3312.50±8.3012.00±3.375.80±1.816.40±5.105.85±4.14t/W值0.77743.50∗0.8431.132-0.556-0.793-0.566P值>0.05<0.05>0.05>0.05>0.05>0.05>0.05
*W值为Wicolxon值

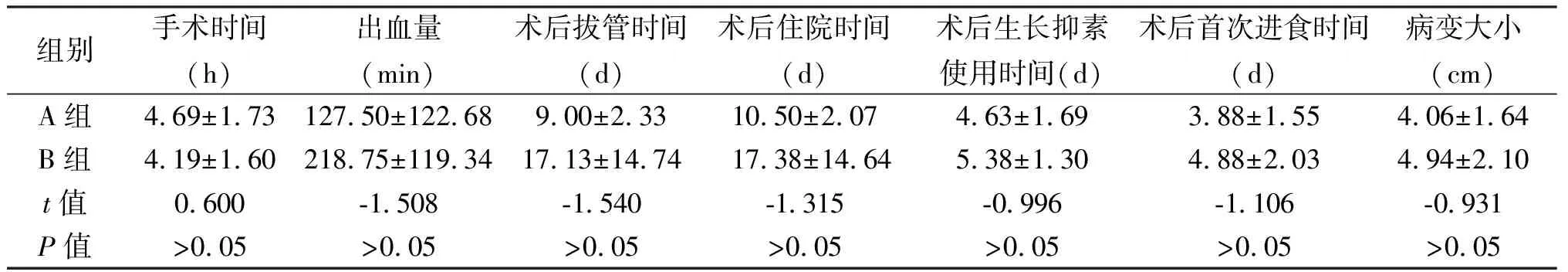
组别手术时间(h)出血量(min)术后拔管时间(d)术后住院时间(d)术后生长抑素使用时间(d)术后首次进食时间(d)病变大小(cm)A组4.69±1.73127.50±122.689.00±2.3310.50±2.074.63±1.693.88±1.554.06±1.64B组4.19±1.60218.75±119.3417.13±14.7417.38±14.645.38±1.304.88±2.034.94±2.10t值0.600-1.508-1.540-1.315-0.996-1.106-0.931P值>0.05>0.05>0.05>0.05>0.05>0.05>0.05

组别手术时间(h)出血量(min)术后拔管时间(d)术后住院时间(d)术后生长抑素使用时间(d)术后首次进食时间(d)病变大小(cm)C组2.81±0.65400.00±185.1613.63±4.2714.75±5.097.63±2.676.88±2.704.66±1.66D组3.65±1.331 060.00±914.3312.50±8.3012.00±3.375.80±1.816.40±5.105.85±4.14t/W值-1.62061.00∗0.3471.3771.7260.23773∗P值>0.05<0.05>0.05>0.05>0.05>0.05>0.05
*W值为Wicolxon值
表5 4组患者手术并发症的比较(n)

组别胰瘘脾梗术后出血高血糖肺部感染血小板升高不明原因高热腹腔感染合计[n(%)]A组000010001(12.5)B组100002102(25.0)C组210110105(62.5)D组201214218(80.0)Fisher确切数2.3363.0342.5882.6541.5036.1231.8252.58810.181P值>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05<0.05
通过本研究我们发现,不论腹腔镜下胰体尾切除术抑或开腹下胰体尾切除术,保留脾脏与切除脾脏的手术时间差异有统计学意义(P<0.05),表明仔细分离脾脏供血的血管并未增加手术时间与手术难度,保留脾脏后出血的风险也无明显升高。虽然保留脾脏与切除脾脏后拔管时间、术后住院时间差异无统计学意义(P>0.05),但保留脾脏手术后并发症更少。本研究中,开腹胰体尾联合脾切除术后并发症发生率最高,Buzelé等[9]曾指出,脾切除术后可出现感染性与血栓性并发症,且发生率与原发病有关。本研究中,不论腹腔镜手术抑或开腹手术,切脾后均出现血小板的大幅度升高及术后不明原因高热,D组更为明显,其中1例术后出血,经输血、止血等保守治疗2 d后得以改善,未行二次开腹手术,但随即出现腹腔感染、肺部感染等并发症,予以积极抗炎、通畅引流等对症支持治疗一周后病情好转。
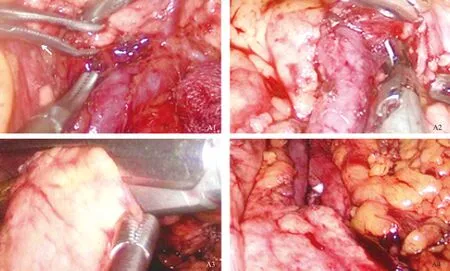
图1 腹腔镜下保留脾脏胰体尾部切除术(A1:剪开韧带后见脾血管;A2:仔细分离脾血管周围分支;A3:进行胰体尾切除;A4:保留脾血管切除胰体尾部)
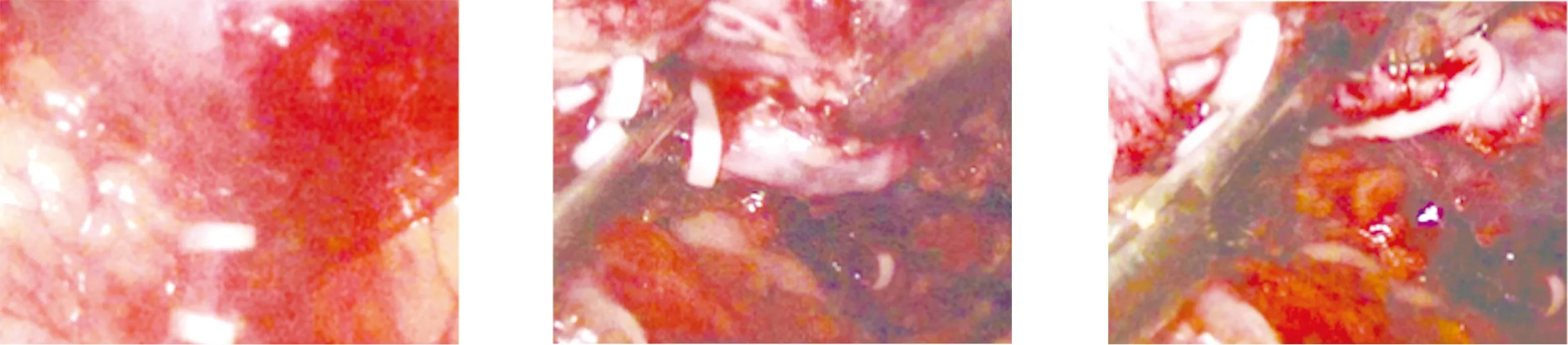
图2 夹闭脾血管 图3 切断脾血管 图4 切断脾血管
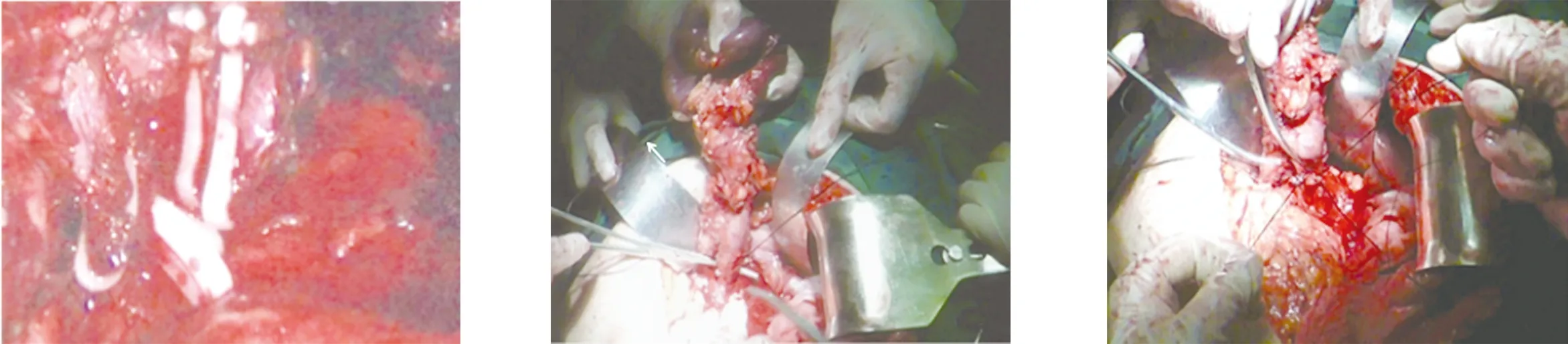
图5 切断脾血管及夹闭其周围分支 图6 游离脾静脉 图7 结扎脾静脉
在保脾的情况下,A组除手术时间较C组长外(P<0.05),术中出血量、术后拔引流管时间、术后住院时间、生长抑素用量、术后首次进食时间均优于C组(P<0.05)。在切除脾脏的情况下,B组较D组术中出血量少(P<0.05),两组手术时间差异无统计学意义,表明腹腔镜手术不仅不增加手术时间,而且可明显减少术中出血量(P<0.05)。C组中出现1例术后脾梗,因梗死面积小于20%,予以保守治疗后脾脏血供恢复。
与腹腔镜手术相比,开腹手术对患者创伤更大,而腹腔镜手术对术者及其团队的要求更高。虽然微创外科得到不断的推广普及,许多医院亦陆续从探索到成熟的转变,但胰腺体尾部切除的腹腔镜手术并未全面普及,其最主要的原因在于手术难度较高[7]。腹腔镜下保留脾脏胰体尾部切除术根据术中脾血管保留情况[10]分为Kimura[11]法(图1)与Warshaw[12]法(图2~图5),前者完整保留脾动静脉,后者仅保留胃短、胃网膜左动、静脉。本研究中,A组共8例,其中Kimura法5例,Warshaw法3例(下面简称K法与W法)。虽然K法组术中出血量较W法组少[(64.00±35.07)mL vs. (233.33±152.75)mL,P<0.05],但两组手术时间差异无统计学意义[(4.10±1.43)h vs. (5.67±2.02)h,P>0.05],且两种方法术后拔管时间、术后出院时间、生长抑素使用时间等差异亦无统计学意义。
国外学者Adam等[13]曾报道,较大的病变占位会对周围胰腺压迫,引起炎症粘连更重,剥离时大量出血的情况更容易出现,此时W法优于K法。因W法将脾动、静脉等血管剥离,减少了机体对脾脏的供血量,从而降低了术中大出血的风险。本研究中,K法组病变直径与W法组差异无统计学意义[(3.60±1.64)cm vs. (4.83±1.61)cm,P>0.05],未能证实上述说法。有研究发现[14-15],W法术后出现脾静脉血栓、脾梗、胃底静脉曲张等较K法多,因为脾动、静脉离断后胃短、胃网膜左动脉对脾脏的血供不足,且前者术后血小板水平常较后者高,容易造成血液高粘稠性,增加了脾静脉血栓、脾梗的发生率。虽然本研究中未发生脾血管相关并发症,但由于样本量少,尚不能认为两种手术后并发症无差异。
综上所述,胰体尾切除术中保留脾脏可为患者带来更多获益,建议推广。腹腔镜胰体尾良、交界性病变切除术安全、可靠,应用价值高,但关于手术方法的选择仍需继续探讨。

