T-2毒素快速定量检测试纸条的研究
许会静,李玉杰,张馨月,王弘瑞,苗茁,柳玉,李艳,王会岩,董媛,*
(1.吉林医药学院检验学院,黑龙江吉林132013;2.吉林医药学院抗体中心,黑龙江吉林132013)
T-2 毒素属于A 型单端孢霉烯族化合物,主要由三线镰刀菌、枝孢镰刀菌、拟枝孢镰刀菌、梨孢镰刀菌、硫色镰刀菌等真菌代谢产生[1]。在寒冷或潮湿的储存条件下,燕麦、玉米、大麦、小麦和动物饲料等易被污染。T-2 毒素可以抑制蛋白质[2]和核酸[3]的合成,人类误食污染的谷物后,表现出一系列急性和慢性的中毒症状,如呕吐、腹泻、昏睡、体重减轻、出血、免疫抑制,甚至死亡[4-5]。目前研究表明,人类食物中毒性白细胞缺乏症和大骨节病[6]也与该毒素相关。T-2 毒素性质稳定,可在动物体内代谢和消除,产生比其本身毒性更强的代谢产物[7]。目前仍没有有效的解毒方法进行治疗。因此,为避免T-2 毒素的污染,减少其对人类和畜牧业的危害,建立快速、灵敏、准确地检测T-2 毒素的方法已成为近年来研究的热点。
目前,气相色谱法(gas chromatography,GC)[8]、气相色谱串联质谱法(gas chromatography mass spectrometry,GC-MS)[9],高效液相色谱法(high-performance liquid chromatography,HPLC)[10]、液相色谱串联质谱法(liquid chromatography mass spectrometry,LC-MS)[11]、酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)[12-13]等技术已经广泛应用到T-2 毒素的检测中。但是,这些传统的检测方法操作繁琐,需要昂贵的仪器,专业的技术人员等,不但成本高,而且分析速度慢,难以达到快速、简便和现场检测要求。胶体金免疫层析技术(colloidal gold immunochromatography,GICA)具有高灵敏度、低成本、操作简便、结果判断直观等优点,已广泛应用于T-2 毒素的快速检测、临场检测等领域,但目前该试纸条只能做定性检测[14-15]。本试验制备出T-2 毒素单克隆抗体,根据胶体金免疫层析试验原理,结合定量读卡仪,建立一种快速定量检测T-2 毒素的胶体金试纸条,并在玉米检测中进行应用,为真菌毒素的快速检测奠定基础。
1 材料与方法
1.1 材料与试剂
Balb/c 小鼠(6 周~8 周雌性):吉林大学动物实验中心;T-2 毒素、HT-2 毒素、新石房蛤毒素(neosaxitoxin,NEO)、蛇形霉素(diacetoxyscirpenol,DAS)、脱氧雪腐镰刀菌烯醇毒素(deoxynivalenol,DON)、雪腐镰刀菌烯醇毒素(nivalenol,NIV)标准溶液:普瑞邦生物工程有限公司;卵清蛋白(ovalbumin,OVA)、牛血清白蛋白(bovine serum albumin,BSA):合肥博美生物科技有限责任公司;30 nm 胶体金、NC 膜、玻璃纤维膜、PVC底板:上海杰一生物科技有限公司。
1.2 仪器与设备
点膜仪(XYZ3000):Bio-Dot 公司;数控切条机(CT-300):上海金标生物科技有限公司;分析型高效液相色谱仪(2695 分析型):美国waters 公司;酶标分析仪(SM-3 型):北京天石天力医疗器械技术开发中心;紫外-可见分光光度计(Nanodrop2000):美国 Thermo 公司;胶体金定量读数仪(TND09MJ):深圳拓能达科技有限公司。
1.3 方法
1.3.1 T-2 毒素单克隆抗体的制备
参考Chu 等[16-17]的方法合成T-2-HG-BSA 和 T-2-HS-OVA 抗原,以 T-2-HG-BSA 为抗原对 6 周~8 周的雌性Balb/c 小鼠进行免疫,4 次免疫后取小鼠免疫血清ELISA 测定效价,选择血清效价高的小鼠脾细胞与骨髓瘤细胞(SP2/0)进行融合,获得T-2 毒素单克隆抗体杂交瘤细胞株,将其接种到Balb/c 小鼠腹腔内采集腹水,得到T-2 毒素单克隆抗体,并采用间接ELISA法对抗体的效价进行测定。
1.3.2 T-2 毒素单克隆抗体的纯化鉴定
将小鼠腹水与20 mmol/L 磷酸钠溶液混合,平衡8 h 后过protein G 纯化柱纯化,最后用甘氨酸盐酸洗脱液冲洗柱子,收集洗脱液并在PBS(0.01 mmol/L,pH 7.2)中透析24 h,得到纯化后的T-2 毒素单克隆抗体。将纯化后的抗体进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳鉴定。
1.3.3 胶体金标记抗体最适pH 值的确定
取酶标板,加入100 μL 胶体金后,用0.1 mol/L HCl和 K2CO3溶液,调节 pH 值分别为 6.0、7.0、7.5、8.0、8.5、9.0 和 9.5,混匀后加入 4 μL T-2 毒素抗体(1 mg/mL,混匀后加入 10 % NaCl 20 μL,30 min 后观察标记结果,测定 OD520值。
1.3.4 金标抗体的制备
取胶体金溶液1 mL,用0.1 mol/L K2CO3溶液调节胶体金溶液(30 nm)至最佳pH 值,在温和搅拌条件下,向其中逐滴加入20 μL T-2 毒素单克隆抗体(1.0 mg/mL),充分混匀 30 min 后,加入 40 μL 浓度为10%BSA 封闭15 min,加入终浓度为0.1%PEG20000混匀15 min。将上述标记后的胶体金溶液1 500 r/min低速离心20 min;取上清再12 000 r/min 高速离心20 min;重悬沉淀于储存液中,4 ℃保存备用。紫外条件下全波长扫描标记抗体的胶体金溶液和未标记的胶体金溶液,观察扫描图谱波形变化,判断标记是否成功。
1.3.5 抗体最佳标记浓度和抗原最佳包被浓度
在确定最佳pH 值条件下,单抗分别按照5、10、20、30 μg/mL 标记,均匀喷涂在玻璃纤维膜上制成胶体金结合垫,T-2-HS-OVA 抗原按照 0.125、0.25、0.5、0.75 mg/mL 分别包被在 NC 膜上的检测线(T 线),羊抗鼠二抗按 1.0 mg/mL 包被到 NC 膜的质控线(C 线),将胶体金结合垫、样品垫和吸水垫按顺序组装在底板上,进行正交试验,检测T-2 毒素标准溶液(0、2、5、10、20、50 μg/kg)浓度,选择 0 μg/kg 显色明显且灵敏度高的组合为最佳条件。在此条件下,羊抗鼠二抗按0.5、0.75、1.0、1.5 mg/mL 包被到 NC 膜的 C 线,选择检测10 μg/kg 标准溶液时C 线显色强度与T 线相当的包被浓度为为最佳条件。
1.3.6 快速检测卡的组装与检测
用PBS 配置5%蔗糖、0.05%tween-20 溶液的处理液,玻璃纤维塑膜浸入处理液,10 min 后25 ℃室温晾干。将最佳标记量的金标抗体均匀喷涂在玻璃纤维膜上制成胶体金结合垫,37 ℃干燥1 h。将T-2-HSOVA 抗原和二抗,分别用包被于NC 膜上的T 线和C线,37 ℃干燥2 h。将胶体金结合垫、样品垫和吸水垫按顺序组装在底板上,并切割装入塑料卡壳中,制成检测卡。在检测卡的加样孔中滴加50 μL 待检样品溶液,2 min 后,放入胶体金定量读数仪中,读取浓度值。
1.3.7 标准曲线的建立
配制不同浓度(0、5、10、20、50、100 μg/kg)的 T-2毒素标准溶液,分别取50 μL 加到检测卡的加样孔中,25 ℃室温反应2 min,放入胶体金定量读数仪中,读取T 线光密度/C 线光密度比值(T/C),T-2 标准品浓度为0 μg/kg 时 T/C 记为 B0,不同浓度 T-2 标准溶液 T/C 记为B,以T-2 毒素标准溶液浓度的对数为横坐标、B/B0值为纵坐标,制作标准曲线。
1.3.8 样品前处理方法的确定
称取粉碎的玉米样品5 g,加入25 mL70%甲醇水溶液,漩涡震荡提取3 min,提取液用双层滤纸过滤,取1 mL 滤液加入到 4 mLPBS(0.01 mol/L)溶液中进行5倍稀释,样品稀释液用有机相滤膜(0.45 μm)过滤,取出该滤液50 μL 滴入检测孔进行检测,2 min 后放入胶体金定量读数仪中,读取浓度值。
1.3.9 回收试验
取玉米样品,检测其中T-2 毒素含量,向其中添加不同浓度的(5、10、20、50、100 μg/kg)T-2 毒素标准溶液,再次进行检测,计算回收率。
1.3.10 特异性检测
用 PBS 稀释 T-2 毒素、HT-2 毒素、NEO、DAS、DON、NIV 标准溶液至终浓度为 200、400、800、1 600、3 200 μg/L,用T-2 毒素快速检测试纸条进行检测,每个浓度设6 个重复,检测试纸条的特异性。
1.3.11 重复性检测
随机抽取3 个不同批次及同一批次的试纸条,检测不同质量浓度的(5、10、20、50、100 μg/kg)T-2 毒素标准溶液,每个样本浓度重复测定5 次,检查试纸条的重复性。
1.3.12 样品检测
取10 份玉米样品,向其中随机添加不同浓度的T-2 毒素标准溶液,制备T-2 毒素含量在5 μg/kg~100 μg/kg 之间的玉米样品,分别用试纸条和高效液相色谱法[18]进行检测,每个样品重复3 次,并将检测结果进行对比。
1.4 数据统计
试验数据利用Excel 2007 进行统计分析和标准曲线制作,数据以平均值表示。
2 结果与分析
2.1 T-2单克隆抗体效价的测定
采用间接ELISA 方法测定T-2 单克隆抗体效价,单克隆抗体的效价为1 ∶256 000。
2.2 T-2毒素单克隆抗体的纯化鉴定
T-2 毒素单克隆抗体经protein G 纯化后通过SDS-PAGE 电泳进行鉴定,结果显示(如图1),50 kDa和25 kDa 位置有清晰条带,且未见杂蛋白,表明纯化得到纯度较高的T-2 毒素单克隆抗体。
2.3 胶体金标记抗体最适pH的确定
物理吸附是胶体金与蛋白质结合的主要机制。胶体金颗粒表面的负电荷与蛋白表面正电荷通过静电作用相互吸附,因此标记溶液的pH 值对蛋白标记成功与否有重要作用。如图2 所示。

图1 T-2 抗体纯化后的SDS-PAGE 电泳鉴定结果Fig.1 Identification of T-2 antibody purification by SDS-PAGE

图2 T-2 毒素金标抗体最佳pH 的确定Fig.2 Optimal pH of T-2 toxin colloidal antibody
由图2 可知,当pH 值为8.5 时,胶体金标记抗体蛋白结合物在520 nm 处的吸光值较高,且曲线趋于平坦,标记抗体未发生死金现象,表明胶体金记抗体的最佳pH 值为8.5。
2.4 金标抗体的质量鉴定
紫外条件下全波长扫描标记抗体的胶体金溶液和未标记的胶体金溶液,结果见图3。

图3 胶体金扫描图谱Fig.3 Colloidal gold scanned pattern
由图3 可见,标记T-2 毒素单克隆抗体的胶体金溶液最大吸收峰出现了明显的位移,因此可判断抗体被胶体金成功标记。
2.5 抗体最佳标记浓度和抗原最佳包被浓度
通过正交试验,单抗的最佳标记浓度为20 μg/mL标记,抗原的包被浓度为0.5 mg/mL,羊抗鼠IgG 的包被浓度为1.0 mg/mL,为最佳组合条件,此时试纸条的最低检测限为5 μg/kg。
2.6 标准曲线的建立
通过检测不同浓度的T-2 毒素标准溶液,胶体金读数仪读取T 线光密度/C 线光密度比值(T/C),以T-2毒素标准溶液浓度的对数为横坐标、B/B0值为纵坐标,制作标准曲线。T-2 毒素标准溶液浓度在10 μg/kg~100 μg/kg 时,线性范围较好。其线性方程和回归系数见图4。

图4 胶体金试纸条法检测T-2 毒素的标准曲线Fig.4 Standard curve for detection of T-2 toxin by colloidal gold strip method
2.7 回收试验
取玉米样品,检测其中T-2 毒素含量,向其中添加不同浓度的T-2 毒素标准溶液,再次进行检测,计算回收率,结果见表1。

表1 玉米添加T-2 毒素的回收率和变异系数Table 1 Recoveries and coefficients of variation of T-2 in corn
结果显示,该试纸条检测玉米样本的回收率在77 %~117.6%之间,变异系数小于10%,表明该检测方法精密度和重现性良好。
2.8 特异性检测
用 PBS 稀释 T-2 毒素、HT-2 毒素、NEO、DAS、DON、NIV 标准溶液至不同浓度,用T-2 毒素快速检测试纸条进行检测,评价试纸条的特异性,结果见表2。

表2 T-2 毒素快速检测试纸条的特异性Table 2 Specificity of T-2 toxin rapid test trip
由表2 可知,T-2 毒素快速检测试纸条与其他真菌毒素无交叉反应。说明该试纸条有高度的特异性。
2.9 重复性检测
随机抽取3 个不同批次及同一批次的试纸条,检测不同质量浓度的T-2 毒素标准溶液,检查试纸条的重复性。检测结果见表3、表4,结果表明,T-2 毒素快速定量检测试纸条的批内和批间变异系数均小于10%,表明该检测方重复性良好。
2.10 方法比对
随机取 10 份 T-2 毒素含量在 5 μg/kg~100 μg/kg之间的玉米样品,分别用试纸条和高效液相色谱法进行检测,并将检测结果进行对比。结果见图5,GICA 与HPLC 检测结果一致。

表3 T-2 毒素快速检测试纸条的批内重复性Table 3 Intra repetitiveness of T-2 toxin rapid test trip

表4 T-2 毒素快速检测试纸条的批间重复性Table 4 Inter repetitiveness of T-2 toxin rapid test trip
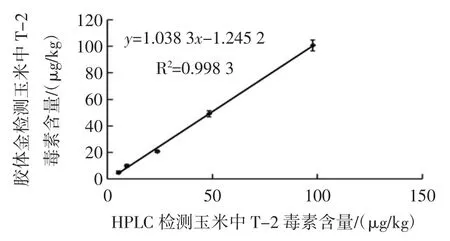
图5 GICA 与HPLC 检测样品中T-2 毒素结果的比较Fig.5 Correlation of quantitative data of T-2 obtained by GICA and HPLC
3 讨论
玉米是我国重要的粮食作物之一,玉米加工食品也是人们日常生活必不可少的,比如玉米面、玉米油、速食玉米等。此外,玉米在工业方面也有重要作用,比如酒精、饲料、制药等的加工原料。但随现代化和工业化进程的发展,T-2 毒素的污染对其造成严重的质量安全问题[18-20]。世界各国对T-2 毒素都有严格的限量标准[21],检测玉米中T-2 毒素的含量对避免T-2 毒素的污染,减少其对人类和畜牧业的危害有重要意义。由于GICA 具有操作简便,快速,灵敏度的特点,已广泛应用于多种真菌毒素的检测中[22-23]。目前,朱亮亮等[14-15]建立的饲料和谷物中T-2 毒素检测试纸条只能定性不能定量。本试验建立的T-2 毒素胶体金定量检测试纸条可以通过定量读数仪获得T-2 毒素的具体含量,避免了人为因素主观判断造成的差异。研究表明[13],半抗原和载体蛋白之间间隔较长碳链的免疫原性优于间隔较短碳链的免疫原性,包被抗原的异质性可提高免疫反应的特异性。因此本实验室选用比T-2HS-BSA 碳链较长的T-2HG-BSA 为免疫原自主制备出了高特异性的抗T-2 毒素单克隆抗体,并进行了胶体金标记,提高了检测结果的特异性。选用与T-2HS-BSA 具有较高异质性的T-2HS-OVA 为包被抗原喷涂在硝酸纤维膜上,提高了检测结果的灵敏度。并通过实验室试纸条检测参数的优化,把T-2 毒素免疫胶体金快速试纸条检测限提高到5 μg/kg,明显高于胶体金标记T-2 毒素多克隆抗体的灵敏度[15],玉米添加回收率在77%~117.6%之间,批内和批间重复性检测变异系数小于10%,玉米中T-2 毒素的检测结果与高效液相法检测结果一致。表明本试验研制的快速定量检测T-2 毒素的方法,可以有效地对食品中T-2 毒素进行检测和监控,具有重要的经济价值和社会价值。

