低温挤出-多酶协同降解脱胚玉米中淀粉的机理
叶向库,申德超
低温挤出-多酶协同降解脱胚玉米中淀粉的机理
叶向库1,2,申德超3
(1. 河北农业大学食品科技学院,保定 071001; 2. 烟台大学生命科学学院,烟台 264005;3. 山东理工大学农业工程与食品科学学院,淄博 255091)
为了改变目前挤出酶解谷物淀粉仅添加一种酶制剂(淀粉酶),只能降解淀粉的1,4糖苷键,不能降解支链淀粉的-1,6糖苷键,限制淀粉转化成葡萄糖的收率进一步提高的现状,该文应用低温(≤80 ℃)挤出-多酶(-淀粉酶、糖化酶、普鲁兰酶)协同降解技术,制备挤出过程中物料的石蜡显微制片,观察脱胚玉米经低温挤出-多酶协同降解处理后,细胞壁、细胞中的淀粉颗粒和蛋白质颗粒的分布状况以及淀粉含量、糊化度、可溶性糖含量的变化。结果表明:在挤出过程中,淀粉发生糊化和降解,表观淀粉质量分数减少,从81.50%减少到74.40%,可溶性糖质量分数增加,从1.07%增加到2.26%,挤出过程中加入酶制剂后这种变化更加明显。添加单一淀粉酶表观淀粉质量分数从79.72%减少到69.16%,可溶性糖质量分数从6.54%增加到7.90%。添加淀粉酶和糖化酶表观淀粉质量分数从81.42%减少到72.45%,可溶性糖质量分数从11.65%增加到14.71%。添加-淀粉酶和普鲁兰酶表观淀粉质量分数从81.31%减少到70.31%,可溶性糖质量分数从6.74%增加到8.29%。添加-淀粉酶、糖化酶、普鲁兰酶3种酶时淀粉质量分数从81.06%减少到69.05%,可溶性糖质量分数从11.25%增加到16.35%。因此,3种酶(-淀粉酶、糖化酶、普鲁兰酶)协同作用对淀粉降解以及可溶性糖含量的增加作用效果最好。显微切片的分析结果表明:添加3种酶制剂(-淀粉酶+糖化酶+普鲁兰酶)的切片,细胞结构中淀粉颗粒被降解破坏的程度大于添加1种(耐高温-淀粉酶)、2种(-淀粉酶+糖化酶,或者-淀粉酶+普鲁兰酶)酶制剂的细胞结构中淀粉颗粒被降解破坏的程度。低温挤出-多酶协同降解后,脱胚玉米挤出物的总淀粉含量降低、可溶性糖含量增加,糊化度增加。试验表明:添加3种酶制剂协同降解脱胚玉米中淀粉的作用效果优于添加1种酶制剂或2种酶制剂的淀粉降解效果,为进一步提高淀粉转化成葡萄糖的收率提供科学依据。
挤压;酶;淀粉;脱胚玉米;细胞结构;蛋白质;理化指标
0 引 言
脱胚玉米中淀粉的利用,首先要经过淀粉糊化、液化、糖化等处理,使淀粉大分子变成小分子,然后用于生产淀粉糖[1]以及作为发酵用原料[2]。低温挤出酶解技术改变传统加水加热进行淀粉糊化处理的方式,采用挤压机进行挤出处理,完成糊化[3-7],同时加入淀粉酶加速淀粉的降解[8]。Mercier等[9]应用挤出酶解(添加耐温-淀粉酶)技术,研究谷物淀粉的挤出液化、糖化过程。Vasanthanl等[10]研究添加耐温-淀粉酶的大麦粉,经100 ℃挤压处理后淀粉的水解度和DE值(dextrose equivalent)增加。冉旭[11]、孙于庆[12]等人用双螺杆挤压机处理添加耐高温-淀粉酶的玉米淀粉,在95 ℃时淀粉DE值达到最大。奚可畏[13]采用脱胚玉米添加-淀粉酶经挤出处理后生产淀粉糖浆,DE值达到89.35%。李宏军[14]采用外加酶法对大米挤出物进行处理,陈善峰[15]采用低温加酶挤压技术对大米挤出物进行糖化处理,麦汁浸出物收得率提高1.20%~3.04%。潘小卫[16]在高粱中添加-淀粉酶经挤出处理用于生产小曲白酒,挤出后35.71%的淀粉发生了降解。玉米淀粉中含有27%的直链淀粉,其余均为支链淀粉。支链淀粉中含有-1,6糖苷键。-淀粉酶能随机水解淀粉中的-1,4糖苷键[17],但不能水解淀粉中的-1,6糖苷键。挤出时只添加-淀粉酶将影响挤出物中可溶性糖和最终淀粉的利用程度。这是目前国内外学者研究仅添加1种酶制剂(耐温-淀粉酶)的淀粉挤出酶解技术的不足之处。
为提高玉米中淀粉支链淀粉的水解利用程度,本文应用低温挤出-多酶协同降解技术[18],研究了添加1种、2种和3种酶制剂的干法脱胚玉米中淀粉的挤出过程。试验应用石蜡显微制片技术,研究挤出前分别添加只能降解直链淀粉的-1,4糖苷键的一种酶制剂(耐高温-淀粉酶),以及既能降解-1,4糖苷键又能降解支链淀粉的-1,6糖苷键的2种酶制剂(耐高温-淀粉酶和糖化酶或者耐高温-淀粉酶和普鲁兰酶)和3种酶制剂(耐高温-淀粉酶、糖化酶、普鲁兰酶)的干法脱胚玉米,在挤出过程中,螺杆外表面和套筒内表面的挤出腔体中的不同取样点物料的脱胚玉米细胞壁及细胞中的淀粉颗粒和蛋白质颗粒等物质的变化情况。揭示物料在挤出过程受到的机械剪切力、热和添加的酶制剂对细胞壁结构及细胞中的淀粉颗粒和蛋白质颗粒分布的影响规律,为挤出酶解技术在制糖及其衍生物生产领域中的应用提供科学依据。
1 材料与方法
1.1 试验材料
脱胚玉米,购于淄博潘庄粮油市场(含水率13.5%(湿基));耐高温-淀粉酶(活力4×104U/mL,烟台麦特尔生物科技有限公司);糖化酶(4×104U /mL,诺维信生物技术有限公司);普鲁兰酶(1×103U/mL,烟台麦特尔生物科技有限公司);中性蛋白酶(1×105U/mL,诺维信生物技术有限公司);固绿(南京奥多福尼生物科技有限公司);番红(天津市登科化学试剂有限公司);其他化学试剂没有特殊说明均为分析纯试剂。
1.2 试验方法
1.2.1 脱胚玉米低温挤出-多酶协同降解的样品处理
取脱胚玉米(含水率13.5%)2 kg,在前人研究的基础上[18-19],加水调至含水率30%,加酶制剂拌匀,放置30 min,使水分分布均匀,经单螺杆挤出机(SSE-95套筒整体剖分式单螺杆挤出机,山东理工大学、淄博汇创生物科技有限公司研制)挤出加工,其中,螺杆转速(≤130 r/min),机筒温度(≤80 ℃),模孔直径(≤14 mm)均可调整,在正常出料的情况下突然停机,迅速打开套筒,沿螺杆顺序1、2、3、4、5、6取样,如图1所示。
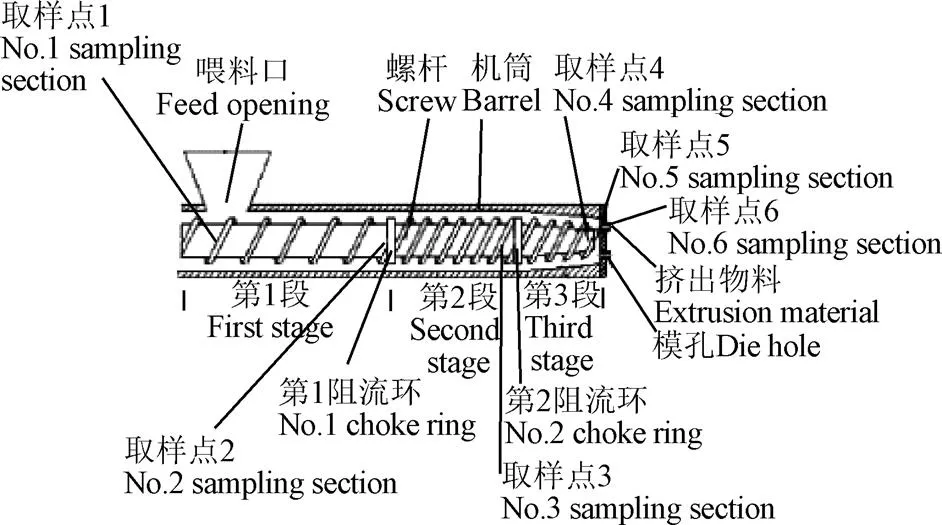
图1 挤出机内取样点示意图
1.2.2 制备石蜡显微切片
石蜡显微切片采用常规制备技术[20],不同之处在于:1)脱胚玉米由于是成熟的细胞组织,新陈代谢较慢,不需固定,直接进行脱水操作。并且水分含量较低,初始脱水可以选取酒精浓度稍高一些,从70%酒精开始进行脱水操作;2)脱胚玉米中细胞壁染色,用1%番红和1%固绿对切片中细胞壁进行染色;3)蛋白质和淀粉染色,取切好的石蜡切片放置于载玻片上,滴一滴碘-碘化钾(I-KI)[21]溶液,盖上盖玻片,蛋白质和淀粉同时染色,显微镜下观察,蛋白质呈黄色,淀粉呈蓝色。
1.2.3 低温挤出-酶解过程中干法脱胚玉米取样点的确定
低温挤出分别添加1种酶制剂(耐高温-淀粉酶)、2种酶制剂(耐高温-淀粉酶+糖化酶)和3种酶制剂(耐高温-淀粉酶+糖化酶+普鲁兰酶)的干法脱胚玉米在挤出过程[18]中,如图1所示,分别选取在挤出机内的1至6取样点物料,制作石蜡显微切片,以未添加酶制剂样品为对照样,观察在挤出过程中添加不同酶制剂组合,对挤出过程中脱胚玉米细胞中细胞壁、淀粉颗粒、蛋白质颗粒变化的影响规律。
以下图例标示的说明:A—脱胚玉米原料(对照样),A后的1、2、3、4、5、6为挤出机中如图1所示的6个取样点,下同;B—脱胚玉米中添加-淀粉酶的脱胚玉米,添加量为0.5L/t;C—脱胚玉米中添加-淀粉酶+糖化酶的脱胚玉米,-淀粉酶的添加量为0.5 L/t,糖化酶添加量1.46 L/t;D—脱胚玉米中添加-淀粉酶+普鲁兰酶的脱胚玉米,-淀粉酶的添加量为0.5 L/t,普鲁兰酶添加量0.7 L/t;E—脱胚玉米中添加-淀粉酶+糖化酶+普鲁兰酶的脱胚玉米,-淀粉酶的添加量为0.5 L/t,糖化酶添加量1.46 L/t,普鲁兰酶添加量0.7 L/t;F—脱胚玉米中添加中性蛋白酶的脱胚玉米,中性蛋白酶的添加量为0.4 L/t。
1.2.4 测试指标及测定方法
可溶性糖的测定采用《食品分析(第二版)》(王永华,2017)中规定的方法[22]。可溶性糖通常是指食品中游离态的单糖、双糖、低聚糖等可溶于水的碳水化合物。测定时常以水作为提取剂,温度控制在40~50 ℃,温度过高,提取可溶性糖的同时还会溶出较多的糊精和可溶性淀粉等成分。提取液中除可溶性糖外,还可能含有蛋白质、淀粉、果胶、色素、有机酸等干扰物质,因此后期要通过添加澄清剂将干扰物质除去。通过试验,选用中性醋酸铅作为澄清剂效果较好,可有效除去蛋白质、果胶、单宁、有机酸等杂质,不会沉淀样液中的还原糖,对试验结果影响较小。
糊化度测定参考《粮油食品品质分析》(王肇慈,2000)中第四章第四节“淀粉度的测定(酶水解法)”[23]。
淀粉含量的测定采用GB5009.9-2016中的酶水解法。
水分测定采用GB5009.3-2016中的直接干燥法。
1.3 数据处理
收集试验数据,取2次独立测定的算术平均值为测定结果,对于淀粉,按GB5009.9-2016中规定,两次独立测定结果的绝对差值不得超过算术平均值的10%。糊化度和可溶性糖,参照GB/T6379.1《测量方法与结果的准确度(正确度与精确度)》的要求执行。所有试验结果均以MEAN±SD表示,采用IBM SPSS20.0软件进行统计分析。以<0.05为差异具有统计学意义,<0.01为差异具有显著统计学意义。
2 结果与分析
2.1 低温挤出-多酶协同降解干法脱胚玉米中淀粉的理化指标的变化规律
脱胚玉米作为发酵原料,人们主要利用其中的淀粉。脱胚玉米中的淀粉在挤出机内发生的一系列变化,是挤出技术能否用于发酵原料预处理工序的关键所在。本文从脱胚玉米在挤出机中淀粉含量、糊化度、可溶性糖的变化情况来探讨理化指标的变化规律。
2.1.1 低温挤出过程中添加不同酶制剂对脱胚玉米淀粉含量的影响规律
脱胚玉米经低温挤出处理,从喂料口到挤出模孔处,淀粉含量逐渐降低,添加酶的种类和数量的不同降低程度也有差别。如表1所示,考虑玉米籽粒中淀粉颗粒包埋在蛋白质基质中,添加蛋白酶有利于淀粉的释放和水解,但实际效果并不理想。添加中性蛋白酶对淀粉的作用最弱,从喂料口到挤出端,淀粉总量降低只有2.31个百分点,而以添加-淀粉酶、糖化酶、普鲁兰酶3种酶混合的降解程度最大,达到12.01个百分点。在挤出机中添加的酶中以-淀粉酶在挤出机中对玉米淀粉的作用最明显,对淀粉降解效果最好。而添加糖化酶的效果不明显,在挤出过程中仅在挤出模孔的极短距离内发挥了一定的作用,可能是前期挤出机内的条件不适宜糖化酶的作用。添加普鲁兰酶效果要稍好一些。未加酶制剂的样品挤出物中的淀粉含量均高于添加淀粉酶的样品。
%

表1 挤出机内淀粉含量沿螺杆的变化
注:处理条件A~F含义见试验方法1.2.3节,取样点1~6见图1,下同
Note: See section 1.2.3 for the meaning of treatment condition A-F, see Fig.1 for the meaning of sampling section 1-6, the same below.
对表1中淀粉含量进行方差分析,如表2所示,处理条件中<0.001,表明处理条件的变化对淀粉含量有极显著的影响。取样点的<0.001,表明取样点的不同对淀粉含量也有极显著的影响。从值可以看出,取样点对淀粉含量的影响要大于处理条件对淀粉含量的影响。进行多重比较时发现,A样品与B和E的<0.05,存在差异性;A与F的<0.01,差异显著。
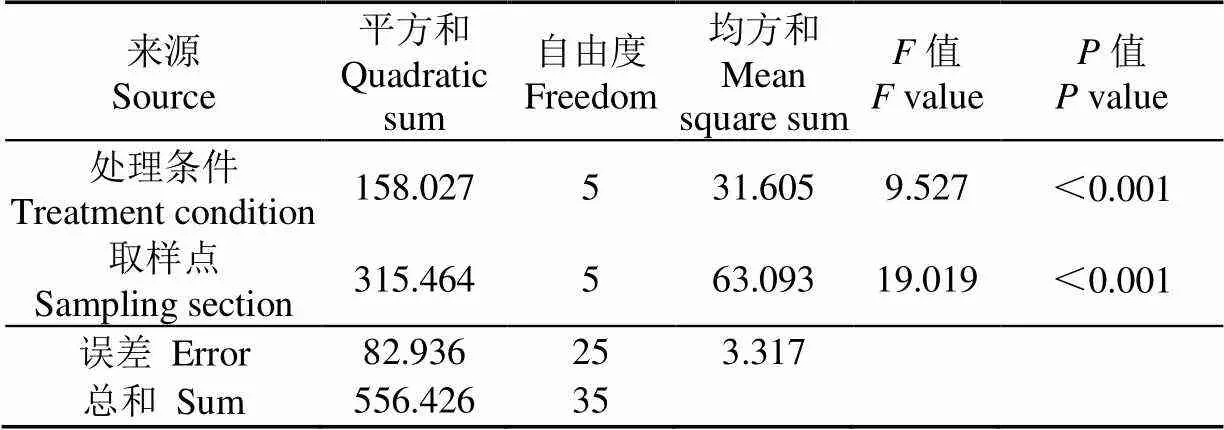
表2 淀粉含量方差分析
2.1.2 低温挤出过程中添加不同酶制剂对淀粉糊化度的影响规律
脱胚玉米经低温挤出处理,淀粉糊化度均有不同程度的提高[24]。加酶与不加酶以及加酶的种类均对挤出过程淀粉糊化产生影响。对于B、C、D、E样品,由于加入淀粉酶,在挤压机挤出过程中,已糊化的淀粉在淀粉酶的作用下部分发生水解,变成小分子物质。在使用酶法测定糊化度的过程中,已变成小分子的部分作为空白被扣除,使分子和分母的总量均变小,从表1中淀粉总量的减少和可溶性糖含量的增加均能说明这一现象,减少的程度随添加淀粉酶的种类不同而产生差异,表现出挤出物糊化度测定的量产生了不确定性,从这方面可以看出,对于添加淀粉酶的挤出物样品,糊化度并不是对挤压降解效果评价的较好指标。而添加蛋白酶的F样品由于挤出过程中对淀粉无水解作用,同时蛋白水解释放出更多的淀粉有利于挤出过程中的糊化作用,F样品糊化度最高,达到96.2%。表3为挤出机内淀粉糊化度沿螺杆的变化
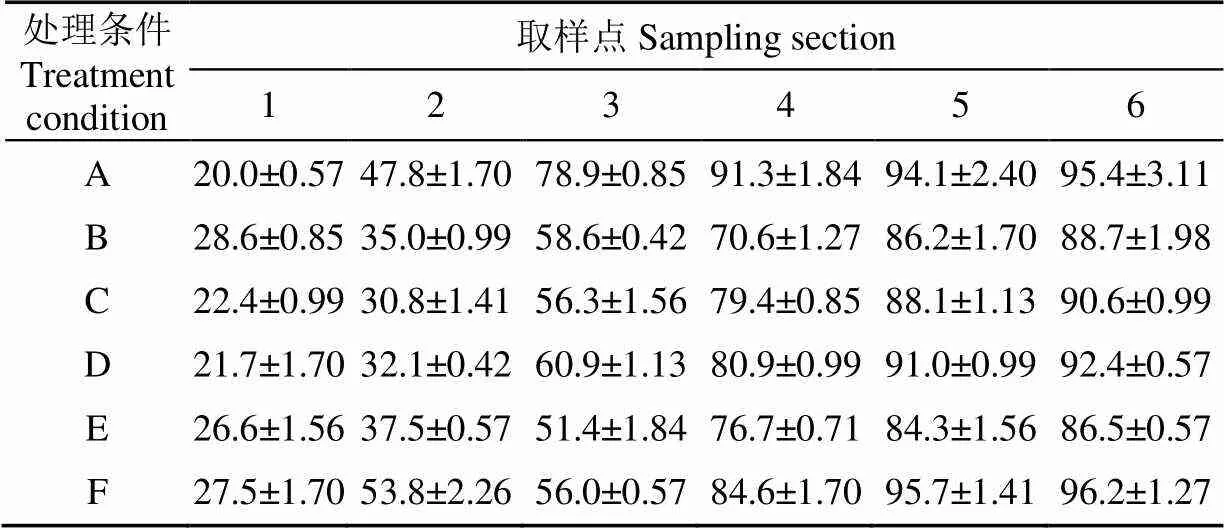
表3 挤出机内淀粉糊化度沿螺杆的变化
对表3中淀粉糊化度进行方差分析,如表4所示,处理条件中=0.007<0.01,表明处理条件的变化对淀粉糊化度有显著的影响。取样点的<0.001,表明取样点的不同对淀粉糊化度有极显著的影响。从值可以看出,取样点对淀粉糊化度的影响要大于处理条件对淀粉糊化度的影响。进行多重比较时发现,A样品与B、C、E的值均小于0.01,有显著性差异;A与D的=0.017<0.05,也存在差异性。也就是表明添加1种、2种和3种淀粉酶制剂的样品,经挤压后糊化度均与未加酶的样品存在明显的差异,而添加蛋白酶的样品F与未加酶的样品A对糊化度的影响无明显差异。

表4 淀粉糊化度方差分析
2.1.3 低温挤出过程中添加不同酶及其组合对可溶性糖的影响规律
脱胚玉米在挤出机内受到强的摩擦、破碎、剪切、熔融等机械作用力,淀粉链部分发生断裂,还原性末端增加,同时会有部分脱落形成小分子物质,可溶性糖类增加,添加酶制剂后这种现象更加明显。
从表5可以看出,脱胚玉米经挤出后可溶性糖均有所增加,但挤出过程中添加不同酶制剂,产生可溶性糖的量差异较大。不加酶的脱胚玉米可溶性糖变化最小,从喂料端的1.07%上升到出料端的2.26%,只上升了1.19个百分点。而加入糖化酶的脱胚玉米挤出过程中可溶性糖增加较多,从11.65%上升到14.71%,上升了3.06个百分点。尤以3种酶协同作用使淀粉降解最明显,产生的可溶性糖最多,从11.25%上升到16.35%,上升了5.1个百分点。另外,添加酶制剂的样品在喂料端未经挤出处理就具有了较高的可溶性糖,究其原因,可能是挤出前调整水分含量时补加一定量的水,同时加入酶制剂,为使原料水分分布均匀,需在室温条件下放置一定时间,在此期间以及取样测定之前,酶制剂缓慢作用于脱胚玉米中的淀粉,尤以糖化酶最为明显,使初始的可溶性糖含量增加。
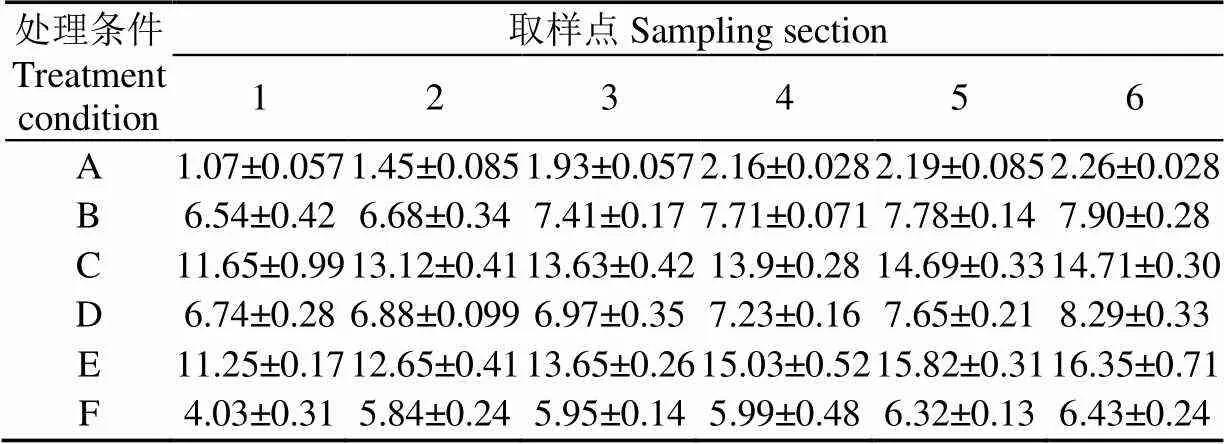
表5 挤出机内脱胚玉米可溶性糖沿螺杆的变化
对表5中可溶性糖含量进行方差分析,如表6所示,处理条件中<0.001,表明处理条件的变化对可溶性糖含量有极显著的影响。取样点的<0.001,表明取样点的不同对可溶性糖含量也有极显著的影响。从值可以看出,处理条件对可溶性糖含量的影响明显大于取样点对可溶性糖含量的影响。进行多重比较时发现,A样品与B、C、D、E、F的值均小于0.001,有极显著性差异。也就是说,挤出过程中酶的添加对可溶性糖的量产生了显著影响。同时,还可以看出对可溶性糖的影响,C和E大于B和D,B和D又大于A和F,由此可以看出,糖化酶的加入对可溶性糖的影响较大。
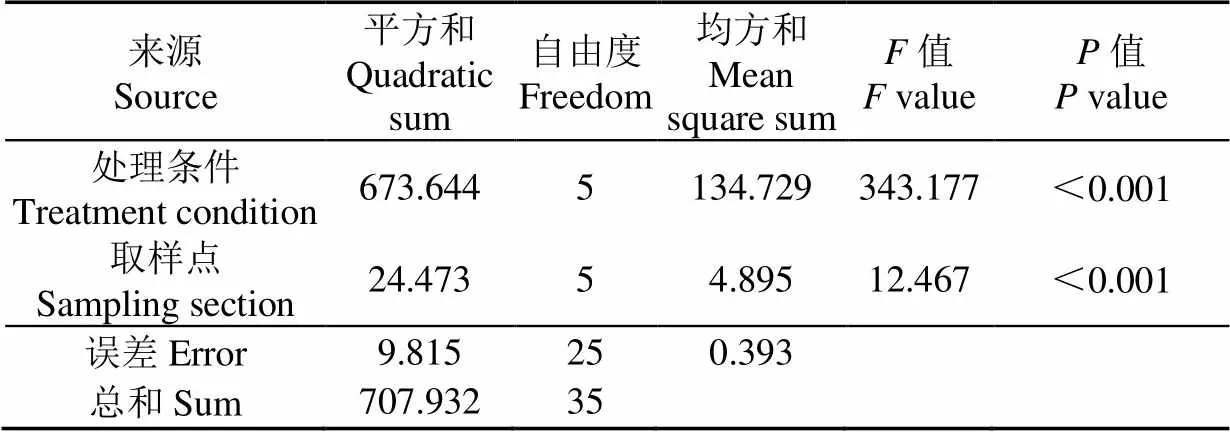
表6 可溶性糖含量方差分析表
添加酶的种类不同,相同挤出条件下产生的可溶性糖差异较大,这与酶作用于淀粉的方式有关[17],-淀粉酶属内切型淀粉酶,从淀粉分子内部随机作用于-1,4糖苷键,但水解位于分子中间糖苷键的概率远高于位于分子末端的-1,4糖苷键,在挤出机中较短的处理时间内,水解出来的单糖、双糖和低聚糖数量有限。而糖化酶水解淀粉时是从淀粉的非还原性末端依次水解-1,4糖苷键,切下葡萄糖单位,因此通过糖化酶的作用,挤出脱胚玉米中可溶性糖的含量明显增加,但对总淀粉影响较小。普鲁兰酶只水解淀粉链分支点处的-1,6糖苷键,在挤出机内作用较短时间的条件下,使可溶性糖含量增加的量相对少些。综合来看,E样品从1~6的挤出过程中可溶性糖含量增加最多,表明脱胚玉米中添加-淀粉酶+糖化酶+普鲁兰酶使淀粉降解的效果较好。挤出过程中,物料受到剪切力作用,首先剪切力破坏细胞壁[25],随后剪切力破坏淀粉颗粒、蛋白质颗粒,同时,伴随淀粉酶降解淀粉过程的进行,也伴随挤出过程中的部分淀粉酶失活[13]。已有研究表明,此时,剪切力仅使蛋白质的粒径以及疏水键和离子键的位置、状态发生变化[26-27],使它的水溶性、凝胶性、变性程度等发生变化,同时干法脱胚玉米中淀粉的含量、糊化度、可溶性糖等理化指标均会发生变化。研究表明,主要是由于剪切力破坏脱胚玉米细胞壁,同时对淀粉颗粒和蛋白质结构也产生影响。可以推测,随着剪切力破坏脱胚玉米细胞壁,细胞外面的水和酶制剂随之进入细胞中,在剪切力、热、水、酶制剂的作用下,淀粉颗粒被降解,剪切力破坏细胞中的网状蛋白质结构。
2.2 低温挤出过程中添加不同酶制剂对脱胚玉米籽粒细胞显微组织结构的影响
2.2.1 低温挤出过程中未添加酶制剂的脱胚玉米挤出过程的显微切片分析
脱胚玉米经挤出机处理,在挤出机套筒内表面与螺杆外表面形成的腔体间物料受机械剪切力作用,植物组织细胞结构会受到一定程度的破坏,从图2可以看出,喂料口处为原料脱胚玉米,A1中细胞紧密,结构完整,在第一阻流环处(A2)脱胚玉米受到的机械剪切力作用较弱,细胞结构有些破损,但尚不太明显。而在第二阻流环处(A3)细胞结构已出现明显的破坏。在模孔内侧细胞结构破坏程度进一步加剧(A4、A5)。随着脱胚玉米加入挤压机到从模孔排出,植物组织中规则网格状结构的数量逐渐减少,原有组织状态受到明显破坏,植物细胞壁破裂,细胞内的淀粉颗粒暴露出来,同时淀粉糊化度增大(见表3),条件适宜时更容易受到酶的作用。
玉米胚乳主要由蛋白质基质包埋的淀粉颗粒和细小蛋白颗粒组成。成熟的玉米胚乳由大量细胞组成,每个细胞都满载着深埋在蛋白质基质中的淀粉团粒,整个细胞内容物的外面是纤维细胞壁[28-29]。生产中对脱胚玉米前期进行预处理,就是采用一定的处理措施,破坏包含玉米淀粉颗粒的纤维细胞壁以及包裹着淀粉颗粒的蛋白质基质,尽可能多的将淀粉颗粒释放出来,同时在水、酶、热的作用下使淀粉吸水胀润,天然晶体结构发生变化,大分子打开,个别糖苷键断裂,淀粉发生糊化,有利于进一步对淀粉颗粒的水解作用。玉米胚乳经挤出处理后,纤维细胞壁破裂,释放出由蛋白质基质包埋的淀粉颗粒,部分淀粉发生降解。本试验通过显微制片技术找到挤出处理可以代替传统蒸煮糊化,用于发酵行业预处理工序的理论依据。

注:图中的绿色和蓝色线条代表细胞壁。
Note: The green and blue line in the picture represents the cell wall.
图2 脱胚玉米细胞壁切片图(100×)
Fig.2 Degermed corn cell wall section picture (100×)
图3中A1~A6是不添加酶制剂脱胚玉米在挤出机中1~6的取样点的样品石蜡显微切片,经革兰氏碘液对淀粉和蛋白质进行染色,碘遇淀粉为蓝色,遇蛋白质染为棕黄色,然后在显微镜下观察。从图中可以看出,喂料口处为原料脱胚玉米,A1中细胞结构完整,蛋白质基质包裹淀粉颗粒比较紧密,淀粉颗粒着色不明显,整个显微视野主要是蛋白质呈现的黄色。在第一阻流环处(A2)脱胚玉米受到的机械作用力较弱,细胞结构有些破损,部分淀粉颗粒溶出,染色后淀粉区域表现明显。而在第二阻流环处(A3)细胞结构进一步被破坏,淀粉区域互相连接,更加明显。在模孔内侧细胞结构破坏程度进一步加剧(A4、A5),淀粉裸露,反过来包围蛋白质基质。当物料从模孔排出时,由于减压后产生的膨化作用使物料的微观结构进一步破坏,从A6可以看出,细胞内的淀粉颗粒完全暴露出来,淀粉聚集体中夹杂着一点蛋白质基质,淀粉从81.5%降低到74.4%(见表1),糊化度从20%上升到95.4%(见表3),均说明在挤出过程中脱胚玉米细胞结构受到严重破坏,淀粉发生明显变性,这一系列的变化都有利于酶制剂的作用。
2.2.2 低温挤出过程中添加不同酶制剂的脱胚玉米挤出物显微切片分析
向脱胚玉米粉中添加-淀粉酶、糖化酶、普鲁兰酶及其组合,利用显微切片观察挤出后细胞结构的变化(见图2),添加的每一种酶制剂从挤出机中1~6点取样,均发现细胞结构的破坏由轻到重,图2中C、D添加2种酶细胞结构的破坏程度与B添加1种酶相比,能明显见到细胞壁破裂,淀粉颗粒存在于不完整的细胞中,表5中可溶性糖沿螺杆的变化情况也说明了这种现象。其中取样点6处可溶性糖样品C为14.71%,样品D为8.29%,高于样品B的7.9%;图2中样品E添加3种酶的作用挤出后对细胞壁破坏的更加严重,与添加2种酶相比,破损的细胞壁明显增多,可以看到碎裂的细胞壁残片,淀粉颗粒大部分游离出来。表1中样品E挤出物淀粉含量降低到所有样品中的最低值69.05%,表5中可溶性糖达到所有样品中的最大值16.35%,都说明了3种酶同时作用的效果在所测试的样品中是最好的。图4为脱胚玉米挤出物细胞成分分布(40×)

注:图中黄色为蛋白质,蓝色为淀粉,下同。

图4 脱胚玉米挤出物细胞成分分布(40×)
脱胚玉米加入酶制剂以后进行挤压处理,从显微切片上观察蛋白质和淀粉分布的变化,与细胞结构的变化趋势相同,从图4可以看出,经挤压处理后原脱胚玉米蛋白质和淀粉的分布从图3中A1的状态发生变化,染色后蓝色区域面积加大,添加2种酶的图4中的C6、D6的细胞壁破坏,淀粉集聚,蓝色面积中只有少量染成黄棕色的蛋白质,而添加1种酶的图4中B6和F6黄色面积较多,添加3种酶的图4中E6几乎都是蓝色,淀粉着色明显,细胞受到破坏较严重。从糊化度(表3)和可溶性糖(表5)的变化可以看出,加入1种酶(-淀粉酶)不如2种酶(-淀粉酶和糖化酶或者-淀粉酶和普鲁兰酶)在挤出过程中对淀粉的作用效果,而同时添加3种酶(-淀粉酶、糖化酶、普鲁兰酶)效果更加明显。蛋白质基质结构完全受到破坏,淀粉也已充分糊化。这种状态下的淀粉更容易受到酶的作用。
2.2.3 低温挤出过程中添加中性蛋白酶的脱胚玉米挤出物显微切片分析
由于玉米籽粒中胚乳部分淀粉颗粒外部包围着蛋白质基质,为了提高在挤出过程中对蛋白质基质的破坏程度,考虑在挤出前添加中性蛋白酶,考察其对蛋白质基质酶解的效果,是否对淀粉的利用产生影响。添加中性蛋白酶后的挤出物如图2中F、图3中F所示。
从图2中F、图3中F可以看出,挤出前物料中加入中性蛋白酶对脱胚玉米胚乳中蛋白质基质的网状结构和蛋白质分布产生影响。其网状结构发生破坏,但程度较轻,仍保留原有的结构分布,在网状结构的壁面处可见小的裂痕,淀粉颗粒在细胞中心处变化不明显。挤压过程使蛋白质分子内疏水基暴露,蛋白质交联[30],结合表1和表3的测定数据,可以看出添加中性蛋白酶后对胚乳中总淀粉降解影响不大,网状结构破坏有限,但淀粉已充分糊化。从表5的数据可以看出,添加3种淀粉酶的可溶性糖含量最高,达16.35%,而添加中性蛋白酶的只有6.43%。由此可见,挤出前是否添加蛋白酶对脱胚玉米原料中淀粉的利用没有明显的影响。
2.3 经济效益分析
低温挤出酶解干法脱胚玉米挤出物生产玉米淀粉糖浆技术,可应用在葡萄糖、麦芽糖、果糖的生产中,还可以应用在柠檬酸、谷氨酸等有机酸、氨基酸的生产中,现以生产柠檬酸为例,说明低温挤出酶解干法脱胚玉米挤出物代替玉米原粮生产柠檬酸的经济效益,本项目技术省去现有技术的喷射液化过程,使玉米原粮中的皮层、胚芽、胚乳等主要组分,经分离分别使用,提高了玉米原粮主要组分的经济效益。试验结果表明,低温挤出加酶干法脱胚玉米挤出物可以代替玉米原粮生产柠檬酸,且省去现有技术的喷射液化过程,使淀粉转化成葡萄糖的收得率提高至105%左右。初步分析表明:低温挤出加酶干法脱胚玉米挤出物生产柠檬酸与现有技术的玉米原粮生产柠檬酸相比,生产1 t柠檬酸,低温挤出加酶干法脱胚玉米挤出物比玉米原粮成本减少1 367.78元/t。然而,尚需进行发酵罐试验和生产中试验证[31]。
3 结 论
1)对脱胚玉米挤出过程中总淀粉含量、糊化度、可溶性糖进行测定,在挤出过程中,挤出物中大分子淀粉受到较强的机械剪切作用力,会有部分产生断裂,淀粉发生糊化和降解,使表观淀粉质量分数减少,从81.50%减少到74.40%,可溶性糖质量分数增加,从1.07%增加到2.26%,挤出过程中加入酶制剂后这种效果更加明显。其中以添加-淀粉酶、糖化酶、普鲁兰酶3种酶混合时变化最大,淀粉减少到69.05%,可溶性糖质量分数增加到16.35%。由此可见,3种酶(-淀粉酶、糖化酶、普鲁兰酶)协同作用对淀粉降解的效果以及可溶性糖含量的增加优于单一酶(-淀粉酶)和2种酶(-淀粉酶+糖化酶,或者-淀粉酶+普鲁兰酶)的作用效果。
2)通过石蜡显微切片技术,观察低温挤出-多酶协同降解处理的脱胚玉米显微切片,可以看出挤出过程中不加酶低温挤出脱胚玉米细胞结构有明显破坏,细胞内淀粉颗粒大部分释放出来,这也是通过挤压技术使淀粉发生一系列变化的根本原因,有利于对淀粉的酶解处理。而挤出过程中添加酶制剂后脱胚玉米细胞结构破坏的更加彻底。其中添加2种酶(-淀粉酶+糖化酶)优于添加1种酶(-淀粉酶)的效果,但仍不如添加3种酶(-淀粉酶+糖化酶+普鲁兰酶)协同作用的效果。
3)挤出过程中,物料受到机械剪切力作用,首先剪切力破坏细胞壁,随后剪切力破坏细胞中的淀粉颗粒、蛋白质颗粒的粒径,剪切力破坏细胞中的网状蛋白质结构,同时,伴随淀粉酶降解淀粉的过程发生,部分淀粉酶也在失活,研究表明,此时,剪切力仅使蛋白质的粒径及疏水键和离子键的位置、状态发生变化,使它的水溶性、凝胶性、变性程度等发生变化。前人和本文的试验结果表明:挤出过程中,剪切力破坏脱胚玉米细胞壁,以及细胞中的淀粉颗粒,在适量水的条件下,酶制剂降解淀粉,干法脱胚玉米中淀粉的含量、糊化度、可溶性糖等理化指标均会发生变化,可见,随着剪切力破坏脱胚玉米细胞壁,细胞外的水和酶制剂随之进入细胞中,在剪切力、水、酶制剂的作用下,淀粉颗粒被降解。
4)挤出前脱胚玉米中添加3种酶制剂挤出物的可溶性糖含量,明显高于添加中性蛋白酶的可溶性糖的含量,可见,挤出过程中添加中性蛋白酶,对脱胚玉米胚乳中总淀粉降解影响不大,且细胞中蛋白基网状结构破坏有限。
致谢:感谢东北农业大学李明教授在植物显微技术方面给予的指导。感谢河北农业大学、烟台大学和山东理工大学为本论文的完成提供的支持和帮助。
[1] 于远洋. 玉米淀粉糖生产关键酶系的优化[D]. 长春:吉林大学,2016.
Yu Yuanyang. Optimization of Key Enzymes in Corn Starch Sugar Production[D]. Changchun: Jilin University, 2016. (in Chinese with English abstract)
[2] 文方,彭金龙,肖蒙. 玉米淀粉与大米混合原料黄酒酿造工艺的研发[J]. 酿酒科技,2017(10):31-34.
Wen Fang, Peng Jinlong, Xiao Meng. Yellow rice wine production by mixed corn starch and rice[J]. Liquor-making science & Technology, 2017(10): 31-34. (in Chinese with English abstract)
[3] 才源. 半干法玉米淀粉糖生产关键技术的研究[D]. 长春:吉林农业大学,2008.
Cai Yuan. The Research on Semi-Dry Corn Starch Sugar Production of Key Technologies[D]. Changchun: Jilin Agricultural University, 2008. (in Chinese with English abstract)
[4] 肖志刚,申德超,吴谋成,等. 挤压预处理与喷射液化生产葡萄糖的对照研究[J]. 粮食与食品工业,2008,15(1):28-32.
Xiao Zhigang, Shen Dechao, Wu Moucheng, et al. Comparison between extrusion pretreatment and spray liquefaction of glucose production[J]. Cereal and Food Industry, 2008, 15(1): 28-32. (in Chinese with English abstract)
[5] 林雅丽,张晖,王立,等. 挤压对糙米中淀粉理化性质的影响[J]. 现代食品科技,2016,32(12):254-259,224.
Lin Yali, Zhang Hui, Wang Li, et al. Effect of extrusion on the physicochemical properties of starch in brown rice[J]. Modern Food Science and Technology, 2016, 32(12): 254-259, 224. (in Chinese with English abstract)
[6] 周星杰,余少璟,陈凯,等. 挤压糊化处理对苦荞粉理化性质的影响[J]. 食品科学,2018,39(11):101-106.
Zhou Xingjie, Yu Shaojing, Chen Kai, et al. Effect of gelatinization by extrusion on physicochemical properties of tartary buckwheat flour[J]. Food Science, 2018, 39(11): 101-106. (in Chinese with English abstract)
[7] 章丽琳,张喻,张涵予. 挤压膨化参数对马铃薯全粉理化性质的影响[J]. 食品与机械,2016,32(12):40-44.
Zhang Lilin, Zhang Yu, Zhang Hanyu. Effects of different extrusion conditions on physicochemical properties of potato powder[J]. Food & Machinery, 2016, 32(12): 40-44. (in Chinese with English abstract)
[8] 马成业,李宏军,陈善峰,等. 脱胚玉米和淀粉挤出物中淀粉-脂热特性分析[J]. 中国粮油学报,2013,28(7):23-28.
Ma Chengye, Li Hongjun, Chen Shanfeng, et al. DSC analysis of starch-lipids complex in extruded corn starch of degermed corn[J]. Journal of the Chinese cereals and oils Association, 2013, 28(7): 23-28. (in Chinese with English abstract)
[9] Mercier C, Linko P, Harper J M. Extrusion Cooking[M]. USA: American Association of Cereal Chemists ,Inc. St. Paul, Minnesota, 1989: 230-241.
[10] Vasanthan T. , Yeung J. , Hoover R. Dextrinization of starch in barley flours with thermostable alpha-Amylase by extrusion cooking[J]. Starch, 2001, 53(12): 616-622.
[11] 冉旭,李玲玲,蒋林茂. 挤压加工条件对玉米淀粉酶转化程度的影响[J]. 粮食与饲料工业,2006(7):23-25.
Ran Xu, Li Lingling, Jiang Linmao. Influence of extrusion conditions on conversion extent of corn amylase[J]. Cereal & Feed Industry, 2006(7): 23-25. (in Chinese with English abstract)
[12] 孙于庆,冉旭. 麦芽糊精挤压生产的试验研究[J]. 食品科技,2006(10):123-125,137.
Sun Yuqing, Ran Xu. Research of production of maltodextrin by extrusion[J]. Food Science and Technology, 2006(10): 123-125, 137. (in Chinese with English abstract)
[13] 奚可畏. 挤压蒸煮玉米淀粉、脱胚玉米制取葡萄糖浆的试验研究[D]. 哈尔滨:东北农业大学,2007.
Xi Kewei. The Study of Producing Glucose Syrup With Extruded Corn Starch and Degermed Maize[D]. Harbin: Northeast Agricultural University, 2007. (in Chinese with English abstract)
[14] 李宏军,申德超. 外加酶对膨化大米辅料麦汁还原糖含量的影响[J]. 食品科技,2009,34(11):144-146,151.
Li Hongjun, Shen Dechao. Effect of additional enzymes on the reducing sugar content of wort by using extruded rice as auxiliary materials in beer brewing[J]. Food Science and Technology, 2009, 34(11): 144-146, 151. (in Chinese with English abstract)
[15] 陈善峰. 低温加酶挤压大米做啤酒辅料的试验研究[D]. 保定:河北农业大学,2012.
Chen Shanfeng. The Experimental Study on Rice Added With Enzymes Extruded at Low Temperature Used as Beer Adjunct[D]. Baoding: Hebei Agricultural University, 2012. (in Chinese with English abstract)
[16] 潘小卫. 加酶挤压高粱酿造小曲白酒的研究[D]. 无锡:江南大学,2017.
Pan Xiaowei. Study on Enzymatic Extrusion Pretreatment of Sorghum for Xiaoqu Liquor Brewing[D]. Wuxi: Jiangnan University, 2017. (in Chinese with English abstract)
[17] 姜锡瑞,段纲. 新编酶制剂实用技术手册[M]. 北京:中国轻工业出版社,2003.
[18] 申勋业,申勋宇,申德超. 一种低温挤出——多酶协同降解的物料预处理方法:CN201610219779.5 [P]. 2016-04-11
[19] 马成业. 低温挤压添加淀粉酶的脱胚玉米生产糖浆的糖化试验研究[D]. 哈尔滨:东北农业大学,2010.
Ma Chengye. Saccharification Experiment Study on Degermed Corn Added With Amylase Extruded at Low Temperature for Production Syrup[D]. Harbin: Northeast Agricultural University, 2010. (in Chinese with English abstract)
[20] 李素坤,张秋芝,郝玉兰,等. 玉米成熟期茎秆石蜡切片方法的研究[J]. 安徽农业科学,2010,38(8):3935-3937.
Li Sukun, Zhang Qiuzhi, Hao Yulan, et al. Research on the method of paraffin section of the corn stak in its maturity stage[J]. Journal of Anhui Agricultural Science, 2010, 38(8): 3935-3937. (in Chinese with English abstract)
[21] 赵凌霄. 禾谷类成熟完整籽粒切片技术及其在玉米颖果淀粉研究中的应用[D]. 扬州:扬州大学,2019
Zhao Lingxiao. Section Methods for Cereal Mature Whole Kernel and Their Application in Investigation of Starch in Maize Caryopsis[D]. Yangzhou: Yangzhou University, 2019. (in Chinese with English abstract)
[22] 王永华,戚穗坚. 食品分析(第三版)[M]. 北京:中国轻工业出版社,2017:114-122.
[23] 王肇慈. 粮油食品品质分析[M]. 北京:中国轻工业出版社,2000: 112-114.
[24] 王庆,张光,杨春华,等. 挤压膨化对大米粉糊化度及蛋白质体外消化率的影响[J]. 食品工业科技,2017,38(7):230-234.
Wang Qing, Zhang Guang, Yang Chunhua, et al. Effect of extrusion on gelatinization degree and protein digestibility of rice flour[J]. Science and Technology of Food Industry, 2017, 38(7): 230-234. (in Chinese with English abstract)
[25] 贾富国,申德超. 大豆挤压膨化物显微结构的研究[J]. 中国粮油学报,2000,15(1):30-32.
Jia Fuguo, Shen Dechao. Study on microstructure of extruded soybeans[J]. Journal of the Chinese Cereals and Oils Association, 2000, 15(1): 30-32. (in Chinese with English abstract)
[26] 陈玉芳. 大豆挤压膨化浸油的试验研究[D]. 哈尔滨:东北农业大学,1998.
[27] 金长江. 挤压大豆浸油预处理工艺及粕蛋白提取的试验研究[D].哈尔滨:东北农业大学,1998.
[28] 周显青. 玉米胚乳的特性及其应用[J]. 粮食与饲料工业,1998(10):40-41.
Zhou Xianqing. Properties and applications of corn endosperm[J]. Cereal & Feed Industry, 1998(10): 40-41. (in Chinese with English abstract)
[29] 王忠,顾蕴洁,王慧慧,等. 关于玉米胚乳细胞发育的研究[EB/OL]. 北京:中国科技论文在线[2012-09-10].http://www.paper.edu.cn/releasepaper/content/2012-09-77.
[30] 徐红华,申德超. 不同挤压参数对大豆粕蛋白质结构的影响[J]. 农业工程学报,2007,23(7):267-271.
Xu Honghua, Shen Dechao. Effects of extrusion parameters on the structure of soybean meal proteins[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2007, 23(7): 267-271. (in Chinese with English abstract)
[31] 申德超.我国柠檬酸产业发展中不容忽视的问题:玉米原粮中的淀粉转化率亟待提高[C]//上海:2015中国生物发酵产业协会: 46-53.
Mechanism of starch degradation of corn grist degermed by extruded at low-temperature and multienzyme synergistic degradation
Ye Xiangku1,2, Shen Dechao3
(1.,,071001,; 2.,,264005,; 3.,,255091,)
In order to improve the conversion rate of starch to glucose, an enzyme (-amylase) was added to amylopectin by changing the-1,6-glycoside bond in amylopectin by extrusion enzymatic hydrolysis technology, and the microstructure of paraffin section was introduced. Low temperature (≤80 ℃) extrusion, multi-enzyme (-amylase, glucoamylase, pullulanase) synergistic degumming preparation. The distribution of protein granules and starch granules and the main physicochemical indexes of starch degradation in cells were observed. The results showed that starch content decreased from 81.50% to 74.40% and soluble sugar content increased from 1.07% to 2.26% during extrusion. The change of enzymatic extrusion process was more obvious. By adding-amylase, starch content decreased from 79.72% to 69.16%, soluble sugar content increased from 6.54% to 7.90%. By adding-amylase and glucoamylase, the starch content decreased from 81.42% to 72.45%, and the soluble sugar content increased from 11.65% to 14.71%. By adding-amylase and pullulanase, starch content decreased from 81.31% to 70.31%, soluble sugar content increased from 6.74% to 8.29%. By adding-amylase, glucoamylase and pullulanase, the starch content decreased from 81.06% to 69.05%, and the soluble sugar content increased from 11.25% to 16.35%. The results of microsection showed that the degradation degree of starch granules in the three enzymes was better than that of one (-amylase) or two enzymes (-amylase, glucoamylase or-amylase, pullulanase). The results showed that starch content decreased, soluble sugar content increased and gelatinization degree increased in degummed maize by low temperature enzymatic extrusion. At the same time, the effect of adding three enzymes (-amylase, glucoamylase and pullulanase) on starch degradation was better than adding one enzyme (-amylase) or two enzymes (-amylase, glucose- amylase or-amylase, pullulanase). These results provide useful data for improving starch utilization.
extrusion; enzyme; starch; degermed corn; cell structure; protein; physicochemical index
2019-01-04
2019-06-23
山东理工大学创新团队4080-108001;横向课题基金9194-10907701和淄博汇创生物科技有限公司提供的项目经费资助。
叶向库,博士生,研究方向为农产品精深加工。Email:yexk@163.com
申德超,教授,博士生导师,主要从事农产品挤压膨化工艺和设备的教学和科学研究。Email:shendc@126.com
10.11975/j.issn.1002-6819.2019.14.036
TS210
A
1002-6819(2019)-14-0291-09
叶向库,申德超. 低温挤出-多酶协同降解脱胚玉米中淀粉的机理[J]. 农业工程学报,2019,35(14):291-299. doi:10.11975/j.issn.1002-6819.2019.14.036 http://www.tcsae.org
Ye Xiangku, Shen Dechao. Mechanism of starch degradation of corn grist degermed by extruded at low-temperature and multienzyme synergistic degradation[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(14): 291-299. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2019.14.036 http://www.tcsae.org

