猪链球菌4型转录调控因子GalR的生物学特性
孙珂,祝昊丹,何孔旺,王丹丹,周俊明,俞正玉,吕立新,倪艳秀
猪链球菌4型转录调控因子GalR的生物学特性
孙珂1,2,祝昊丹1,何孔旺1,王丹丹1,周俊明1,俞正玉1,吕立新1,倪艳秀1
(1江苏省农业科学院兽医研究所,南京 210014;2吉林农业大学动物科学技术学院,长春 130118)
【】研究分析猪链球菌4型(serotype 4,SS4)强毒株SH1510 转录调控因子GalR基因的缺失对细菌生物学特性的影响,为进一步研究GalR对半乳糖代谢途径的调控及其致病机理提供理论依据。利用同源重组双交换的方法构建了SS4强毒株SH1510 转录调控因子GalR基因缺失株SH1510Δ,通过GalR基因内部扩增引物I1/I2进行缺失株初步筛选,进一步通过PCR和Western blotting鉴定缺失株SH1510Δ。对亲本株SH1510和缺失株SH1510Δ进行革兰氏染色以比较形态差异;配置基础培养基,分别加入葡萄糖、蔗糖、D-半乳糖后培养细菌,绘制细菌生长曲线,比较细菌对不同糖的利用率;将亲本株和缺失株的菌液浓度分别调整为2.5×109、5×108、1×108、2×107CFU/mL,对BALB/c小鼠进行腹腔注射以观察小鼠致死率并使用Reed-Muench法计算菌株LD50。将浓度为2×107CFU/mL的亲本株和缺失株1﹕1等体积混合后腹腔注射BALB/c小鼠,24 h后取脑、脾、血在氯霉素抗性和无抗性THB平板上进行细菌计数,比较细菌在小鼠体内的定植能力;并以健康猪的全血模仿体内环境,将亲本株和缺失株分别加入含有SS4抗血清的健康猪全血中,37℃孵育2 h进行平板计数,比较细菌在全血中的存活能力。使用内部检测引物I1/I2做PCR,缺失株SH1510Δ检测为阴性,进一步使用引物C1/C2、O1/C2、O2/C1、O1/O2鉴定缺失株SH1510Δ,分别扩增出1 056、2 121、2 094、3 147 bp的片段,结果和预期相符。Western blotting 鉴定结果表明亲本株SH1510可与粗制GalR多抗兔血清发生特异性结合,在37 kD处出现单一条带,但缺失株SH1510Δ没有条带出现。PCR和Western blotting鉴定结果均表明缺失株SH1510Δ已构建成功。亲本株和缺失株经革兰氏染色,光学显微镜下观察可见亲本株和缺失株均呈链状排列,长度相似,形态无显著差异。在葡萄糖和蔗糖作为唯一糖原的生长条件下,亲本株和缺失株的生长情况相仿,而当糖原为D-半乳糖时,缺失株的生长速率和OD600值明显低于亲本株。另外,从最高OD600值可以看出,猪链球菌SH1510对糖的利用率为葡萄糖>蔗糖>D-半乳糖。 小鼠致病性试验中,亲本株和缺失株的LD50分别为1×108CFU和1.62×108CFU,缺失株对小鼠的致病性下降了1.62倍。体内竞争感染试验结果显示,缺失株在小鼠的脑、脾、血液中的细菌分离数均远低于亲本株,差异极显著(<0.01)。全血存活试验表示,亲本株的存活率为35.2%,缺失株的存活率为27.3%,缺失株SH1510Δ比亲本株SH1510在全血中的存活率显著下降(<0.05)。GalR 基因可促进猪链球菌4型对半乳糖的利用,同时对SH1510的毒力有直接或间接的调控作用。
猪链球菌4型;GalR;生物学特性;毒力
0 引言
【研究意义】细菌对环境的改变必须做出迅速的反应,营养的供给随时都可以发生变化,反复无常,要能得以幸存必需具有可以变换不同代谢底物的能力,细菌代谢与调控型因子可以让细菌更好的应对环境变化,帮助细菌生存和感染,所以对细菌代谢调控基因的研究有利于细菌致病机制的阐明。【前人研究进展】猪链球菌()是一种重要的猪病原菌,可导致猪关节炎、败血症、心内膜炎、脑膜炎、肺炎等病症,也可导致畜牧与兽医相关从业人员的发病及死亡[1-3]。根据细菌荚膜抗原,猪链球菌可分为33个血清型(1-31型,33型和1/2型),其中,猪链球菌2型被公认为是致病性最强血清型[4-6]。另外,在亚洲国家也经常出现3,4,5,7,8,1/2血清型[7-10];加拿大经常分离出3,4,8,22,1/2血清型[11]。猪链球菌4型(type 4,SS4)也是一种致病血清型,可导致人和动物发病甚至死亡。1968—1984年,荷兰分离出30株引起人脑膜炎的猪链球菌菌株,其中1株为SS4[12]。2009—2012年,泰国在患有猪链球菌病的人群中分离出了668株猪链球菌,血清型比例SS4为0.15%[13]。2001年,HAN于韩国不同生猪屠宰场406份扁桃体中分离出55株猪链球菌,SS4占5.5%[14]。PRUFER[15]将1996—2016年间从德国分离的711株猪链球菌进行血清学分型,结果1996—2004年间的189株分离株中出现19个猪链球菌血清型,其中SS4占10%;2015—2016年间的522株分离株中出现23个猪链球菌血清型,SS4占10.3%;将研究结果与猪链球菌的临床背景联系起来,SS4经常分离自具有呼吸道疾病和中枢神经系统疾病的患病猪,证明SS4可引起肺病和脑膜炎;将结果与毒力因子结合分析,SS4分离菌株高频率携带毒力因子mrp和sly。CHATURVEDI[16]等用4周龄仔猪为动物模型评价SS4的毒力,结果导致仔猪死亡。近几年来,在中国健康猪场和发病猪场均经常分离到SS4,且分离率逐渐上升[17],王娟[18]对2011—2014年间在广东省不同地区发病猪场分离的58株猪链球菌进行血清学分型,SS4血清型比例为3.45%。周明瑶[19]在苏南地区某健康猪场80份鼻拭子中检测到猪链球菌4型竟高达46.25%,这证明猪链球菌4型在我国某些地区已成为优势血清型,严重威胁猪群健康。当前,国内外对猪链球菌的研究主要集中在猪链球菌2型上[20],对SS4的研究较少,范围仅限于血清型分型PCR鉴定,对SS4毒力因子的研究还没有报道。江苏省农业科学院畜牧兽医研究所实验室前期通过比较蛋白组学分析猪链球菌4型强弱毒株的菌体蛋白表达谱,筛选到了16个差异表达蛋白,其中包括转录调控因子。GalR是参与半乳糖转运和代谢的调控蛋白[21]。在大肠杆菌中,GalR可调控D-半乳糖代谢途径相关基因galETKM、galP、galS、mglBAC的转录[22]。肺炎链球菌中,在半乳糖作为糖源的生长环境下,是维持正常生长所必须的基因,转录因子可作为的转录激活因子,促进半乳糖的代谢[23]。【本研究切入点】GalR蛋白是SS4强弱毒株中显著差异表达蛋白之一,推测其可能与SS4的致病性相关。因此,通过同源重组的方法构建了SS4强毒株SH1510的GalR基因缺失株SH1510Δ,对其生物学特性进行比较,包括细菌的形态、生长特性、糖的利用率、在猪全血中的存活能力及对BALB/c小鼠的致病性。【拟解决的关键问题】转录调控因子对猪链球菌4型强毒株SH1510半乳糖代谢及毒力的影响。
1 材料与方法
试验于2017年12月至2018年12月在江苏省农业科学院兽医研究所完成。
1.1 菌种和质粒
猪链球菌4型强毒株SH1510,2015年分离自上海病猪肺脏,由江苏省农业科学院兽医研究所保存。pR326质粒(氯霉素抗性)由江苏省农业科学院兽医研究所试验室保存。温敏性自杀质粒pSET4s(猪链球菌-大肠杆菌穿梭质粒,壮观霉素抗性)由Takamatsu[24]惠赠。缺失株SH1510Δ(氯霉素抗性)自建。大肠杆菌DH5α化学感受态细胞购自南京诺唯赞生物科技有限公司。
1.2 培养基
THB液体培养基按照说明书,3%THB粉状成品配制;THB固体培养基是在THB液体培养基的基础上加入1.5%的琼脂粉制成。THY液体培养基是在THB液体培养基的基础上加入2%的酵母提取物制成。基础培养基配方为5.0 g·L-1氯化钠、2.5 g·L-1磷酸氢二钠、3.5%胰蛋白胨、0.04 g·L-1对氨基苯甲酸、0.2 g·L-1VB1、0.2 μg·L-1VB2、1 μg·L-1VB3。
1.3 主要试剂与仪器
PCR Thermal Cycler Dice TP-600 ( 日本Takara );THB(美国BD公司);2 x Taq PCR Mix、DL 2000 marker、DL 5000 marker(东盛生物科技有限公司); MiniBEST DNA Fragment Purification ( 日本Takara );DNA Ligation Kit(日本Takara)。
1.4 引物
试验所设计的引物序列详情见表1。L1/L2,R1/R2分别扩增GalR编码基因的上下游同源臂基因序列;C1/C2扩增氯霉素抗性基因;I1/I2 扩增GalR基因的ORF内部基因序列(用于缺失株的初步筛选);在GalR基因上下游同源臂外部设计一对引物O1/O2,扩增包括GalR基因、上下游同源臂基因及其外部的一段基因序列的总长(用于外部检测)。

表1 引物序列
1.5 缺失株SH1510ΔGalR的构建
1.5.1 基因缺失质粒pSET4s::GalR的构建 基因缺失质粒pSET4s::GalR的构建如图1所示,使用引物L1/L2、R1/R2及SH1510 DNA模板扩增出GalR编码基因的上下游同源臂基因,使用引物C1/C2及pR326质粒为模板扩增氯霉素抗性基因。各扩增产物使用MiniBEST DNA Fragment Purification进行纯化回收,通过限制性内切酶对纯化后的DNA片段进行酶切,然后将酶切后的各产物进行纯化。最后利用DNA Ligation Kit,将3个片段以上游同源臂、氯霉素抗性基因、下游同源臂的顺序依次连接到pSET4s载体上,其间每一步通过转化进大肠杆菌DH5α进行大量克隆。每一步连接过后的质粒送上海英潍捷基生物有限公司进行测序,以确保质粒构建的准确性。
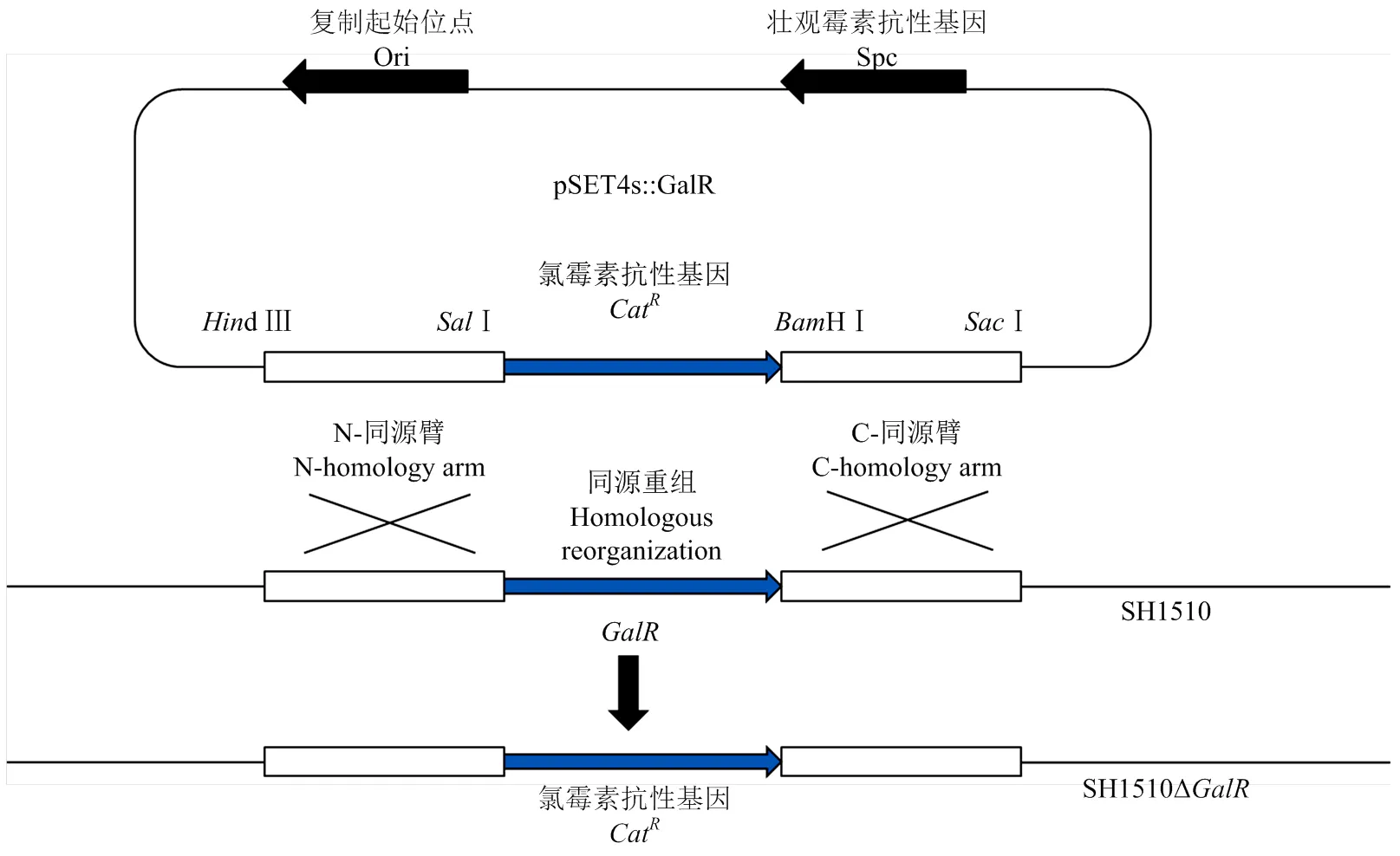
图1 SH1510ΔGalR缺失株的构建示意图
1.5.2 电转化 本试验参照Takamatsu的方法制备SH1510感受态细胞[24]。分别取4、5、6、7、8 μL pSET4s::GalR缺失质粒加入80 μL SH1510感受态细胞轻柔混匀,将混合物转移进已预冷的电击杯当中,冰浴30 min, 然后进行电转化,电转参数为2.35 kV·cm-1、200 Ω和25 μF,加入900 μL THY液体培养基吹打混匀,将混合物转移至3 mL THY液体培养基中,28℃摇床培养至OD600为0.4左右,吸取100 μL菌液涂布于双抗THY平板(壮观霉素100 μg·mL-1,氯霉素12.5 μg·mL-1),28℃培养24 h后挑单菌于5 mL THY液体培养基(氯霉素12.5 μg·mL-1)中,菌液生长至OD600值为0.4左右,转移试管于37℃摇床继续培养4—6 h,菌液倍比稀释后涂布于单抗THY平板(氯霉素12.5 μg·mL-1),37℃培养24 h。
1.5.3 缺失株的筛选与鉴定 挑取200个单菌进行增菌培养,吸取1 mL菌液制成DNA模板,使用内部检测引物I1/I2进行缺失株初步筛选,鉴定为阴性的菌株,进一步使用引物C1/C2,O1/C2,O2/C1,O1/O2进行鉴定,并将扩增的阳性片段送上海英潍捷基生物有限公司测序,测序结果通过比对进行验证。
1.5.4 Western blotting 鉴定 将亲本株SH1510和缺失株SH1510Δ按2%比例接种进3 mLTHB液体培养基,过夜培养后,8 000 r/min离心 10 min,弃上清,菌体沉淀使用100 μLPBS重悬,加入25 μL蛋白上样缓冲液,100℃煮沸10 min,进行SDS-PAGE。半干转印法转移蛋白至PVDF膜,5%脱脂乳进行过夜封闭,次日弃掉脱脂乳,TBST洗涤4次,粗制GalR多抗兔血清(1﹕400)为一抗,室温孵育2 h,TBST洗涤4次,HRP-羊抗兔IgG(1﹕10 000)为二抗,室温孵育1 h,TBST洗涤4次,ECL显色。
1.6 革兰氏染色
将冻存的亲本株SH1510和缺失株SH1510Δ平板划线进行复苏,挑取亲本株和缺失株的单菌落分别接种于THB肉汤中,200 r/min,37℃振荡培养至对数生长期,将亲本株SH1510和缺失株SH1510Δ进行涂片、革兰氏染色和镜检,在油镜镜头下观察并比较两株菌的形态。
1.7 不同糖利用率的比较
参照文献[25]的方法配制基础培养基,试验配制六瓶基础培养基,两瓶为一组,分别加入10 mmol·L-1葡萄糖、蔗糖和D-半乳糖。复苏细菌,挑取亲本株SH1510和缺失株SH1510Δ的单菌落分别接种于THB肉汤中,200 r/min,37℃振荡培养至OD600=0.7,12 000 r/min离心10 min,弃上清,用灭菌生理盐水洗涤菌体2次,等体积重悬细菌。将亲本株和缺失株的菌液按1%的比例加入3组培养基中,每隔1 h,测定OD600值,直到细菌OD600值到达稳定方可停止,试验重复3次,计算每小时OD600平均值以绘制生长曲线。
1.8 小鼠致病性试验
细菌经复苏后,挑取亲本株SH1510和缺失株SH1510Δ的单菌落分别接种于THB肉汤中,200 r/min,37℃振荡培养至对数生长期,12 000 r/min离心10 min,弃上清,用灭菌生理盐水洗涤菌体2次,调整菌液浓度为2.5×109、5×108、1×108、2×107CFU/mL。将BALB/c 小鼠随机分成8组,每组10只,每只小鼠腹腔注射1 mL菌液;另设对照组10只,每只腹腔注射1 mL无菌生理盐水。注射后每天观察并记录小鼠的临床表现和死亡情况,连续观察7 d。用Reed-Muench法计算出菌株对BALB/c 小鼠的LD50。
1.9 体内竞争感染试验
根据上述方法将亲本株SH1510和缺失株SH1510Δ的菌液浓度均调整为2×107CFU/mL。按照1﹕1的比例混合两菌液。试验小鼠共5只,每只小鼠腹腔注射1 mL混合菌液。攻毒24 h后,每只小鼠均取脑、脾、血放入破碎管中,加入PBS使用匀浆机将其破碎,倍比稀释后分别涂布无抗THY平板和单抗THY平板(氯霉素12.5 μg·mL-1),涂布的平板设置3次重复,37℃过夜培养后进行平板计数。其中,无抗平板上长的菌落数为亲本株和缺失株菌落数的总和,单抗平板上长的菌落数为缺失株菌落数,亲本株的菌落数等于无抗平板菌落数减去单抗平板菌落数。
1.10 全血存活试验
采集健康猪血,经酶联免疫试验检测血清中SS4抗体为阴性。培养亲本株SH1510和缺失株SH1510Δ菌液,OD600至0.6—0.8之间,12 000 r/min离心10 min,弃上清,用灭菌生理盐水洗涤菌体2次,调整菌液OD600至0.1。取1 mL全血、300 μL SS4抗血清、100 μL菌液进行混匀,37℃温箱孵育2 h。分别在0、2 h取孵育混合物,倍比稀释涂布THY平板,过夜培养后进行细菌平板计数。设定0 h孵育混合物的细菌平板计数结果为100%标准,计算2 h细菌全血中存活百分比。
2 结果
2.1 缺失株SH1510ΔGalR的PCR鉴定
缺失株SH1510Δ的PCR鉴定结果见图2,使用内部检测引物I1/I2做PCR,亲本株扩增出723 bp的片段,缺失株为阴性;使用氯霉素抗性基因检测引物C1/C2做PCR,亲本株为阴性,缺失株扩增出1 056 bp的片段;使用O1/C2和O2/C1进行交叉PCR检测,引物O1/C2检测亲本株为阴性,缺失株扩增出2 121 bp的片段,引物O2/C1检测亲本株同为阴性,缺失株扩增出2 094 bp的片段;使用外部检测引物O1/O2做PCR,亲本株扩增出2 826 bp的片段,缺失株扩增出3 147 bp的片段。以上结果表明缺失株SH1510Δ构建成功。
2.2 Western blotting 鉴定
Western blotting 鉴定结果可见图3,亲本株SH1510可与粗制GalR多抗兔血清发生特异性结合,在37 kD处出现单一条带。缺失株SH1510Δ不能发生反应,没有条带出现,结果表明缺失株SH1510Δ构建成功。
2.3 革兰氏染色
在图4中可以看出两株菌均呈圆形或卵圆形,链状排列,长度相似,无明显差异。
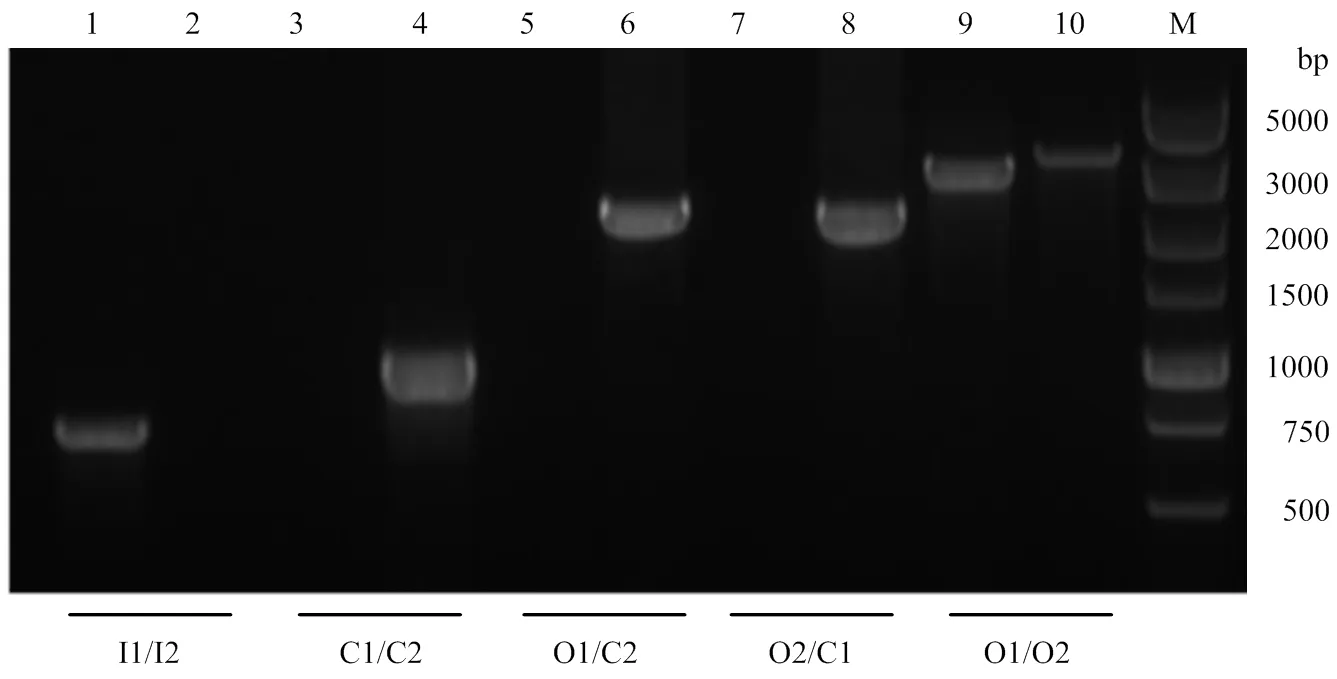
M:DNA分子质量标准;1、3、5、7、9:菌株SH1510;2、4、6、8、10:菌株SH1510ΔGalR。1、2:引物I1/I2;3、4:引物C1/C2;5、6:引物O1/C2;7、8:引物O2/C1;9、10:引物O1/O2
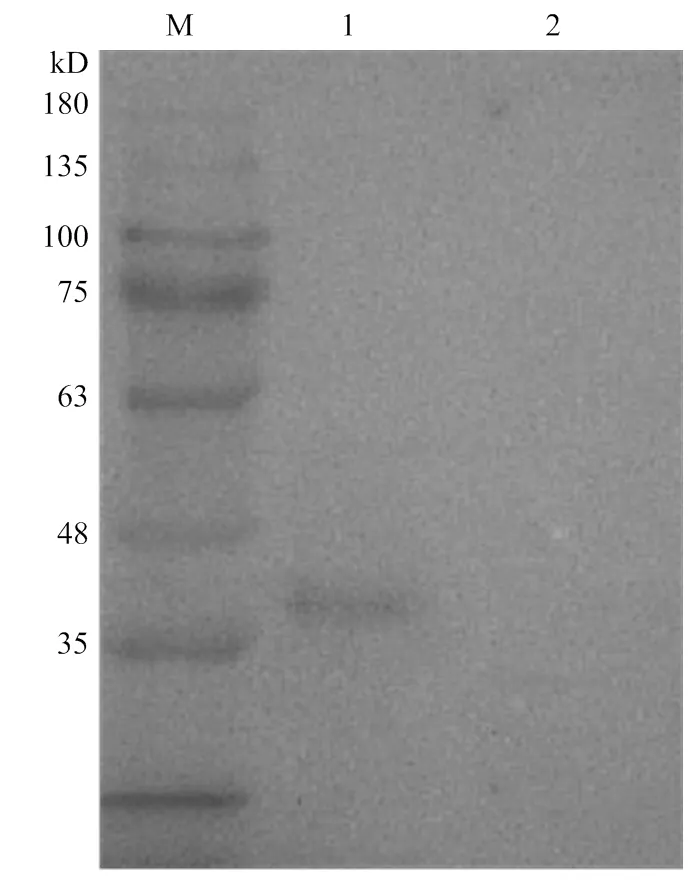
M:蛋白分子质量标准;1:SH1510菌株;2:SH1510ΔGalR菌株
2.4 不同糖利用率的比较
由图5可见,在葡萄糖和蔗糖作为唯一糖原的情况下,亲本株和缺失株的生长情况相仿;在D-半乳糖作为唯一糖原的情况下,缺失株的生长速率和OD600值明显低于亲本株;同时,从最高OD600值可以看出,猪链球菌SH1510对糖的利用率为葡萄糖>蔗糖>D-半乳糖。

A:菌株SH1510(1000×);B:菌株SH1510ΔGalR(1000×)
2.5 BALB/c小鼠致病性试验
攻毒过后,BALB/c小鼠表现嗜睡,不食或少食,脓眼等临床症状并发生死亡,对照组小鼠无异常表现。两菌株对BALB/c小鼠的致死率和半数致死量LD50见表2。结果可知,缺失株SH1510Δ的LD50(1.62×108CFU)是亲本株SH1510 LD50(1×108CFU)的1.62倍,缺失株SH1510Δ比亲本株SH1510的BALB/c小鼠致病力下降1.62倍,可见转录调控因子GalR基因和猪链球菌SH1510的毒力有关。
2.6 内竞争感染试验
攻毒后观察到小鼠出现嗜睡、脓眼、跛行等发病症状,采集小鼠脑、脾、血液进行处理,处理后分别在无抗THY平板和单抗THY平板(氯霉素12.5 μg·mL-1)上进行细菌计数,结果如图6所示,在BALB/c小鼠脑、脾和血液当中,亲本株的菌落数均远高于缺失株菌落数,差异极显著(<0.01)。体内竞争感染试验结果表明基因缺失后,细菌在体内的定植能力显著减弱。
2.7 全血存活试验
全血存活试验结果见图7,2 h后,亲本株SH1510的存活率为35.2%,缺失株SH1510ΔR的存活率为27.3%,缺失株SH1510Δ比亲本株SH1510在全血中的存活率下降显著(<0.01)。全血存活试验结果表明GalR基因缺失后,细菌在全血中的存活能力显著下降。

A,葡萄糖;B,蔗糖; C,D-半乳糖 A, glucose; B, sucrose; C,D-galactose

A. 血液;B. 脑;C. 脾A. Blood; B. Brain; C. Spleen
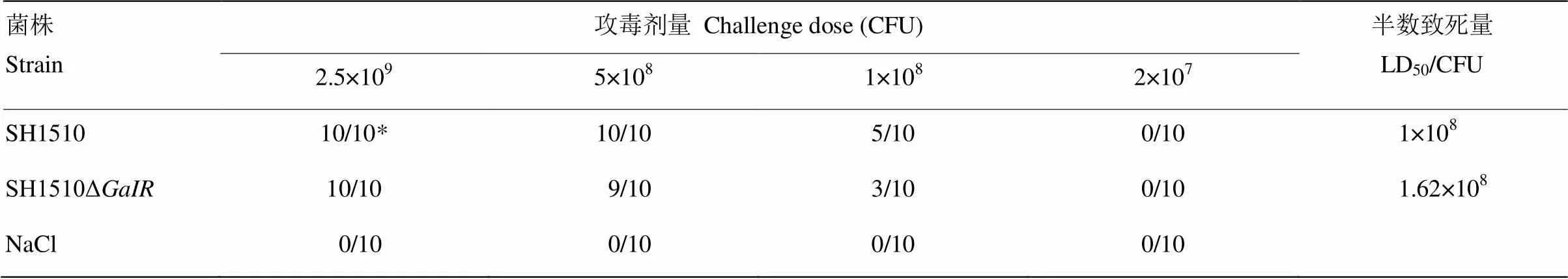
表2 BALB/c小鼠致死率和半数致死量
*分子表示每组小鼠死亡数,分母表示每组小鼠总数
The molecules represent the number of deaths in each group of mice and the denominator represents the total number of mice in each group

图7 亲本株和缺失株在全血中的存活能力
3 讨论
后基因组时代,基因敲除是研究目的基因功能的经典分子生物学技术[26],同源重组构建目的基因缺失株的方法在猪链球菌毒力因子的相关研究中得到广泛应用[27],通过构建目的基因缺失株,进一步研究并分析亲本株和缺失株生物学特性的差异,由此可鉴定目的基因的特定功能。
转录调控因子属于LacI家族,LacI家族的转录调节因子主要参与调节糖的分解代谢途径(例如,利用乳糖、半乳糖、果糖、葡萄糖、麦芽糖等的途径)[28]。在大肠杆菌和肺炎链球菌中,具有调控半乳糖代谢基因转录的功能[22-23]。在猪链球菌中的功能尚未得到证实,所以通过构建缺失株来鉴定的功能。通过革兰氏染色观察到两株菌均呈圆形或卵圆形,链状排列,长度相似,无明显差异,这项结果表明不是细菌维持基本形态的必要基因。亲本株和缺失株对不同糖的利用率试验,在葡萄糖和蔗糖作为唯一糖原的情况下,两株菌的生长情况相仿,缺失株在两种利用率较高的糖环境下均能正常生长,在D-半乳糖作为唯一糖原的情况下,的缺失导致猪链球菌SH1510的生长速率和OD600值降低,这表明可促进细菌对半乳糖的利用。Afzal[23]研究表明,在肺炎链球菌中,可作为半乳糖激酶编码基因的转录激活因子,从而促进半乳糖代谢,因此推测在猪链球菌中,转录调节因子很可能具有相似的功能。
BALB/c小鼠致病性结果显示,亲本株SH1510的 LD50为1×108CFU,缺失株SH1510Δ的LD50为1.62×108CFU,缺失株对小鼠的致病性下降了1.62倍。这项结果直接表明SH1510菌株GalR基因和SS4毒力相关。在猪链球菌的疾病感染过程中,猪链球菌首先需要粘附和侵袭上皮细胞,然后进入血液抵抗中性粒细胞和巨噬细胞的吞噬和杀伤而存活,后随血液循环侵入各组织脏器,引发败血症,导致全身感染,由此可见猪链球菌在全血中的存活能力对细菌的致病性极为重要[29-30]。全血存活试验中,缺失株SH1510Δ比亲本株SH1510在全血中的存活率显著下降(<0.05)。体内竞争感染试验表明在小鼠脑、脾和血液中,亲本株的菌落数均远高于缺失株菌落数,差异极显著(<0.01),这说明GalR基因缺失后,缺失株在体内脏器的定植能力和存活能力都远低于亲本株,猪链球菌必须通过血液循环系统才能入侵各个脏器从而导致全身感染,缺失株SH1510Δ在全血中的存活能力显著低于亲本株,所以脏器中缺失株的分离数量才远低于亲本株,由此可见两项试验结果密切相关。
这是在我国首次开展对猪链球菌4型毒力因子的研究,也是首次对转录调控因子致病性方面的研究,研究表明不但参与半乳糖的代谢与分解,而且对猪链球菌4型的毒力有直接或间接的调控作用。为进一步探索对半乳糖代谢途径的调控及其致病机理提供一定的理论依据。
4 结论
成功构建猪链球菌4型强毒株SH1510转录调控因子GalR基因缺失株SH1510Δ并对其部分生物学特性进行研究,结果表明,GalR基因缺失后,SH1510的细菌形态无显著变化;在葡萄糖和蔗糖为糖原条件下,不影响细菌的生长,在D-半乳糖为糖原的条件下,导致细菌生长速率和OD600值降低;小鼠致病性降低1.62倍;体内定植能力极显著降低(<0.01)和全血存活能力显著降低(<0.05)。
[1] 杜凡姝, 吕茜, 段锻, 陈丽, 黄金虎, 王丽平. 江苏苏北地区猪链球菌耐药性调查及万古霉素耐药基因检测. 畜牧与兽医, 2018, 50(12): 32-36.
DU F S, LV Q, DUAN D, CHEN L, HUANG J H, WANG L P. Antimicrobial susceptibility and emergence of vancomycin resistance genes in., 2018, 50(12): 32-36. (in Chinese)
[2] FAULDS-PAIN A, SHAW H A, TERRA V S, KELLNER S, BROCKMEIER S L, WREN B W. Thesortases SrtB and SrtF are essential for disease in pigs., 2019, 165(2): 163-173.
[3] KONG D, CHEN Z, WANG J, LV Q, JIANG H, ZHENG Y, XU M, ZHOU X, HAO H, JIANG Y. Interaction of factor H-binding protein ofwith globotriaosylceramide promotes the development of meningitis., 2017, 8(7): 1290-1302.
[4] 刘瑾, 陈申申, 张越, 钟孝俊, 潘子豪, 姚火春. 猪链球菌2型SstF蛋白对杆菌肽耐药性及毒力的影响. 畜牧与兽医, 2018(06): 74-79.
LIU J, CHEN S S, ZHANG Y, ZHONG X J, PAN Z H, YAO H C. Influence of SstF on bacitracin resistance and virulence inserotype 2., 2018(06): 74-79. (in Chinese)
[5] XIA X J, WANG L, CHENG L K, SHEN Z Q, LI S G, WANG J L. Expression and immunological evaluation of elongation factor Tu ofserotype 2., 2017, 20(2): 277-284.
[6] SHEN X, LIU H, LI G, DENG X, WANG J. Silibinin attenuatesserotype 2 virulence by targeting suilysin., 2019, 126(2): 435-442.
[7] KATAOKA Y, SUGIMOTO C, NAKAZAWA M, MOROZUMI T, KASHIWAZAKI M. The epidemiological studies ofinfections in Japan from 1987 to 1991., 1993, 55(4): 623-626.
[8] 吴超. 猪链球菌流行病学特征和hp0197基因多态性研究[D]. 武汉: 华中农业大学, 2013.
WU C. Study on epidemiology characterization ofand hp0197 genetic diversity analysis [D]. Wuhan: Huazhong Agricultural University, 2013. (in Chinese)
[9] HAN D U, CHOI C, HAM H J, JUNG J H, CHO W S, KIM J, HIGGINS R, CHAE C. Prevalence, capsular type and antimicrobial susceptibility ofisolated from slaughter pigs in Korea., 2001, 65(3): 151-155.
[10] 万云. 猪链球菌2型SntA蛋白在致病过程中的功能研究[D]. 武汉: 华中农业大学, 2017.
WAN Y. The involvement of SntA protein in pathogenesis ofserotype 2 [D]. Wuhan: Huazhong Agricultural University, 2017. (in Chinese)
[11] GOTTSCHALK M, LACOUTURE S, BONIFAIT L, ROY D, FITTIPALDI N, GRENIER D. Characterization ofisolates recovered between 2008 and 2011 from diseased pigs in Quebec, Canada., 2013, 162(2/4): 819-825.
[12] ARENDS J P, ZANEN H C. Meningitis caused byin humans., 1988, 10(1): 131-137.
[13] KERDSIN A, AKEDA Y, TAKEUCHI D, DEJSIRILERT S, GOTTSCHALK M, OISHI K. Genotypic diversity ofstrains isolated from humans in Thailand., 2018, 37(5): 917-925.
[14] HAN D U, CHOI C, HAM H J, JUNG J H, CHO W S, KIM J, HIGGINS R, CHAE C. Prevalence, capsular type and antimicrobial susceptibility ofisolated from slaughter pigs in Korea., 2001, 65(3): 151-155.
[15] PRUFER T L, ROHDE J, VERSPOHL J, ROHDE M, DE GREEFF A, WILLENBORG J, VALENTIN-WEIGAND P. Molecular typing ofstrains isolated from diseased and healthy pigs between 1996-2016., 2019, 14(1): e210801.
[16] CHATURVEDI V K, SINGH D P, SRIVASTAVA A K. Pathogenicity ofserotype 4 in piglets., 1999, 145(15): 435-436.
[17] 刘琪, 王娟, 周如月, 贾爱卿, 王贵平. 广东地区健康猪群和发病猪群猪链球菌流行病学调查分析. 中国畜牧兽医, 2017, 44(6): 1825-1831.
LIU Q, WANG J, ZHOU Y R, JIA A Q, WANG G P. Theepidemiological analysis of healthy and infected swine in Guangdong Province., 2017, 44(6): 1825-1831. (in Chinese)
[18] 王娟. 2014--2015年广东部分地区猪链球菌流行病学调查[D]. 南京:南京农业大学,2015.
WANG J. Epidemiologic investigation ofin some areas of guangdong province from 2014 to 2015[D]. Nanjing: Nanjing Agricultural University, 2015. (in Chinese)
[19] 周明瑶. 2015年苏南地区健康猪群猪链球菌流行病学调查[D]. 南京:南京农业大学, 2016.
ZHOU M Y. the epidemiological investigation ofisolated from health pigs in southern jiangsu province in 2015[D]. Nanjing: Nanjing Agricultural University, 2016. (in Chinese)
[20] 李丽, 黄良宗, 谢博, 张海龙, 顾万军. 9型猪链球菌广东株的分离鉴定和基因序列分析. 中国畜牧兽医, 2018(04): 1016-1026.
LI L, HUANG L Z, XIE B, ZHANG H L, GU W J. Isolation, identification and gene sequence analysis ofserotype 9 strain from Guangdong. China Animal Husbandry and Veterinary Medicine, 2018(04): 1016-1026. (in Chinese)
[21] GEANACOPOULOS M, ADHYA S. Functional characterization of roles of GalR and GalS as regulators of the gal regulon., 1997, 179(1): 228-234.
[22] QIAN Z, TROSTEL A, LEWIS D E, LEE S J, HE X, STRINGER A M, WADE J T, SCHNEIDER T D, DURFEE T, ADHYA S. Genome-wide transcriptional regulation and chromosome structural arrangement by GalR in, 2016, 3(4): 156-164.
[23] AFZAL M, SHAFEEQ S, MANZOOR I, KUIPERS O P. GalR acts as a transcriptional activator of galKT in the presence of galactose in., 2015, 25(6): 363-371.
[24] TAKAMATSU D, OSAKI M, SEKIZAKI T. Thermosensitive suicide vectors for gene replacement in, 2001, 46(2): 140-148.
[25] 唐宇龙. 猪链球菌2型Sortases、CcpA和SodA功能与致病力研究[D]. 杭州: 浙江大学, 2012.
TANG Y L. Functional analysis of Sortases, CcpA and SodA oftype 2 in relation to pathogenicity[D]. Hangzhou: Zhejiang University, 2012. (in Chinese)
[26] 王勇. 猪链球菌2型转录调控因子Rex功能研究[D]. 南京: 南京农业大学, 2017.
WANG Y. Biological functional of transcription regulator Rex intype 2[D]. Nanjing: Nanjing Agricultural University, 2017. (in Chinese)
[27] 郑成坤. 猪链球菌2型Spx调节因子和NADH氧化酶的致病性研究[D]. 武汉: 华中农业大学, 2017.
ZHENG C K. Contribution of the Spx regulators and NADH oxidase to the pathogenicity ofserotype 2[D]. Wuhan: Huazhong Agricultural University, 2017. (in Chinese)
[28] NGUYEN C C, SAIER M J. Phylogenetic, structural and functional analyses of the LacI-GalR family of bacterial transcription factors., 1995, 377(2): 98-102.
[29] 许仲旻. 猪链球菌致STSLS相关转录因子的筛选及其调控机制的研究[D]. 武汉: 华中农业大学, 2018.
XU Z M. The screening of STSLS relatedtranscription factors, and its regulatory mechanism[D]. Wuhan: Huazhong Agricultural University, 2018. (in Chinese)
[30] 任素静. 猪链球菌2型Type Ⅱ毒素—抗毒素系统的鉴定与功能研究[D]. 武汉: 华中农业大学, 2017.
REN S J. Research on identification and function of Type Ⅱ toxin-antitoxin system inserotype 2[D]. Wuhan: Huazhong Agricultural University, 2017. (in Chinese)
Biological Characteristics of Transcriptional Regulator GalR inSerotype 4
SUN Ke1,2, ZHU HaoDan1, HE KongWang1, WANG DanDan1, ZHOU JunMing1, YU ZhengYu1, LÜ LiXin1, NI YanXiu1
(1Institute of Veterinary Medicine, Jiangsu Academy of Agricultural Sciences, Nanjing 210014;2College of Animal Science and Technology, Jilin Agricultural University, Changchun 130118)
【】The study was carried out to investigate the effect of the deletion of the transcriptional regulatorgene oftype 4 virulent strain SH1510 on the biological characteristics of bacteria in order to further study GalR regulation of galactose metabolism pathway and its pathogenesis, so as to provide a theoretical basis.【】The SH1510Δ, an SS4 virulent strain SH1510 transcriptional regulatorgene deletion strain, was constructed by homologous recombination double-crossover. Then, a preliminary screening of the deletion strain was performed by the internal amplification primers I1/I2 ofgene, and further identified the deletion strain SH1510Δby PCR and Western blotting. We performed Gram staining on the parental strain SH1510 and the deletion strain SH1510Δto compare morphological differences. We configured the basal medium, added glucose, sucrose and D-galactose to culture the bacteria, and plotted the bacterial growth curve to compare the bacteria’s utilization of different sugars. The bacterial concentration of the parent strain and the deletion strain were adjusted to 2.5×109CFU/mL, 5×108CFU/mL, 1×108CFU/mL and 2×107CFU/mL, respectively, and BALB/c mice were intraperitoneally injected. Then, the lethality of the mice was observed, and the strain LD50was calculated by using the Reed-Muench method. The parental strain and the deletion strain with a concentration of 2×107CFU/mL were mixed in an equal volume of 1﹕1 and intraperitoneally injected into BALB/c mice. After 24 h, brain, spleen and blood were counted on chloramphenicol-resistant and non-resistant THB plates to compare the colonization ability of bacteria in mice. The internal environment with the whole blood of healthy pigs was simulated, and then the parent strain and the deletion strain were separately and added to whole blood of healthy pigs containing SS4 antiserum, and incubated at 37℃ for 2 h for plate counting to compare the viability of bacteria in whole blood.【】PCR was performed by using the internal detection primer I1/I2, and the result showed that the deletion strain SH1510Δwas negative. Further, primers C1/C2, O1/C2, O2/C1, and O1/O2 were used to identify the deletion strain SH1510Δ, and 1 056, 2 121, 2 094, and 3 147 bp fragments were amplified, respectively, and the results were in agreement with expectations. The results of Western blotting showed that the parental strain SH1510 could specifically bind to the crude rabbit anti-GalR polyclonal serum, and a single band appeared at 37 kD, but the deletion strain SH1510Δshowed no band. The results of PCR and Western blotting indicated that the deletion strain SH1510Δwas successfully constructed. The parent strain and the deletion strain were stained by Gram. The optical microscopic observation showed that the parent strain and the deletion strain were arranged in a chain, the length was similar, and the morphology was not significantly different. Under the growth conditions of glucose and sucrose as the sole glycogen, the growth of the parent strain and the deletion strain was similar; when the glycogen was D-galactose, the growth rate and OD600value of the deletion strain were significantly lower than that of the parent strain. In addition, it could be seen from the highest OD600value that the utilization rate of sugar bySH1510 was glucose>sucrose>D-galactose. In the mouse pathogenicity test, the LD50of the parent strain and the deletion strain were 1×108CFU and 1.62×108CFU, respectively, and the pathogenicity of the deletion strain to the mouse was decreased by 1.62 times.competitive infection test results showed that the number of bacteria isolated from deleted strains in the brain, spleen and blood of the mice was much lower than that of the parent strains, and the difference was extremely significant (<0.01). The whole blood survival test showed that the survival rate of the parent strain was 35.2%, the survival rate of the deletion strain was 27.3%, and the survival rate of the deletion strain SH1510Δin the whole blood was significantly lower than that of the parent strain SH1510 (<0.05).【】In summary, thegene could promote the utilization of galactose byserotype 4, and had direct or indirect regulation of the virulence of SH1510.
serotype 4; GalR; biological characteristics; virulence
10.3864/j.issn.0578-1752.2019.19.017

2019-01-22;
2019-04-17
国家公益性行业(农业)科研专项经费(201303041)、江苏现代农业生猪产业技术体系(JATS(2018)259)
孙珂,Tel:15729396877;E-mail:sunke2012@126.com。
倪艳秀,E-mail:er1998@126.com
(责任编辑 林鉴非)

