酸性土壤上花生高效根瘤菌的分离及应用
刘鹏,田颖哲,钟永嘉,廖红
酸性土壤上花生高效根瘤菌的分离及应用
刘鹏,田颖哲,钟永嘉,廖红
(福建农林大学资源与环境学院根系生物学研究中心,福州 350002)
花生(L.)是世界上重要的油料和经济作物。在我国南方产区,大部分花生种植地土壤为酸性。酸性土壤不仅pH值低、瘦瘠,而且还有低磷、铝毒等诸多障碍因素,严重限制了花生的生物固氮及产量。【】本文旨在分离及应用适应酸性土壤的高效固氮根瘤菌,提高花生固氮效率及产量,改良酸性土壤。利用平板划线结合镜检的方法,从田间采集的新鲜花生根瘤中分离纯化单菌落;通过PCR技术检测分离物中是否含有结瘤基因和固氮基因,进行根瘤菌的初步分子鉴定;再通过16S rRNA基因序列比对,对根瘤菌进行进一步分子鉴定。候选根瘤菌通过水培回接,检测其与花生的共生结瘤及固氮能力;再通过田间试验评价筛选出来的候选根瘤菌在酸性土壤上的应用效果。本研究首先从不同酸性土壤种植区域的花生根瘤中分离、纯化得到256个分离物;其中10株含有和,初步确定为根瘤菌。经16S rRNA基因全长序列测定,发现8株为慢生型根瘤菌(),2株为根瘤菌属根瘤菌()。水培回接试验发现,这10株根瘤菌均能够与花生共生、形成有效根瘤,证实是花生根瘤菌。在此基础上,选取4株固氮效率较高的根瘤菌,在酸性土壤上应用。结果表明,4株根瘤菌均能与花生在酸性土壤上形成根瘤,而未接种的花生根部不能形成根瘤。并且接种根瘤菌后显著改善了花生氮营养,提高了花生的生物量和产量。与不接种的对照相比,接种根瘤菌后,花生生物量、产量和氮含量分别提高了27.1%—38.0%、24.7%—104.2%和73.9%—151.3%。本研究分离鉴定的花生根瘤菌能够高效固氮和适应酸性土壤,具有重要的应用前景。
酸性土壤;花生;根瘤菌;生物固氮
0 引言
【研究意义】花生(L.),豆科花生属,一年生草本植物,具有产量高、用途广、抗逆性强、经济效益好、营养价值高等特点,是世界上重要的油料和经济作物[1]。花生作为豆科植物,能与根瘤菌共生形成根瘤进行生物固氮[2],是农业生产上优良的轮作换茬和间套种作物,具有增加复种指数,改良土壤结构、肥地养地等农业生态功能[3]。近年来,我国花生供需矛盾日益彰显,已成为全球花生的主要进口国之一[4]。我国花生产区以长江流域为界,分为南方小花生区和北方大花生区[5]。其中南方产区的土壤主要为酸性土壤。筛选适应酸性土壤的高效固氮根瘤菌,对提高南方花生产量,缓解我国花生供需矛盾及改良酸性土壤,具有重要的意义。【前人研究进展】研究表明,接种根瘤菌不仅能提高豆科作物的产量和品质,还能提高土壤微生物活性和多样性,提高土壤肥力[6]。在国外,接种根瘤菌作为花生的主要栽培措施之一,已被大面积推广应用[7]。在我国,接种根瘤菌在湖北、山东等地的花生生产上也有使用,但面积较小[8]。接种根瘤菌对豆科作物生长的促进作用主要取决于根瘤菌与作物的匹配性和固氮能力[9]。根瘤菌的生长与活性受土壤理化性质影响很大,北方豆科作物根瘤菌在南方酸性土壤适应性较差,田间接种效果不明显[10-11]。因此,想要提高豆科作物根瘤菌的实际应用效果,需要筛选土壤中竞争力和固氮能力较强,适应范围较广的根瘤菌[12]。【本研究切入点】酸性土壤不仅pH值低,而且土壤酸化加剧了盐基离子如Ca2+、Mg2+等的淋溶,促进了铝、锰等元素的释放,增强了磷的固定,造成氮、磷、钾等养分匮缺,对作物生长极为不利[13]。此外,土壤酸化还会限制豆科植物结瘤固氮。据报道,土壤pH值低于5.0时,大部分豆科作物无法正常结瘤[14]。在花生中,关于筛选适应酸性土壤的高效根瘤菌及应用鲜有报道。【拟解决的关键问题】本研究从来自酸性土壤上不同种植区域的花生根瘤中,分离纯化花生根瘤菌。通过水培回接和田间应用验证,筛选出适应酸性土壤的花生高效固氮根瘤菌,为配制适应酸性土壤的花生高效根瘤菌提供理论依据和应用材料。
1 材料与方法
1.1 试验材料
供试花生为闽花8号,福建农林大学油料作物所庄伟健教授惠赠。供试花生根瘤采自福建省安溪县龙涓乡(东经117.80°,北纬24.95°)、福建省福安市天香茶园(东经119.51°,北纬26.14°)、福建省尤溪县洋中(东经118.49°,北纬26.28°)。其中,安溪和福安采样点无花生种植历史,洋中采样点连年种植花生。田间试验在安溪县举源茶叶合作社茶园进行。土壤基本理化性质如表1。
1.2 土壤理化性质测定
土壤样品测定参照鲍士旦等方法[15]。pH:电位法(土﹕水=1﹕2.5,质量比);有机质:高温外加热重铬酸钾氧化-容量法;碱解氮:1 mmol∙L-1NaOH碱解扩散法;有效磷:BrayⅠ提取-钼锑抗比色法;速效钾:乙酸铵浸提-火焰光度法。
1.3 根瘤菌分离纯化及分子鉴定
根瘤菌分离纯化:参考贾立敏等方法[16]:挑取新鲜花生根瘤,用超纯水冲洗5—7遍,95%乙醇溶液处理2.5 min;0.2% HgCl2溶液消毒5 min,无菌水冲洗5—7次。用无菌刀片将消毒根瘤切为两半,将根瘤切面在YMA培养基表面划线,倒置封好,28℃恒温培养。从第2天起,挑取单菌落继代培养,直至获得纯净单菌落。
菌落分子鉴定:参照毕江涛等及李永春等[17-18]方法,利用和引物(表2)进行PCR扩增,1%凝胶电泳检测初筛。再用16S rRNA基因通用引物(表2)进行PCR扩增,对产物测序分析[19-20](上海铂尚生物技术有限公司)。
扩增的反应体系(以10 µL为例):2×Mix酶5 µL,引物F/R(10 µmol·L-1)各0.2 µL,菌液1 µL,无菌水补足至10 µL。PCR反应程序(表2):95℃预变性5 min;94℃变性1 min,退火30 s,60℃延伸30 s,40循环;72℃延伸10 min,4℃保存PCR产物。取3 µL扩增产物在1.0%的琼脂糖进行凝胶电泳检测。
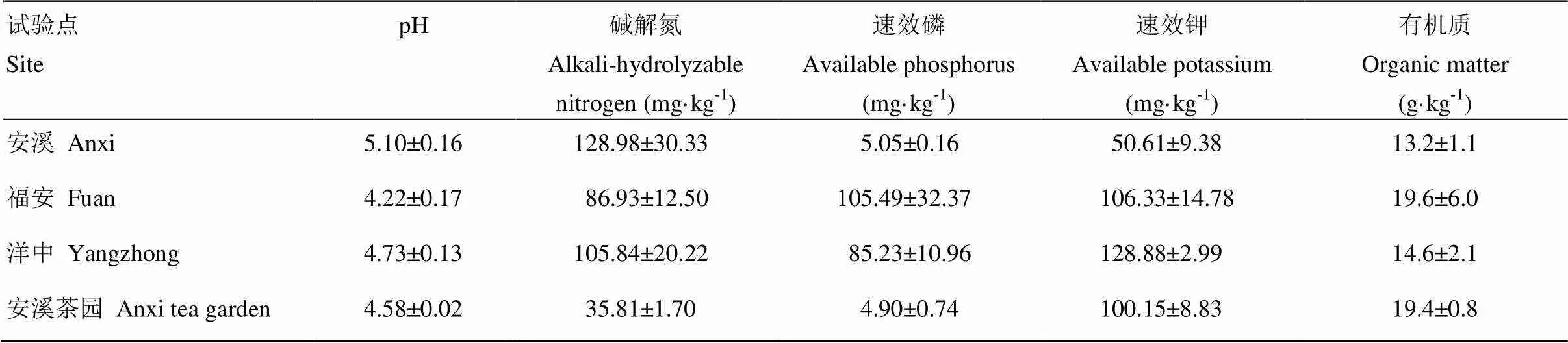
表1 各采样点土壤基本理化性质
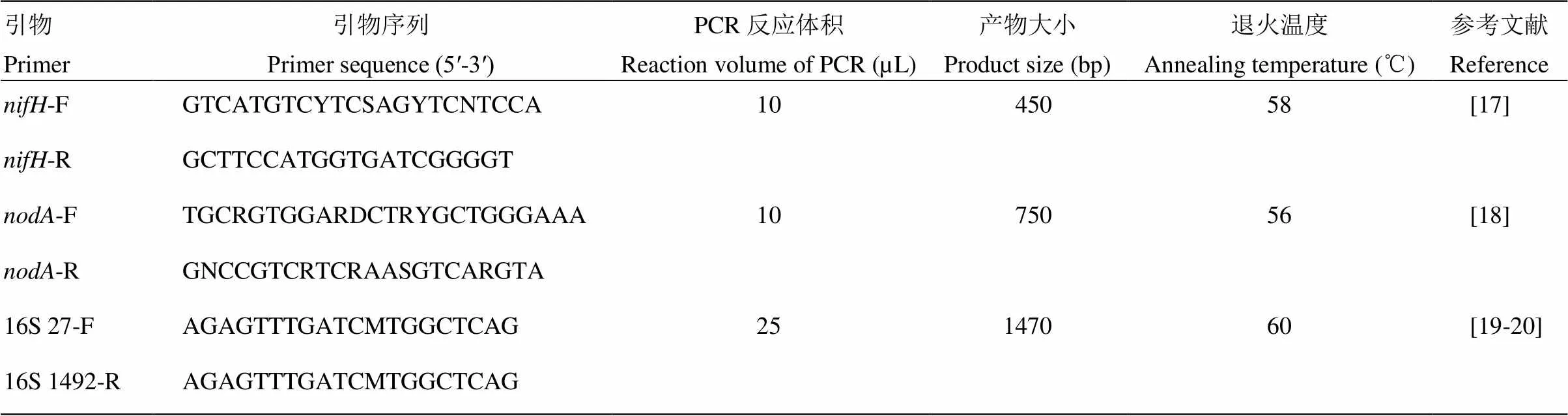
表2 根瘤菌分析鉴定所用的PCR引物
1.4 水培回接试验
低氮水培回接,营养液配方如下(g·L-1):Ca (NO3)2·4H2O 0.03 g,MgSO4·7H2O 0.12 g,CaCl2·2H2O 0.10 g,KH2PO40.10 g,Na2HPO4·12H2O 0.15 g,C6H5O7Fe·5H2O 0.005 g,微量元素1 mL,蒸馏水1000 mL,pH 5.8—6.0。微量元素配方(g·L-1):H2MoO40.02 g,MnSO41.81 g,H3BO32.86 g,CuSO4·5H2O 0.8 g,ZnSO4·7H2O 0.22 g。
根瘤菌培养:将-80℃保存的根瘤菌菌株,划线并培养,后接种于YMA液体培养基培养,28℃,200 r/min,培养至菌液OD600=1.2。
将胚根长至3—5 cm的花生幼苗浸泡在根瘤菌菌液2 h进行接种,再移至低氮营养液中,在生长室(日/夜:16 h/8 h,26℃/24℃)生长30 d。本试验包括分别接种10株不同根瘤菌与不接种处理,4个生物学重复,共44盆。收获后,测定植株生物量、结瘤数、含氮量和固氮酶活性等。参照艾文琴等[21],利用乙炔还原法测定花生根瘤固氮酶活性。
1.5 田间试验
根瘤菌田间试验:在水培试验结果的基础上,选取固氮能力较强4株根瘤菌(AXLQ1-6,FAMB12-6,YZMB13-3和YZMO14-4),在酸性土壤上进行田间试验,以不接种为对照。随机区组设计,3次重复,共15个小区。每小区长30 m、宽0.8 m,共24 m2。花生株行距为0.30 m×0.15 m,每小区种植花生400株。播种前施钙镁磷肥75 kg·hm-2。杂草、病虫害控制等按照花生田间日常管理执行。在开花期和成熟期进行取样:种植45 d后(即开花期),每根瘤菌菌种,每小区取代表性植株10株,共30株测定叶片SPAD值、地上部生物量、氮含量、根瘤个数等指标。种植110 d后(即成熟期),进行小区测产。
1.6 数据处理
16S rRNA基因系统发育树构建:选取具有较高同源性、已发表根瘤菌序列为参比菌株序列,利用BioEdit软件对供试菌株和参比菌株序列进行16S rRNA基因序列的多序列自动比对,再利用Mega 7.0软件,采用Kimura-2参数,进行邻接法(Neighbor- Joining)分析,生成系统发育树。
试验中所有的数据均用Microsoft Excel 2014(Microsoft Company,美国)和SPSS 18.0(Statistical Product and Service Solutions,美国)等统计软件进行统计分析,用SigmaPlot 12.0(Systat Software,美国)进行作图。
2 结果
2.1 酸性土壤上花生根瘤菌的分离纯化与分子鉴定
利用平板划线法,从花生根瘤中共分离出256个分离物。利用引物和引物对菌液进行PCR目的片段扩增,1%凝胶电泳结果如图1所示。结瘤基因PCR扩增产生750 bp左右的条带,固氮基因扩增产生450 bp左右的条带。通过和PCR扩增检验,256个分离物中,有10个分离物同时含有和,初步预测这些菌株具有固氮结瘤潜力(图1)。

1、2、3、4、5、6、7、8、9、10、11分别代表根瘤菌AXLQ1-6,AXLQ1-7,YZHO5-5,FAMB12-6,YZMB13-3,YZHO13-7,FAMB13-9,YZLH14-3,YZMO10-8,YZMO14-4,CK
将上述10株候选花生根瘤菌的16S rRNA基因序列,与从GenBank数据库中获取的6株参比菌株的序列,进行比对,构建系统发育树(图 2)。从进化与发育关系来看,本研究获得的根瘤菌主要分为两大类,其中8株属于慢生型根瘤菌属(),2株属于根瘤菌属()。8株慢生型根瘤菌,包括菌株YZMB13-3、AXLQ1-7、YZMO14-4、YZLH14-3、YZHO5-5、FAMB12-6、YZHO13-7、FAMB13-9与参比慢生型根瘤菌SEMIA6396、MN-139聚在一起。2株根瘤菌属根瘤菌,AXLQ1-6和YZMO10-8,与根瘤菌属的参比菌株strain G2312和strain5502G聚在一起,说明了根瘤菌属和慢生根瘤菌属菌株都具有与花生共生形成根瘤的潜力。
2.2 根瘤菌在水培试验中与花生的结瘤固氮能力
将上述根瘤菌进行水培回接,检验其与花生共生结瘤及固氮的能力。结果表明,所有供试根瘤菌均能与花生共生形成根瘤,而不接种处理的花生植株不能形成根瘤。其中,接种处理每株花生平均结瘤数为11—39个(表3)。与对照相比,结瘤植株生物量、SPAD值变化不显著,但大部分植株含氮量显著增加,高于对照43.2%—507.7%(表3)。表明本研究分离鉴定的10株根瘤菌,确实具有与花生共生,形成根瘤以及固氮的能力。
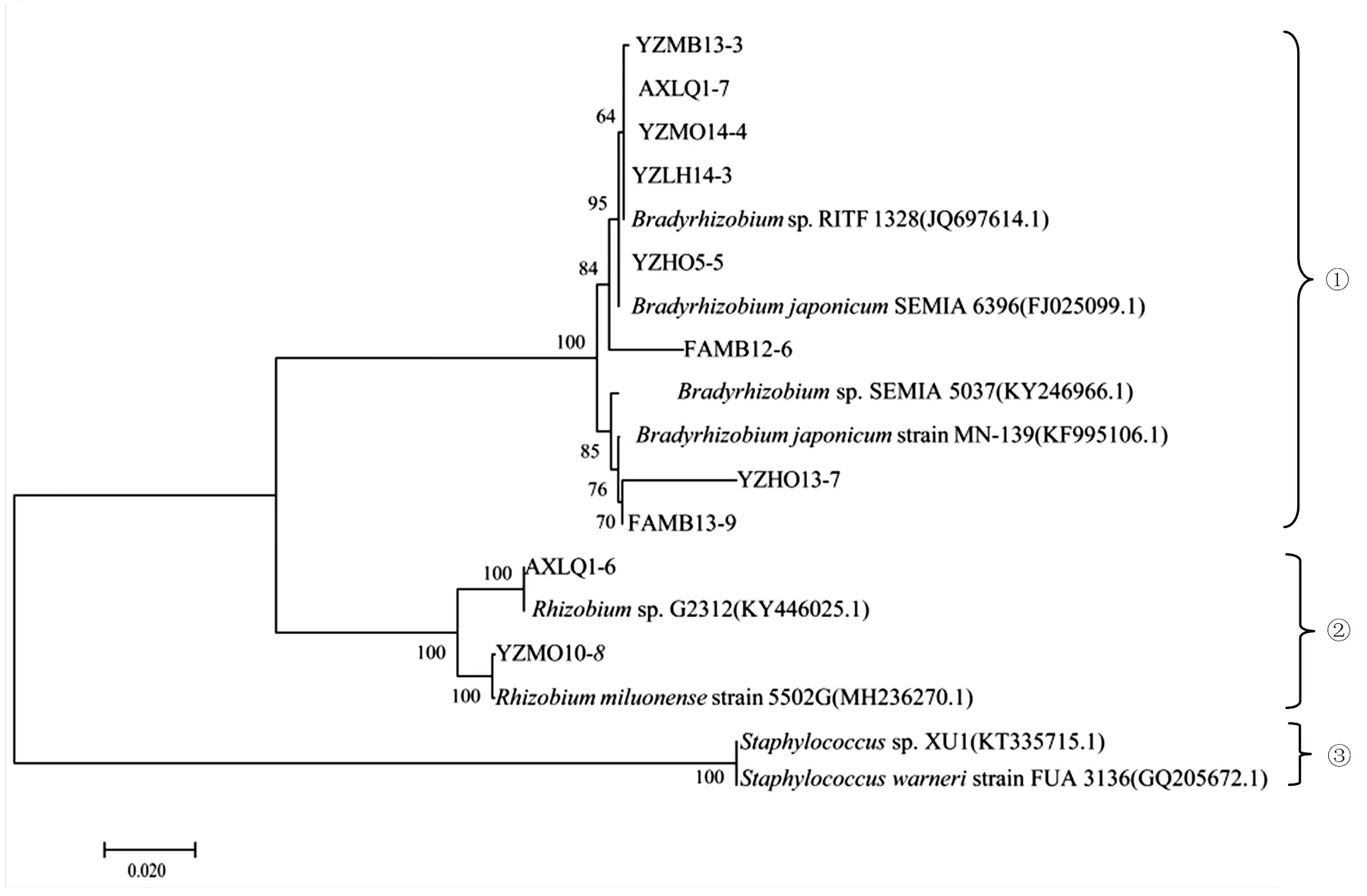
①慢生型根瘤菌属,②根瘤菌属,③葡萄球菌属。各参比菌株后面括号里是 16S rRNA 基因全序列在基因库中的登录号
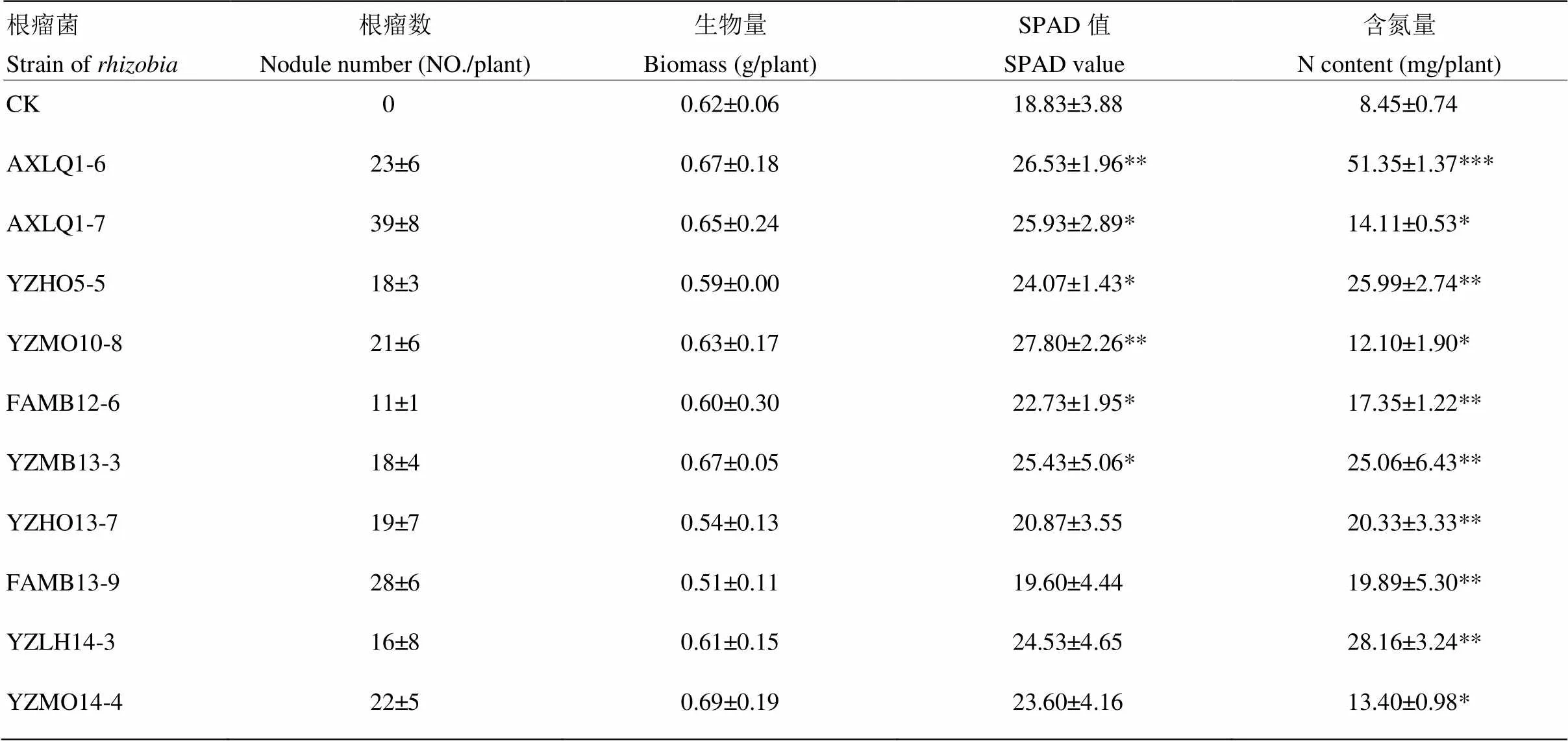
表3 水培试验中接种不同根瘤菌对花生结瘤及生长的影响
表中的数据为 4次重复的平均值及其标准误差。*表示同一性状接种根瘤菌植株与对照的Student检验结果。*:0.01<<0.05;**:0.001<<0.01;***:<0.001
The data in the table were the mean ± standard error (n=4). *, **, *** present the significant differences between inoculated with and without rhizobium stain through Student-test for the same trait at 0.01<<0.05, 0.001<<0.01 and<0.001 level, respectively
根瘤固氮酶活性测定结果表明,所有供试根瘤菌与花生形成的根瘤,均具有固氮酶活性。但不同根瘤菌所形成的根瘤,固氮酶活性差异显著。最高可达28 μmol (C2H4)·g-1(FW)·h-1,最低仅为0.3 μmol (C2H4)·g-1(FW)·h-1(图3),差异近100倍,说明了不同的花生根瘤菌之间的固氮能力差异明显。
2.3 花生高效根瘤菌在酸性土壤上田间应用效果
在水培试验结果的基础上,选取4株固氮酶活性较高的根瘤菌进行大田应用。结果表明,所选的4株根瘤菌在田间都能与花生正常结瘤,并促进花生生长(表4)。供试根瘤菌在酸性土壤上,与花生具有较强共生结瘤能力。表现在接种后不仅结瘤率100%,而且单株结瘤数高达69—195个(表4),不接种的对照植株不能形成根瘤。此外,接种不同根瘤菌均能显著促进花生生长、提高花生植株生物量。接种后所形成的根瘤固氮酶活性在1.8—6.0 µmol C2H4·g-1·h-1之间。其中,来自低氮土壤的根瘤菌FAMB12-6固氮酶活性较高,而筛选自高氮土壤的根瘤菌AXLQ1-6固氮酶活性较低(表1,图4)。与对照相比,接种4种不同根瘤菌,分别提高了花生生物量33.6%、37.7%、38.0%和27.1%(表4)。

图中的数据为 3 次重复的平均值及其标准误差。***:单因素方差分析差异极显著,P<0.001。不同小写字母表示不同根瘤菌处理间差异达 0.05 显著水平
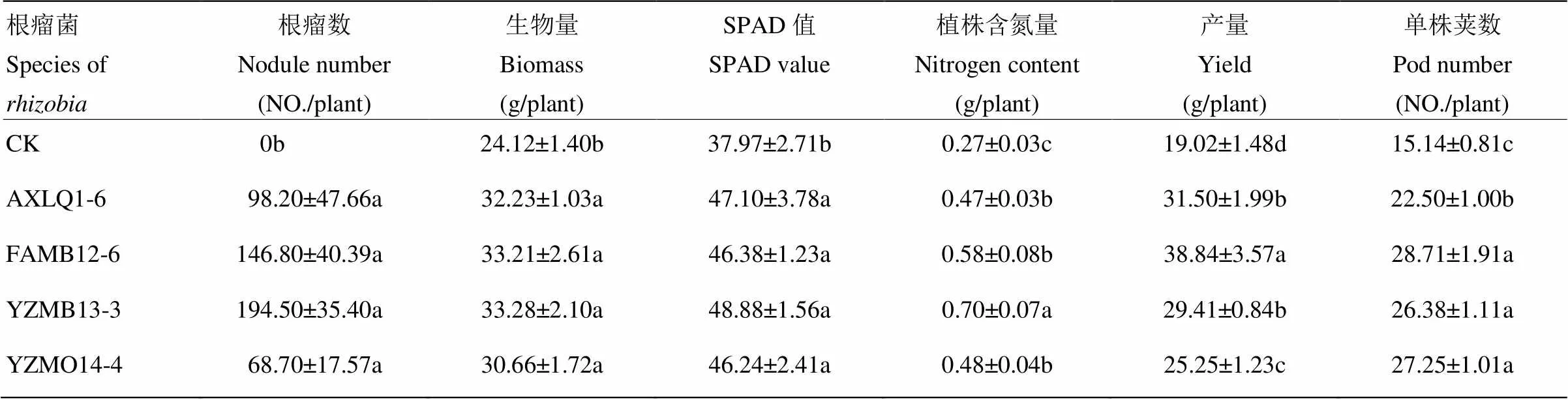
表4 田间接种不同根瘤菌对花生结瘤及生长的影响
表中的数据为30株苗的平均值及其标准误差。同列数据后不同小写字母表示处理间差异达0.05显著水平
The data in the table were mean ± standard error (n=30). Different letters indicated significantly different at 0.05 level

图中的数据为 10 次重复的平均值及其标准误差。***:单因素方差分析差异极显著,P<0.001。不同字母表示不同根瘤菌处理间差异达 0.05 显著水平
此外,接种根瘤菌显著改善了花生氮营养、提高花生产量。SPAD值是衡量植株叶绿素含量的重要指标,SPAD值的高低可间接体现植物氮营养的高低。接种根瘤菌显著提高了花生叶片的SPAD值,其中接种根瘤菌YZMB13-3,对花生SPAD值提高较为明显,提高了28.7%(表4,图5)。与对照相比,接种根瘤菌显著改善了花生氮营养。尤其是接种YZMB13-3后,植株氮含量增加了151.0%(表4,图5)。接种根瘤菌后,花生产量也显著增加。接种根瘤菌FAMB12-6对花生增产最为明显,增幅为104.2%(表4,图5)。接种根瘤菌促进花生增产主要原因为增加单株结荚数(表4,图5)。

图5 酸性土壤条件下接种YZMB13-3根瘤菌对花生生长的影响
3 讨论
3.1 酸性土壤上花生根瘤菌的发现及意义
我国南方土壤主要为酸性土壤,南方土壤由于自然发育、酸沉降、淋溶作用造成土壤pH值低,且土壤中可供植物利用的氮、磷、钾、镁等元素严重缺乏,不利于作物生长[22]。已有研究发现,接种根瘤菌可显著提高豆科作物的抗逆性,还可提高土壤养分利用率[18]。因此在酸性土壤上种植花生,在选择耐酸性花生种质的同时,还要利用适应酸性土壤和花生匹配的花生根瘤菌[23]。接种花生根瘤菌作为提高花生产量的重要策略,在20世纪60年代已有报道[24]。但是国内大部分的研究主要集中在华北、华中以及西北地区的花生根瘤菌,但对华南地区酸性土壤花生根瘤菌的研究较为少见[25]。本研究在连续种植以及未种植花生的华南地区酸性土壤上,利用田间、盆栽的方式通过分离、鉴定得到具有结瘤固氮功能的花生根瘤菌(表1,图2)。与之前报道的筛选自中性或碱性土壤的花生根瘤菌相比,具有耐酸的特性。同时本研究利用了多个花生品种对花生根瘤菌进行捕捉,利用水培与田间试验对根瘤菌进行根瘤固氮能力的筛选,最终得到固氮效率高、竞争力强和适应性广的花生根瘤菌(表3,表4,图4)。本研究分离得到的花生根瘤菌应用于南方酸性土壤中不仅可以改善宿主植株的氮营养,还可以提高花生产量,提高土壤氮素,培肥地力,减少肥料应用,改善生态环境,具有重要的应用前景。
3.2 花生根瘤菌的宿主范围及土壤适应性
根瘤菌属于革兰氏阴性细菌,在土壤中分布广泛。有报道指出,根瘤菌受环境胁迫和宿主植株选择的影响,向着不同方向进化,经过长期的演变与进化形成表型和遗传基因的高度多样性[26]。细菌是一种生命活体,对生存环境的要求比较高。因此,不同的根瘤菌在不同土壤的生长状况也不尽相同。据报道,一般根瘤菌在中性或中碱性的土壤中结瘤固氮效果最好,而在酸性土壤中效果较差[27]。田间试验结果表明,本研究筛选到的花生根瘤菌在土壤pH为5.1时,还能正常结瘤固氮、促进花生植株生长(表4,图5),说明其具有较好的适应酸性土壤的能力。究其原因,本研究在筛选根瘤菌时,同时兼顾到根瘤菌土壤环境和宿主种类两个方面。在土壤环境方面,根瘤菌来自pH值为4.2—5.1的3种典型酸性土壤,氮磷含量差异较大的土壤类型,以及不同的花生种植历史。本研究所得菌株可初步划分为根瘤菌属和慢生型根瘤菌属。与刘璐等人研究发现的结果相一致,豆科植物长期共生的根瘤菌具有高度区域特异性[28]。本研究中有6株根瘤菌菌株主要来自洋中(图2),说明相对其他的取样地点(安溪、福安)长期种植花生的洋中土壤中,花生土著根瘤菌可能具有较高的丰富度。因此,获得的花生根瘤菌类型较广泛,可以应对不同的环境类型。根瘤固氮酶活性受土壤含氮量影响较大,土壤的含氮量较高,根瘤菌的固氮酶活性受到抑制[29]。如本研究田间试验中,由福安较低含氮量的土壤筛选到的根瘤菌表现较高固氮酶活性,而筛选自安溪含氮量较高的土壤的根瘤菌则固氮酶活性较低(表1,图4)。并且,来自于洋中的根瘤菌YZMB13-3所形成根瘤最多,可能为当地的优势菌株,竞争能力较强(表4)。
在宿主方面,为了提高研究分离得到的根瘤菌菌株具有较广宿主适应性,本研究采用来自18种不同花生的根瘤作为根瘤菌的来源。此外,田间应用的根瘤菌菌株是通过分子鉴定和水培回接试验的层层筛选,选取固氮酶活性较高的菌株,具有较强的固氮效率。因此,本研究所获得的根瘤菌,具有可以适应酸性土壤、宿主范围广和固氮效率较高的特点。
3.3 花生高效根瘤菌在酸性土壤上的应用前景
氮是植物生长必需大量营养元素之一,植物生长对氮的需要量较大。氮素供应是农业生产上限制作物产量的重要因素之一。花生属豆科植物,花生与花生根瘤菌通过有效的共生固氮作用可为提供花生整个生育期所需氮素的50%以上[30]。本研究结果表明,接种花生根瘤菌可以显著提高花生植株生物量,增强花生对酸性土壤的适应性。这一结果和目前许多报道通过接种根瘤菌提高宿主植物的耐受逆境的能力是一致的。例如,接种根瘤菌或者其他微生物可以显著提高宿主植物对逆境的适应,比如盐碱,干旱等[29, 31-32]。并且程凤娴等在研究中发现,接种根瘤菌不仅增加了大豆植株氮含量,也增加了植株磷含量[23]。可见,接种根瘤菌也可促进豆科作物对其他的养分吸收,从而提高产量。这与本研究发现一致,在酸性土壤上接种根瘤菌,不仅可以通过生物固氮为花生提供氮素,还可促进花生的生殖生长(单株结荚数显著增加,表4)。
目前,我国土壤酸化越来越严重。以福建省为例,其耕地土壤酸化面积占总面积66.47%[33]。铝毒、低磷、低氮是酸性土壤上限制豆科作物产量的重要因素。在农业生产上,需要施加大量的复合肥来提高土壤的氮、磷养分水平,这也是造成土壤进一步酸化,破坏自然生态的主要原因[34]。此外,酸性土壤地区豆科作物种植比较少,土壤中土著根瘤菌丰度较低。人工接种根瘤菌是提高豆科作物固氮能力和产量主要措施之一[35]。本研究结果表明,在未种植过花生的酸性土壤上,如果不接种根瘤菌,花生基本没有根瘤,进一步说明酸性土壤中能与花生匹配共生的根瘤菌非常少。接种根瘤菌后,不仅能够形成具有固氮功能的根瘤,还能促进花生生长,显著提高花生生物量以及植株含氮量,最终增加花生产量(表4,图5)。说明接种高效根瘤菌确实是提高花生对酸性土壤的适应性,最终提高花生产量的有效措施。
4 结论
本研究分离、纯化并鉴定了酸性土壤上的10株花生高效根瘤菌。这些根瘤菌分别属于慢生型根瘤菌与根瘤菌属根瘤菌;在水培条件下,与花生共生,形成具有高效固氮的根瘤;进一步选取4株结瘤固氮能力较强的根瘤菌进行田间试验,发现这些高效根瘤菌都能显著促进酸性土壤上花生的生长,可分别提高花生生物量、产量和含氮量27.1%—38.0%、24.7%—104.2%和73.9%—151.3%。因此本研究分离鉴定的花生根瘤菌能够适应酸性土壤和高效固氮,具有重要的应用前景。
[1] 蔡长久. 农民稳增收的大田作物—花生.农村实用科技信息, 2005, 10(3): 8-9.
CAI C J. Field crops for farmers' steady income increase—peanut., 2005, 10(3): 8-9. (in Chinese)
[2] 杨江科, 谢福莉, 周俊初. 江汉平原及其周边地区花生根瘤菌的遗传多样性. 生态学报, 2003, 23(3): 504-511.
YANG J K, XIE F L, ZHOU J C. Genetic diversity of peanut rfrom in Jianghan Plain and the adjacent areas., 2003, 23(3): 504-511. (in Chinese)
[3] 姚瑞林. 花生根瘤菌的应用技术及其肥效. 花生学报, 1989, 3(4): 15-17.
YAO R L. Application technology and fertilizer efficiency of peanut., 1989, 3(4): 15-17. (in Chinese)
[4] 农业部经济与经济信息司. 2016年我国花生市场运行情况及2017年市场展望[N]. 中国粮食信息网, 2017, 2017-01-24.
Department of Economic and Economic Information, Ministry of Agriculture. Peanut Market Operation in 2016 and Market Prospect in 2017[N]., 2017, 2017-01- 24. (in Chinese)
[5] 张怡. 中国花生生产布局变动解析. 中国农村经济, 2014, 11(2): 73-82+95.
ZHANG Y. Analysis on the change of peanut production distribution in China., 2014, 11(2): 73-82+95. (in Chinese)
[6] 韩华君, 张磊, 谢德体. 耐酸苜蓿根瘤菌在酸性黄壤中的定殖研究. 西南农业大学学报(自然科学版), 2006, 28(5): 722-726.
HAN H J, ZHANG L, XIE D T. Dynamics of root colonization of acid-tolerantstrainsin an acid yellow soil., 2006, 28(5): 722-726. (in Chinese)
[7] 朱增改, 张文敏. 花生根瘤菌剂及促生菌剂使用方法研究. 土壤肥料, 2004, 1(2): 45-46.
ZHU Z G, ZHANG W M. Study on the application of peanutagent and growth promoting agent., 2004, 1(2): 45-46. (in Chinese)
[8] 崔玉兰. 不同根瘤菌剂对花生生长及产量的影响研究. 现代农村科技, 2013, 14(5): 62-63.
CUI Y L. Effects of differentagents on peanut growth and yield.gy, 2013, 14(5): 62-63. (in Chinese)
[9] 吴海燕, 刘春光, 张桂芝. 花生根瘤菌高效菌株的筛选及固氮效应的研究Ⅱ.花生根瘤菌高效菌株的筛选及固氮效应田间试验. 吉林农业科学, 2004, 29(4): 28-34.
WU H Y, LIU C G, ZHANG G Z. Screening of high efficientstrains and study on nitrogen fixation effect of peanutII. screening of high efficientstrains and field test of nitrogen fixation effect., 2004, 29(4): 28-34. (in Chinese)
[10] 王晶, 许修宏. 根瘤菌与大豆在不同类型土壤中的生态适应性研究. 中国土壤与肥料, 2009, 5(5): 72-76.
WANG J, XU X H. Eco-adaptability ofand soybean in different soils., 2009, 5(5): 72-76. (in Chinese)
[11] 杨江科. pH对土壤中土著快、慢生大豆根瘤菌结瘤的影响. 应用生态学报, 2001, 12(4): 639-640.
YANG J K. Effect of pH on nodulation of fast-growing and slow-growing soybeanin soil., 2001, 12(4): 639-640. (in Chinese)
[12] 张艳华. 辽宁省花生根瘤菌的系统发育及应用研究[D]. 沈阳: 沈阳农业大学,2016.
ZHANG Y H. Phylogeny and application of peanutin Liaoning Province[D]. Shenyang: Shenyang Agricultural University,2016. (in Chinese)
[13] 徐根娣, 刘鹏, 许敏. 铝胁迫对大豆同工酶的影响. 湖北农业科学, 2005, 5(29): 85-88.
Xu G D, Liu P, XU M. Effects of aluminum stress on soybean isozymes., 2005, 5(29): 85-88. (in Chinese)
[14] 吴甫成, 彭世良, 王晓燕. 酸沉降影响下近20年来衡山土壤酸化研究. 土壤学报, 2005, 42(2): 219-224.
WU P C, PENG S L, WANG X Y. Soil acidification in Hengshan in the past 20 years under the influence of acid deposition., 2005, 42(2): 219-224. (in Chinese)
[15] 鲍士旦. 土壤农化分析. 北京: 中国农业出版社, 2000: 30-107.
BAO S D.. Beijing: China Agricultural Press, 2000: 30-107. (in Chinese)
[16] 贾立敏, 蔡扩军, 李爱巧. 牛圈舍空气中放射根瘤菌的分离鉴定. 新疆畜牧业, 2017, 4(7): 25-26.
JIA L M, CAI K J, LI A Q. Isolation and identification ofin the air of cowshed., 2017, 4(7): 25-26. (in Chinese)
[17] 毕江涛, 贺达汉, 谢瑞梅, 韦革宏.沙冬青根瘤菌结瘤基因PCR-RFLP分析. 中国沙漠, 2009, 29(4): 703-710.
BI J T, HE D H, XIE R M, WEI G H. PCR-RFLP analysis of nodulation geneoffrom., 2009, 29(4): 703-710. (in Chinese)
[18] 李永春, 孔令如, 王焱, 孔文尧, 杨统一, 邹爱兰, 戚金亮, 杨永华. 酸性土壤中大豆优势根瘤菌的分离、鉴定及其生物学特性. 中国油料作物学报, 2011, 33(4): 384-390.
LI Y C, KONG L R, WANG Y, KONG W Y, YANG T Y, ZOU A L, QI J L, YANG Y H. Isolation, identification and biological characteristics ofassociated with soybean in acidic soil., 2011, 33(4): 384-390. (in Chinese)
[19] Akhgar A, Arzanlou M, Bakker P, Hamidpour M. Characterization of 1-Aminocyclopropane-1-Carboxylate (ACC) deaminase-containingspp. in the rhizosphere of salt-stressed canola., 2014, 24(4): 461-468.
[20] 张小娟.青海省不同生态区蚕豆根瘤菌16S rDNA分析.干旱地区农业研究, 2018, 36(4): 259-263.
ZHANG X J. 16S rDNA of rhizobium isolated from faba bean of different ecotopes in Qinghai Province, 2018, 36(4): 259-263. (in Chinese)
[21] 艾文琴, 姜瀚原, 李欣欣, 廖红. 一种高效研究大豆根瘤共生固氮的营养液栽培体系. 植物学报, 2018, 53(4): 519-527.
AI W Q, JIANG H Y, LI X X, LIAO H. An efficient nutrient solution system to study symbiotic nitrogen fixation in soybean., 2018, 53(4): 519-527. (in Chinese)
[22] 张永春.长期不同施肥对土壤酸化作用的影响研究[D].南京: 南京农业大学,2016.
ZHANG Y C. Research of long term fertilization on soil acidification[D]. Nanjing: Nanjing Agricultural University, 2016. (in Chinese)
[23] 程凤娴, 曹桂芹, 王秀荣. 华南酸性低磷土壤中大豆根瘤菌高效株系的发现及应用. 科学通报, 2008, 53(23): 2903-2910.
CHENG F X, CAO G Q, WANG X R. Discovery and application of soybeanstrains with high efficiency in acidic low phosphorus soil in South China., 2008, 53(23): 2903-2910. (in Chinese)
[24] 华北农业科学研究所土壤肥料研究室. 一九五○年花生根瘤菌拌种工作总结. 中国农业科学, 1951(4): 24-25.
Soil and Fertilizer Research Office, North China Institute of Agricultural Sciences. Summary of peanut rhizobia seed dressing in 1950., 1951(4): 24-25. (in Chinese)
[25] Khalid R, ZHANG Y J, Ali S, SUI X H, ZHANG X X, Amara U, CHEN W X, Hayat R.Sp. Nov., isolated from groundnut () nodules grown in rainfed Pothwar, Pakistan., 2015(107): 281-290.
[26] 康凯.花生慢生根瘤菌的多样性研究[D].武汉: 华中农业大学,2007.
KANG K. Study on diversity of slow-growing rhizobia isolated from[D]. Wuhan: Huazhong Agricultural University, 2007. (in Chinese)
[27] 李智燕, 邢学峰, 唐华. 铝和酸胁迫对苜蓿根瘤菌生长和抗氧化酶系的影响. 草业学报, 2013, 22(3): 146-153.
LI Z Y, XING X F, TANG H. Effects of aluminum and acid stress on growth and antioxidant enzymes of alfalfa., 2013, 22(3): 146-153. (in Chinese)
[28] 刘璐, 詹庆才, 彭伟正. 根瘤菌生物地理学的研究进展. 微生物学报, 2018, 58(2): 202-208.
LIU L, ZHAN Q C, PENG W Z. Advances in biogeography of., 2018, 58(2): 202-208. (in Chinese)
[29] 刘丽, 马鸣超, 姜昕. 根瘤菌与促生菌双接种对大豆生长和土壤酶活的影响. 植物营养与肥料学报, 2015, 21(3): 644-654.
LIU L, MA M C, JIANG X. Effect ofand PGPR co-inoculant on soybean characteristics and soil enzyme activities., 2015, 21(3): 644-654. (in Chinese)
[30] 杨庆锋, 杜迎辉, 赵伟杰. 不同氮肥处理下花生根瘤菌的应用效果. 安徽农业科学, 2013, 41(21): 8860-8861.
YANG Q F, DU Y H, ZHAO W J. Application of peanutunder different nitrogen fertilizer treatment., 2013, 41(21): 8860-8861. (in Chinese)
[31] 姜华, 赵雅丽, 何承刚. 紫花苜蓿根瘤菌及其共生系统耐酸性的研究. 云南农业大学学报(自然科学), 2013, 1(10): 56-60.
JIANG H, ZHAO Y L, HE C G. Study on acid tolerance inand its symbiosis system., 2013, 1(10): 56-60. (in Chinese)
[32] 张媚佳, 徐淑韵, 徐苏凌. 接种耐酸根瘤菌对紫花苜蓿生长的影响. 贵州农业科学, 2011, 39(5): 164-166.
ZHANG M J, XU S Y, XU S L. Effect of acid-toleranton the growth of alfalfa., 2011, 39(5): 164-166. (in Chinese)
[33] 陈敬慈, 张炳铃, 陈旭东. 安溪茶园土壤酸化问题与改良措施. 北京农业, 2014, 29(8): 115-116.
CHEN J C, ZHANG B L, CHEN X D. Soil acidification and improvement measures in Anxi Tea Garden., 2014, 29(8): 115-116. (in Chinese)
[34] 曹立耘. 根据土壤性质合理施肥. 湖南科技报, 2015-01-06(7).
CAO L Y.Rational fertilization based on soil properties. Hunan Science and Technology Daily, 2015-01-06(7). (in Chinese)
[35] 黎健龙, 涂攀峰, 陈娜, 唐劲驰, 王秀荣, 年海, 廖红, 严小龙. 茶树与大豆间作效应分析. 中国农业科学, 2008, 41(7): 2040-2047.
LI J L, TU P F, CHEN N, TANG J C, WANG X R, NIAN H, LIAO H, YAN X L. Effects of tea intercropping with soybean., 2008, 41(7): 2040-2047. (in Chinese)
Isolation and Application of EffectiveStrains in Peanut on Acidic Soils
LIU Peng, TIAN YingZhe, ZHONG YongJia, LIAO Hong
(Root Biology Center, College of Resources and Environment, Fujian Agriculture and Forestry University, Fuzhou 350002)
【】Peanut (L.) is an important oil and economic crop in the world. Most of the peanut cultivation soils in South China are acidic. Since low pH value, nutrition deficiencies and aluminium (Al) toxicity on acidic soils severely limit yield and biological nitrogen fixation (BNF) capacity in peanut. 【】The purpose of this paper is to isolate acidic soil adaptivestains to improve BNF and yield of peanut, as well as to remediate acidic soils.【】Firstly, strains were isolated and purified from fresh peanut nodules by collecting from the field by streak plate method combined with microscope observation, the nodulation geneand nitrogen fixing genewere detected by PCR to preliminary identification of potentialstrains, and then 16S rRNA sequencing was used for further taxonomy identification of the isolate strains. The symbiotic nodulation and nitrogen fixation ability of potentialstrains were validated by inoculation to the peanut under hydroponics conditions. Further, the candidate rhizobium strains in the field trial on acidic soils were evaluated. 【】 A total of 256 microbe strains were isolated and purified from nodules of peanuts grown in different sites on acidic soils. Based on the results of 16S rRNA sequencing analysis, ten of them containedand, and were initially identified as potential. Of which, 8 strains belonged tosp. and 2 belonged tosp. Hydroponic experiments further confirmed that the 10 strains could form functional nodules with peanuts. Subsequently, 4 strains with higher BNF capacity were selected for field evaluation on acidic soils. The results showed that all the 4 strains successfully formed functional nodules with peanuts in the field. On contrary, none of nodules could be formed in peanuts without rhizobium inoculation. Besides,inoculation significantly improved N nutrition, and increased biomass and yield of peanut. By comparison with CK plants, biomass, yield and N content of peanuts inoculated withstrains were increased by 27.1%-38.0%, 24.7%-104.2% and 73.9%-151.3%, respectively. 【】Taken together, the peanutisolated and identified in this study could fix N2effectively and adapted well to acidic soils, and therefore which had great application potentials.
acidic soils; peanut; rhizobia; biological nitrogen fixation
10.3864/j.issn.0578-1752.2019.19.010

2019-03-25;
2019-06-04
国家重点研发计划项目(2016YFD0100700)
刘鹏,E-mail:448860600@qq.com。
廖红,E-mail:hliao@fafu.edu.cn
(责任编辑 李云霞)
——固氮微生物

