不同虾青素制剂对急性酒精氧化损伤小鼠的抗氧化作用*
关 磊,吴广璐,代明琴,余韩洁钰,董 平,李 敬**,梁兴国,2
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.青岛海洋科学与技术国家实验室海洋药物与生物制品功能实验室,山东 青岛 266235)
虾青素(Astaxanthin)即3,3′-二羟基-4,4′-二酮基-β,β′-胡萝卜素,结构中含有不饱和酮基和羟基共轭双键结构,因而具有比β-胡萝卜素更强的抗氧化活性,是已知的具有最强抗氧化活性的天然物质[1-2]。此外,虾青素还具有良好的抗肿瘤活性、免疫增强活性,并可预防心血管疾病,因此食用虾青素及其制品对保障人类健康具有重要的意义[3-5]。然而,虾青素水分散性和稳定性差等缺陷不仅降低其生物利用率,而且严重限制了它在水基食品配方中的使用[6]。
为改善虾青素的水分散性和稳定性,研究者们尝试利用微/纳米技术包埋/分散虾青素,获得了组成和理化性质各异的虾青素水分散体系。例如Bustos-Garza等[7]以100%乳清蛋白为壁材制备的虾青素微胶囊,其水分散性和稳定性良好。Li等[8]采用高压均质法制备的固体脂质虾青素纳米粒具有明显的光热稳定性。刘楠等[9]制备的虾青素/卵磷脂/壳聚糖纳米粒的ζ电位在42~61 mV之间,分散体系稳定。然而,稳定分散的虾青素微/纳米体系能否改善虾青素的体内抗氧化活性,以及其体内活性作用主要受哪些理化因素的影响等问题至今尚不清楚。药剂学研究发现,药物剂型对药物疗效的发挥起着至关重要的作用[10]。研究表明,纳米包载的阿霉素抗肿瘤效果优于微胶囊包载的阿霉素,微胶囊包载的阿霉素的抗肿瘤效果优于游离的阿霉素[11-13],由此推测载体粒子的粒径大小会对所包载物质活性作用的发挥产生重要影响。目前,关于虾青素制品的抗氧化活性已有较多研究,但多集中于体外研究,对虾青素在体内的抗氧化活性,特别是不同虾青素剂型在体内活性和生物利用率方面缺乏系统和深入的研究与报道。
本文基于对虾青素油与水分散型虾青素制品(微囊粉和纳米粉)理化性质的比较分析,重点研究了虾青素剂型对虾青素在体内发挥抗氧化活性的影响。选取虾青素纳米粉剂(Astaxanthinna nopower,Ast-nano)、虾青素微囊剂(Astaxanthin microcapsule,Ast-micro)和虾青素油(Astaxanthin oil,Ast-oil)为研究对象,通过建立急性酒精氧化损伤模型,比较3种不同剂型虾青素制品的体内抗氧化效果,明确不同虾青素剂型在体内功能差异,为虾青素功能制品的合理高效利用提供理论依据及实验支持。
1 材料与方法
1.1 材料
虾青素(Astaxanthin,Ast)、鲑鱼精DNA(Salmon sperm DNA,DNA)购自Sigma公司;虾青素油(Ast-oil)购自湖北雅仕达生物技术有限公司;虾青素微囊剂(Ast-micro)由中国海洋大学食品科学与工程学院薛长湖教授惠赠;壳聚糖(Chitosan;分子量:70 KDa;脱乙酰度:90.25%)、壳寡糖(Water soluble chitosan;分子量:5 KDa;脱乙酰度:90%)购自浙江澳兴生物科技有限公司;赖氨酸买自河南巧手食品添加剂有限公司;超氧化物歧化酶(Superoxide dismutase,SOD)试剂盒、谷胱甘肽(Glutathione,GSH)试剂盒、丙二醛(Malondialdehyde,MDA)试剂盒、蛋白质羰基(Protein carbonyl,PC)试剂盒及血浆和组织中蛋白测定试剂盒均购自南京建成生物工程研究所;乙醇、丙酮及甘露醇均为国产分析纯。
昆明种雄鼠(25~30 g)购自青岛大任富城畜牧有限公司。
1.2 仪器
旋转蒸发器:RE-5210型,上海亚荣生化仪器;Rotavapor R-3型,瑞士Buchi公司;真空泵:V-700型,瑞士Buchi公司;精密增力电动搅拌器:JJ-1型,常州国华电器有限公司;激光粒度仪:3000HS型,英国Malvern仪器公司;场发射扫描电子显微镜:JSM-6700F型,扫描电子显微镜:JSM840型,日本电子株式会社;高效液相色谱仪:Chromaster型,配置二极管阵列检测器(DAD),日本日立公司;真空冷冻干燥机:RLPHR 1-4LD型,德国CHRIST公司。
1.3 方法
1.3.1 虾青素纳米粉剂(Ast-nano)的制备 参考Wang等[14]的方法略作调整,将虾青素溶于乙醇/丙酮溶液(3∶1,v/v)后,用0.45 μm孔径的聚偏氟乙烯膜抽滤得虾青素溶液,调整鲑鱼精DNA和壳聚糖的浓度为0.01 mg/mL,制备得到虾青素/DNA/壳聚糖纳米悬液,室温避光保存。
选用壳寡糖和甘露醇、壳寡糖和赖氨酸两种冻干保护剂体系制备Ast-nano:将纳米悬液与壳寡糖/甘露醇溶液混合,使二者的最终浓度分别为0.05%(m/v)和0.25%(m/v),-80 ℃预冻8 h后进行冷冻干燥,收集粉红色粉末,记为Ast-nano 1,最终冻干粉中保护剂含量约为70%。相似地,将纳米悬液与壳寡糖/赖氨酸溶液混合,使二者在混合液中的浓度分别为0.05%(m/v)和0.005%(m/v),冷冻干燥,记为Ast-nano 2,最终冻干粉中保护剂含量约为65%。避光保存。
1.3.2 各剂型虾青素制品的理化性质表征
微观形态观察:电子显微镜观察新鲜制备Ast-nano及虾青素微囊剂(Ast-micro)的微观形态,将Ast-nano悬液滴加至云母板后置于室温下干燥,同时将Ast-micro直接固定在云母板上,将样品板放入喷雾室喷镀金粉后,2个样品分别用场发射扫描电子显微镜(FE-SEM)和扫描显微镜(SEM)观察[14-15]。Ast-nano和Ast-micro的平均粒径利用Nano Measure1.2软件计算分析得到。
水合粒径及ζ电位测定:激光粒度仪测定新鲜制备Ast-nano悬液及Ast-micro复溶后粒子的水合粒径,多分散指数(Polydispersity index,PDI)和ζ电位[14]。
虾青素含量测定:通过高效液相色谱(HPLC)检测Ast-nano、Ast-micro和虾青素油(Ast-oil)中虾青素含量。各取3 mL Ast-nano和Ast-micro水溶液及Ast-oil油溶液用二氯甲烷/甲醇混合液(1∶1,v/v)重复萃取3次,收集下层萃取液旋转蒸干后,再用1.5 mL二氯甲烷/甲醇混合液(1∶3,v/v)复溶,0.22 μm滤膜过滤后,进样检测[14],虾青素含量的计算公式为:

(1)
溶解时间分析:分别称取500 mg的混合均匀的Ast-nano和Ast-micro放入不同的20 mL血清瓶中,随后加入5 mL去离子水,震荡,计算加入去离子水到溶解完全的时间[16]。
1.3.3 动物分组、给药及氧化损伤
分组方法:小鼠在25°C、12 h光照的房间中,自由饮水、觅食,适应1周后开始实验。将40只小鼠按体重随机分为5组,每组8只,设置为对照组、模型组、Ast-micro组、Ast-oil组、Ast-nano组(采用Ast-nano 1),实验中动物均喂养普通饲料,自由饮水。
给药方法:以虾青素剂量为标准,Ast-micro、Ast-oil和Ast-nano的给药剂量均为0.9 mg/kg·BW,对照组和模型组给予蒸馏水。连续灌胃30天,末次灌胃后,进行酒精急性氧化损伤。
氧化损伤:急性酒精氧化损伤方法参照中国食品药品监督管理局于2012年制定的《抗氧化功能评价方法》中的标准方法,即在30天给药结束后,模型组和实验组(Ast-micro组、Ast-oil组和Ast-nano组)一次性给予50%乙醇12 mL/kg·BW,对照组给予同等体积的生理盐水,自由饮水,6 h后取材(对照组不作处理,不禁食取材)。
1.3.4 样品采集及测定 实验结束,眼球取血并收集组织,部分全血制备2%溶血液;部分全血,2 000 r/min离心10 min分离血浆,置于-80 ℃待测;取一定质量的肝组织,生理盐水冲洗、擦干、称重、剪碎,置于组织匀浆液中,20 000 r/min匀浆10 s,间歇30 s,重复3次,制成一定质量分数组织匀浆(m/v),3 000 r/min离心10 min,取上清液置于-20 ℃待测。血液和肝脏中的谷胱甘肽(GSH)、超氧化物歧化酶(SOD)、丙二醛(MDA)、蛋白质羰基(PC)及组织总蛋白含量等指标均采用试剂盒测定完成。
计算模型组指标相对于对照组指标的变化率CRM/C(Change Rate,%):
(2)
计算实验组指标相对于模型组指标的变化率CRX/M(Change Rate,%):
(3)
(2)和(3)式中指标分别指代各组的GSH、MDA、SOD及PC。
1.3.5 体重记录及脏器指数的测定 实验过程中,每2天测一次体重,记录小鼠生长变化。实验结束后,解剖并观察心、肝、脾、肺、肾、胃、脑等主要脏器。考虑动物体重差异会造成个体之间脏器的重量差异较大,对组织进行脏器指数换算,即:

(4)

2 结果及分析
2.1 各剂型虾青素制品理化性质分析
为分析虾青素纳米粉剂(Ast-nano)、虾青素微囊剂(Ast-micro)和虾青素油(Ast-oil)之间理化性质的差异,对它们的理化性质进行表征,结果如图1和表1所示。首先,利用扫描电镜观察了Ast-nano和Ast-micro的微观结构,由图1可见,新鲜制备的Ast-nano呈规则的球形,分散均匀且粒子大小均一,平均粒径约为50 nm;Ast-micro呈球形或椭球形,但粗糙的表面存在塌陷的情况,且可观察到沙粒状小颗粒(约10 μm)覆盖于微球表面或已剥离球体表面,由Nano Measure1.2分析得到Ast-micro的平均粒径为292 μm。随后,选择不同的冻干保护体系用于Ast-nano的冷冻干燥,并获得了Ast-nano 1和Ast-nano 2两种纳米粉剂,对比溶解速度可知,Ast-micro最易溶于水,10 s内可实现快速溶解,表观溶解度达800 mg/mL;Ast-nano 1和Ast-nano 2均可在30 s内充分溶解,且保护剂溶解度高(S赖氨酸=63 g)、添加量少的Ast-nano 2较保护剂溶解度低(S甘露醇=18.2 g)、添加量大的Ast-nano 1的溶解速度快,说明冻干保护剂的亲水性和添加量对纳米体系的溶解速率有较大影响。进一步检测微/纳米悬液中粒子的水合粒径,以及PDI和ζ电位(PDI值和ζ电位作为表征胶体分散体系均匀度和稳定性的指标)发现[17],Ast-nano 1、Ast-nano 2和Ast-micro在复溶后的水合粒径分别为547、305和190 nm,Ast-micro复溶后的水合粒径显著小于Ast-nano复溶后的水合粒径,但Ast-micro悬液的PDI值为0.48,ζ电位为-18 mV,较大的PDI和近电中性的ζ电位说明Ast-micro的水相分散体系的均匀度和稳定性较差。而不同的Ast-nano:Ast-nano 1和Ast-nano 2的ζ电位均大于40 mV,特别是Ast-nano 2的PDI小于0.3,说明Ast-nano 2具有比Ast-nano 1更好的稳定性。最后,利用HPLC检测Ast-micro和Ast-nano粉剂中的虾青素含量,结果表明Ast-nano 2的虾青素含量最高,高达18.34%,分别是Ast-nano 1和Ast-micro中虾青素含量的6.35倍和2.49倍,主要得益于Ast-nano 2中保护剂添加量较少。另外,Ast-oil中虾青素的含量最低,仅为0.31%,但其工艺相对简单,易于产业化。
(A:新鲜制备虾青素/DNA/壳聚糖纳米混悬液场发射扫描图;B:虾青素微囊剂扫描图。A:FE-SEM of freshastaxanthin/DNA/chitosan nano-suspensions;B:SEM of Ast-micro.)
图1 新鲜制备虾青素/DNA/壳聚糖纳米混悬液及虾青素微囊剂的扫描电镜图
Fig.1 Scanning electron micrographs of fresh astaxanthin/DNA/chitosan nano-suspensions and Ast-micro

表1 不同剂型虾青素制品的理化性质结果Table 1 Results of physical and chemical properties of different astaxanthin products
注:虾青素含量是指虾青素纳米粉剂、虾青素微囊剂或虾青素油中虾青素所占比例;标有不同字母的数据表示相互之间差异显著(P<0.05)。
Note:Astaxanthin content was the proportion of astaxanthin in Ast-nano,Ast-micro or Ast-oil;Data with different letters indicated significant differences (P<0.05).
①Sample;②Astaxanthin content;③Dissolution time;④Hydrous particle diameter;⑤Poly dispersity index(PDI);⑥Zeta potential;⑦Ast-micro;⑧Ast-oil
2.2 模型评价
为评价虾青素纳米粉剂(Ast-nano)、虾青素微囊剂(Ast-micro)和虾青素油(Ast-oil)在体内抗氧化活性的差异,本研究建立了急性酒精氧化损伤模型。建模后,模型组小鼠均出现行动缓慢、站立不稳、嗜睡等明显的酒精中毒现象,其与对照组小鼠各生化指标的比较结果见图2。在模型组中,无论血浆还是肝脏,生化指标与对照组相比均存在显著变化,GSH含量和SOD活力显著下降,MDA与PC含量显著增加。血浆和肝脏中GSH含量均超过21%,SOD活力下降超过17%,MDA与PC含量上升均超过25%,血浆中PC含量变化最大,变化率为83%。结果证实,模型组小鼠体内GSH含量显著下降,显示出GSH的耗竭,且酒精大量摄入造成的氧化应激使脂质和蛋白质分别氧化产生大量的MDA和PC,同时导致体内抗氧化酶SOD的活性降低,表明成功建立了小鼠急性酒精氧化损伤模型。

图2 急性酒精氧化损伤小鼠肝脏和血浆中谷胱甘肽、丙二醛、超氧化物歧化酶及蛋白质羰基的变化率(n=8)Fig.2 Change rate of GSH,MDA,SOD and PC in liver and plasma of mice with acute alcohol oxidative injury (n=8)
2.3 虾青素制品剂型对小鼠体质量及脏器指数的影响
2.3.1 小鼠体质量变化 为分析虾青素纳米粉剂(Ast-nano)、虾青素微囊剂(Ast-micro)和虾青素油(Ast-oil)对小鼠整体生存状态的影响,本研究连续记录了小鼠30天内的体质量变化(见图3),各组小鼠体质量变化均无显著差异(P>0.05),各组小鼠体质量均在正常波动范围内逐渐增长,实验结束时各组小鼠的体质量均维持在40 g左右。实验过程中小鼠均无不良症状出现,健康状态良好,未出现死亡现象,表明Ast-nano、Ast-micro和Ast-oil均对小鼠体质量变化无显著影响。然而,Ast-oil组小鼠体质量较其余各组略高,分析原因是Ast-oil中的油脂含量较高造成小鼠体质量增长较快。
2.3.2 脏器指数 脏器指数可反映动物总体营养状态及器官状况,因此,本研究在实验结束后,解剖并观察心、肝、脾、肺、肾及脑等主要组织的状态,均未发现异常。将组织称重并计算脏器指数,如图4所示,各组小鼠的心指数均在0.5%左右,脾指数在0.23%左右,肺指数在0.5%左右。肝、肾及脑等组织的脏器指数均在一定范围内波动,肝脏指数波动范围较大,为4.16%~4.64%,而肾指数和脑指数的波动范围较小,分别为1.27%~1.44%和0.95%~1.13%。脏器指数在正常范围内产生波动的现象是由动物个体差异造成的[18],各组小鼠的心、肝、脾、肺、肾及脑等的脏器指数之间并不存在显著性差异(P>0.05)。因此,实验表明Ast-nano、Ast-micro和Ast-oil灌胃给药后均不会对小鼠脏器产生影响。
2.4 肝脏和血浆生化指标的检测
为评价虾青素纳米粉剂(Ast-nano)、虾青素微囊剂(Ast-micro)和虾青素油(Ast-oil)在体内的抗氧化效果,本文对肝脏和血浆中GSH含量、SOD活性、MDA及PC含量进行测定,并计算实验组生化指标相对于模型组的变化(见图5),变化率值越大表明抗氧化效果越明显。肝脏中检测结果显示,Ast-nano、Ast-micro和Ast-oil均对氧化损伤小鼠起到保护作用。然而,Ast-nano、Ast-micro和Ast-oil对氧化损伤小鼠的保护作用却显著不同。Ast-nano组小鼠肝脏中的GSH含量和SOD活性相对于模型组小鼠变化最为明显,变化率分别约为80%和31%。Ast-micro组小鼠肝脏中的GSH和SOD变化率分别约为57%和23%。Ast-oil对GSH和SOD的作用效果最弱,二者的变化率分别约为39%和20%。同样,对MDA和PC而言,Ast-nano的作果最强,变化率分别约为-38%和-41%。Ast-micro组MDA和PC的变化率分别约为-25%和-27%,Ast-oil组MDA和PC的变化率分别约为-24%和-25%,说明Ast-micro对MDA和PC作用效果略微优于Ast-oil。结果表明,不同剂型虾青素制品对肝脏氧化后的抗氧化效果不同,Ast-nano优于Ast-micro和Ast-oil,Ast-micro优于Ast-oil。

图3 不同虾青素制剂(虾青素给药剂量均为0.9 mg/kg·BW)对小鼠体质量的影响(n=8,P>0.05)Fig.3 Effect of different astaxanthin formulations (The astaxanthin dosage was 0.9 mg/kg·BW)on the body weight of mice (n=8,P>0.05)
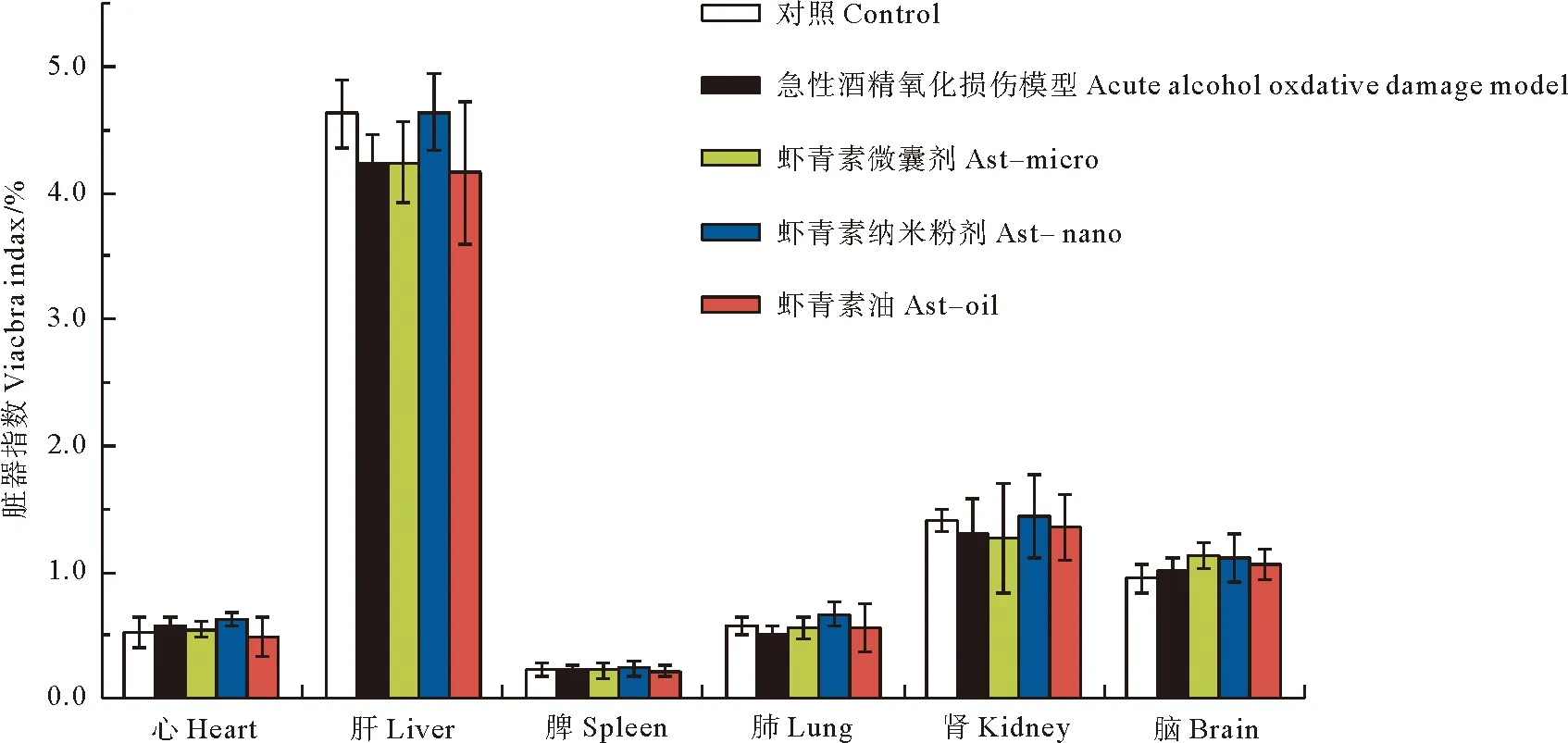
图4 灌胃给药30天后不同虾青素制剂(虾青素给药剂量均为0.9 mg/kg·BW)对小鼠脏器指数的影响(n=8,P>0.05)Fig.4 Effect of different astaxanthin formulations(The astaxanthin dosage was 0.9 mg/kg·BW)on viscera index in mice after 30 days of intragastric administration(n=8,P>0.05)

图5 虾青素微囊剂、虾青素纳米粉剂和虾青素油对肝脏(A)和血浆(B)中生化指标的影响(n=8,*:P<0.05)Fig.5 Effects of Ast-micro,Ast-nano and Ast-oil on biochemical indexes in the liver (A)and plasma (B)(n=8,*:P<0.05)
血浆中检测结果显示,Ast-nano可显著提高GSH含量和SOD活性,降低MDA和PC含量。相较于模型组,Ast-nano组中GSH和SOD的变化率分别为47.42%和43.25%,MDA和PC的变化率分别为-36.94%和-37.69%。口服Ast-micro后,小鼠血浆中GSH和SOD相对于模型组的变化率分别为15.04%和30.85%,MDA和PC相对于模型组的变化率分别为-5.69%和-13.4%。同样,口服Ast-oil后,血浆中的GSH、SOD及PC也会发生显著变化,与模型组相比变化率分别为13.97%,37.23%和-14.04%。然而,令人意外的是,Ast-oil组中MDA的含量相对于模型组而言不降反增,这种现象可能是由油脂摄入过多在体内积累,进而被氧化所导致[19]。实验数据表明虾青素制品的不同剂型对机体氧化损伤后血液中抗氧化酶、抗氧化物质及脂质氧化和蛋白质氧化产生的抗氧化作用不同,体内抗氧化效果Ast-nano优于Ast-micro优于Ast-oil。
3 讨论
目前,商品虾青素制品主要分为水分散和油分散两大类。由于虾青素见光易分解,易被氧化等特点[20-21],油分散虾青素多采用胶囊配方,且在市场较为常见。水分散虾青素制品主要有固体粉剂和乳剂,相对于乳剂,固体粉剂更利于长期稳定和贮运。粉剂溶于水后为胶体或悬浊液体系[22-24]。虾青素含量和溶解时间为评价固体粉剂水分散效果的两大重要指标。本文对所选用的虾青素纳米粉剂(Ast-nano)和虾青素微囊剂(Ast-micro)进行了虾青素含量、溶解时间等理化性质的测定。实验结果显示,Ast-nano和Ast-micro中虾青素含量分别为18.34%和7.36%,与雨生红球藻中虾青素含量(5%)相比分别提高了266.8%和47.2%,表明Ast-nano和Ast-micro均能显著提高水相体系中的虾青素含量。同时,Ast-nano、Ast-micro在冷水中的溶解时间均不超过30 s,属于速溶制剂[25]。这些结果预示着Ast-nano和Ast-micro均可良好分散于水相体系中,大大拓展虾青素制品的应用范围。
在虾青素不同剂型制备的基础上,本文建立了急性酒精氧化损伤模型以研究不同虾青素制剂对氧化损伤小鼠的保护作用。虾青素能够有效地清除氧自由基,防止氧化应激反应产生的大量氧自由基对细胞DNA、细胞膜脂质和蛋白质造成损伤,使机体维持正常状态[26-28]。谷胱甘肽(GSH)、蛋白质羰基(PC)和丙二醛(MDA)含量及超氧化物歧化酶(SOD)活性的测定结果表明,Ast-nano、Ast-micro和Ast-oil在清除自由基、降低过氧化物和增强机体抗氧化性能等方面均具有显著功效,然而不同剂型虾青素制品的抗氧化效果却不尽相同。总体而言,虾青素水分散制剂产生的抗氧化效果优于油分散制剂,可能是由于过量油脂增加了肠道消化负担,反而不利于Ast-oil的吸收利用[29]。这与Huo[30]和Failla[31]等报道的食品基质中的脂质种类和含量影响脂溶性类胡萝卜素在肠道的吸收相一致。此外,令人感到意外的是虾青素油组小鼠血浆中的MDA含量不降反升,竟比氧化损伤模型组的还高1.8%,猜测其原因可能是:油脂摄入过多在体内积累,进而被氧化所会导致血浆中MDA含量升高[32],同时过量的脂质在消化液的作用下会形成体积较大脂类混合微团,不利于脂类物质在小肠中的吸收[33]。另外,Ast-nano具有更明显的体内抗氧化效果:Ast-nano可使氧化损伤小鼠血浆中的GSH、SOD、MDA和PC四项生化指标恢复到正常水平,而虾青素微囊剂组小鼠血浆中GSH和MDA的变化率约为虾青素纳米粉剂组的33%和14%;同样,Ast-nano也可使氧化损伤小鼠肝脏中的生化指标恢复至正常水平,而虾青素微囊剂组中生化指标的相对变化率约为虾青素纳米粉剂组的70%。对于Ast-nano和Ast-micro产生的体内抗氧化差异,猜测其可能与包载虾青素粒子的大小及所带电荷的种类和多少等因素有关:Ast-nano复溶后的ζ电位均为正值,大于40 mV,Ast-micro复溶后的电位为-18 mV。由于小肠黏膜细胞表面分布大量的负电荷,更易于粘附和吸收正电荷纳米粒[34],而且Cook等[35]研究表明,壳聚糖作为吸收促进剂可显著增强纳米粒的吸收,因此Ast-nano发挥出更佳的抗氧化效果。基于此,可知虾青素纳米制剂的抗氧化效果依次为:Ast-nano优于Ast-micro优于Ast-oil,说明水分散型的虾青素微/纳米体系显示出比虾青素油的更强抗氧化作用。除此之外,结果表明虾青素对氧自由基抑制途径均产生显著的促进作用,各指标间的变化上差异显著,表明虾青素对各个抑制途径的作用不同,这与Hirotaka等的研究结果相似[36]。
4 结语
研究表明,虾青素纳米粉剂(Ast-nano)和虾青素微囊剂(Ast-micro)均具有较好的水分散性且虾青素含量较高,有利于虾青素制品在水基食品和医药制品中的广泛应用,从而大大拓展其应用范围。同时,本研究还表明,不同剂型虾青素对酒精造成的氧化应激均会产生正向作用,提高机体抗氧化酶活性和降低脂质过氧化,但不同的剂型对虾青素抗氧化功能的发挥产生的作用不同。对比不同剂型虾青素的抗氧化研究结果发现,纳米粉剂更有利于虾青素抗氧化功能的发挥。本研究结果为高活性虾青素制品的开发和微/纳米营养载运系统的理性设计提供了有力的理论依据和技术支持。

