微小RNA在肝癌耐药Bel-7402/5-FU细胞中的表达分析*
赵锦燕 尚海霞 曾建伟 兰炜兰 洪振丰#
(1 福建中医药大学中西医结合研究院 福州 350122;2 福建省中西医结合老年性疾病重点实验室 福州 350122)
原发性肝癌是常见的恶性肿瘤之一,2018 年全球癌症统计数据分析显示原发性肝癌死亡率居全球癌症死亡率的第四位。在我国,由于慢性肝炎和黄曲霉素污染的食物摄入使得肝癌的发病率和致死率均居高不下[1]。目前,肝癌的治疗仍以综合化疗为主,然而肿瘤多药耐药的发生导致肝癌治疗效果不佳[2]。微小RNA(MicroRNA,miRNA)是一类普遍存在的非编码小分子RNA,主要作用于靶基因3′非翻译区(Untranslated Region,UTR),引起靶mRNA的降解或抑制其翻译,参与调控机体的各项生理病理活动(包括肿瘤)[3~5]。为探讨miRNA 在肝癌耐药中的作用,本研究应用miRNA 表达谱芯片筛选肝癌多药耐药细胞异常表达的miRNA,以寻找能够逆转肝癌多药耐药的治疗靶点。现报道如下:
1 实验材料与方法
1.1 实验材料
1.1.1 细胞株 Bel-7402 细胞及其5-氟尿嘧啶(5-FU)诱导的耐药株Bel-7402/5-FU 购自南京凯基生物科技发展有限公司。
1.1.2 实验试剂 Agilent 人miRNA 芯片19.0(博奥生物有限公司);胎牛血清(FBS)、0.25%胰酶和RPIM1640 基础培养基(美国life technologies 公司);RNAiso for small RNA、Uni-miR qPCR Primer和SYBR PrimeScriptTMmiRNA RT-PCR kit(宝生物工程大连有限公司)。
1.2 实验方法
1.2.1 细胞培养 Bel-7402 细胞和Bel-7402/5-FU细胞分别培养于RPMI 1640 完全培养基(含10%FBS、100 U/ml 青霉素和100 μg/ml 链霉素)和含20 μg/ml 5-FU 的RPMI 1640 完全培养基(含10%FBS、100 U/ml 青霉素和100 μg/ml 链霉素),37℃,5%CO2饱和湿度的CO2培养箱内。检测指标前将Bel-7402/5-FU 细胞更换成正常的RPMI 1640 完全培养基培养。
1.2.2 MTT 法验证Bel-7402/5-FU 的耐药性 分别取处于指数生长期的Bel-7402 细胞和(或)Bel-7402/5-FU 细胞,以5 000 个细胞/孔接种于96孔板,每孔100 μl,置细胞培养箱中过夜,分别用不同浓度的5-氟尿嘧啶(0~25 600 μM)、阿霉素(0~256 μM)、顺铂(0~128 μM)干预48 h 后用MTT法检测,每组设8 个复孔。对照组的细胞活力按100%计算。
1.2.3 miRNA 表达谱分析 取对数生长期Bel-7402 细胞和(或)Bel-7402/5-FU 细胞,分别以2.0×105/孔的密度接种于6 孔板中,每组3 个样本,常规培养48 h,弃上清,每孔加Trizol 1 ml 提取总RNA,琼脂糖凝胶电泳检测细胞样本RNA 的完整性。然后,每个样品单独标记,进行芯片实验,以得到该样品中miRNA 的表达,按照Agilent miRNA标准标记方法进行荧光标记后和芯片进行杂交、清洗。使用生物芯片扫描仪扫描,获取每个阵列荧光染料的扫描图像和数据,并以TIFF 的文件格式保存图像和数据。使用基因芯片提数软件提取数据,选择合适的数据归一化方法,得到各个RNA 样品的杂交信号,并选择出差异性表达的miRNA 基因,常规筛选标准为:p-value≤5%,同时FC(abs)在2.0 倍以上。
1.2.4 RT-qPCR 验证 按上述方法收集细胞,应用RNAiso for small RNA 提取miRNA,应用SYBR PrimeScriptTMmiRNA RT-PCR kit 进行Poly(A)加尾反应和反转录反应,向20 μl 逆转录产物中加无RNA 酶的去离子水补足至100 μl,取2 μl 稀释液进行后续的real-time PCR 反应。反应体系(20 μl):SYBR Premix Ex TaqⅡ(2×)10 μl,PCR Forward Primer(10 μm)0.8 μl,Uni-miR qPCR Primer(10 μm)0.8 μl,Rox Reference Dye Ⅱ(50×)0.4 μl,cDNA 溶液2 μl 和dH2O 6 μl。
1.3 统计学方法 采用SPSS18.0 统计学软件对数据进行分析,计量资料用表示,采用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 Bel-7402/5-FU 细胞具有多药耐药性 与Bel-7402 比较,Bel-7402/5-FU 对5-氟尿嘧啶、阿霉素和顺铂均具有耐药性,5-氟尿嘧啶对Bel-7402 和Bel-7402/5-FU 的抑制率分别是(100.00±3.20)%、(31.41±2.34)%、(18.84±0.56)%、(15.25±0.21)%、(14.37±0.22)%、(14.22±0.21)%、(14.70±0.29)%、(13.75±0.11)%、(13.60±0.13)%、(13.93±0.23)%和(100.00±0.96)%、(100.00±0.76)%、(99.76±1.59)%、(91.75±0.88)%、(90.41±1.10)%、(85.18±1.88)%、(79.97±1.30)%、(75.66±0.76)%、(69.18±1.29)%、(67.38±1.31)%,阿霉素对Bel-7402 和Bel-7402/5-FU 的抑制率分别是(100.00±3.70)%、(82.07±2.11)%、(80.67±1.29)%、(51.34±1.38)%、(20.78±0.21)%、(22.91±0.30)%、(34.08±1.50)%、(24.41±0.24)%、(26.93±0.35)%、(28.66±0.29)%和(100.00±1.64)%、(88.37±1.06)%、(89.10±2.44)%、(87.87±1.25)%、(83.81±1.62)%、(84.39±1.82)%、(87.43±2.42)%、(79.97±1.87)%、(67.15±0.95)%、(59.62±0.43)%,顺 铂 对Bel-7402 和Bel-7402/5-FU 的抑制率分别是(100.00±4.96)%、(92.46±2.34)%、(90.28±3.75)%、(73.27±4.01)%、(63.13±4.20)%、(41.97±0.18)%、(10.41±0.11)%、(10.89±0.30)%和(100.00±2.41)%、(95.63 ±1.32)%、(96.31±2.51)%、(94.49±2.04)%、(93.30±2.29)%、(91.54±2.32)%、(90.33±1.37)%、(90.18±1.03)%,差异均有统计学意义(P<0.05)。见图1。

图1 Bel-7402/5-FU 细胞对5-氟尿嘧啶、阿霉素和顺铂耐药性
2.2 miRNA 在耐药细胞中的差异表达谱 选择P值≤5%,同时FC(abs)在2.0 倍以上的miRNA 做聚类分析图和散点图,发现差异表达的miRNA 有29个,其中上调14 个,下调15 个。见图2、图3。
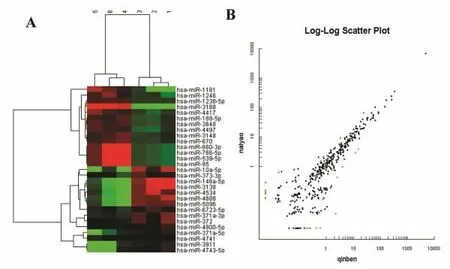
图2 miRNA 芯片检测耐药细胞中miRNA 的差异表达
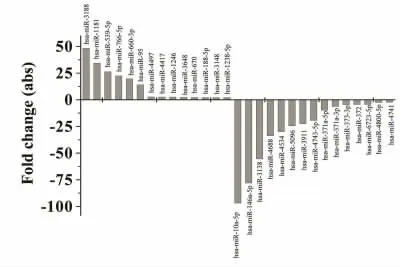
图3 差异表达的miRNA 柱形图
2.3 差异表达miRNA 的验证 采用qPCR 验证miRNA 芯片中FC(abs)大于2 的miRNA,结果发现与Bel-7402 细胞比较,有9 个验证结果与芯片结果相符,其中miR-10a-5p、-371a-3p、-371a-5p、-372、-373-3p、-146a-5p、-6723-5p 下 调,miR-3148、-4497上调,差异具有统计学意义(P<0.05)。见图4。

图4 miRNA 验证结果
3 讨论
肿瘤的多药耐药是指肿瘤细胞对一种抗肿瘤药物产生抗药性的同时,对结构和作用机制不同的其他抗肿瘤药物也产生耐药的一种交叉抗药性,是目前肝癌治疗的主要障碍[6],克服肿瘤多药耐药是肝癌治疗方法未来研究的重点。然而肿瘤细胞多药耐药产生是一个十分复杂的过程,它可能是初次使用就产生耐药的原发性耐药,也可能是用过一段时间之后产生的获得性耐药。耐药基因mdr1/P-gp 高表达导致细胞外排功能增加是目前较为公认的机制,研究者针对P-gp 的作用靶点研发了很多抑制剂,但由于副作用等诸多原因,很少能真正用于临床。所以研发新型的、高效低毒的肝癌多药耐药逆转剂任重而道远。
非编码RNA 是表观遗传学的重要组成部分,随着研究的深入,越来越多研究发现miRNA 的表达能够影响肝癌多药耐药[7~8]。本研究通过miRNA表达谱芯片筛选肝癌耐药细胞株中差异表达的miRNA,并通过荧光定量PCR 验证,探讨miRNA在肝癌耐药中的作用。研究发现在肝癌耐药中,有9个miRNA 表达发生改变(miR-10a-5p、-371a-3p、-371a-5p、-372、-373-3p、-146-5p、-6723-5p 下 调,miR-4497、-3148 上调),表明在肝癌耐药的发生中,miRNA 发挥了重要作用。目前研究发现,上述miRNA 在不同肿瘤中可能发挥不同的作用(miR-371a-3p、miR-371a-5p 和miR-6723-5p 未见报道)。miR-10a-5p 在食道鳞癌[9]、乳腺癌[10~12]和肾细胞癌[13]中具有抑癌作用,而在颗粒癌[14]、非小细胞肺癌[15]和神经胶质瘤[16]中促进肿瘤的生长、迁移和侵袭。miR-372 抑制肺癌和肾细胞癌的迁移、侵袭以及上皮-间质转化[17~19]。在鼻咽癌中,miR-372 可以通过激活PBK 依赖的p53 途径抑制癌细胞的转移,从而增加放疗的敏感性[20];而在胃癌、肝癌和乳腺癌中,miR-372 促进肿瘤的发展进程和转移[21~23]。miR-373在膀胱癌、黑色素瘤、骨肉瘤和食道鳞癌中作为促癌miRNA 发挥作用[24~27],而在对非小细胞肺癌和前列腺癌的研究中发现,miR-373 能够抑制癌细胞的生长和转移[28~29]。miR-146 在不同的肿瘤中发挥不同的作用,在肺癌和甲状腺乳头状癌中发挥促癌作用[30~31],在乳腺癌中则抑制肿瘤转移[32]。有关miR-3148和miR-4497 的研究较少,目前的研究发现miR-3148 具有促癌作用,miR-4497 具有抑癌作用[33~34],而这些miRNA 在肿瘤多药耐药中的作用尚未明确,有待我们进一步研究。miRNA 调控肝癌多药耐药的机制复杂,随着研究的深入,我们希望能够通过调控miRNA 成为低毒有效且不干扰抗肿瘤药物的耐药逆转剂。

