红海葱化学成分和药理作用的研究进展
魏嘉宝,吴燕红,李苑新
广东药科大学新药研发中心,广州 510006
红海葱为百合科风信子亚科海葱属植物(Urgineamaritima)的干燥球根,其始用于公元前1 500年,现记载于《英国植物志》。红海葱多生长于沿海沙地、干旱石缝等海拔较低的地区,主要分布于加那利群岛、葡萄牙、北非、印度、以色列以及伊朗南部等地区[1]。因其具有滋补、消食、利尿、平喘、杀虫等多种功效,古代临床上常以醋蜜剂、糖浆剂、酊剂及生品捣碎贴敷等形式用于治疗脘腹胀满、气喘咳嗽、水肿、冻伤等多种疾病[1];现代研究表明红海葱中含有三萜类、黄酮类、有机酸类、生物碱、多糖等多种活性成分,对治疗充血性心衰、心律不齐、恶性肿瘤、哮喘、水肿、关节炎等疾病均有显著性疗效[2]。
目前,从红海葱中分离提纯的化学成分主要为三萜类和黄酮类。现代初步药理研究红海葱中的三萜类具有抗癌、抗心衰作用,其中海葱苷具有增强心肌收缩力、调节心律的作用,可用于治疗充血性心力衰竭;海葱次苷A能促使乳腺癌、前列腺癌、肝癌等多种恶性肿瘤细胞凋亡。黄酮类则具有较好的抗炎作用,对风湿关节炎、支气管炎及哮喘痰咳等疾病具有显著性疗效[3]。然而,红海葱的药效物质基础、作用机制及相关的构效关系研究甚少,阻碍其进一步开发利用。本文主要通过归纳总结国内外关于红海葱主要化学成分及药理作用的研究,为进一步深入探明其有效成分的作用机制及相关的构效关系提供初步的参考依据。
1 海葱的化学成分研究
1.1 萜类
截止目前为止,从红海葱中分离的萜类化合物有70多种,其中大多数为蟾蜍二烯羟酸内酯类,其母核见图1,且多为达玛烷型类三萜类化合物,只有少数是其他萜类成分。其化学结构见表1和图2。

图1 红海葱的蟾蜍二烯羟酸内酯母核Fig.1 Structural skeleton of bufadienolides in Urginea maritima
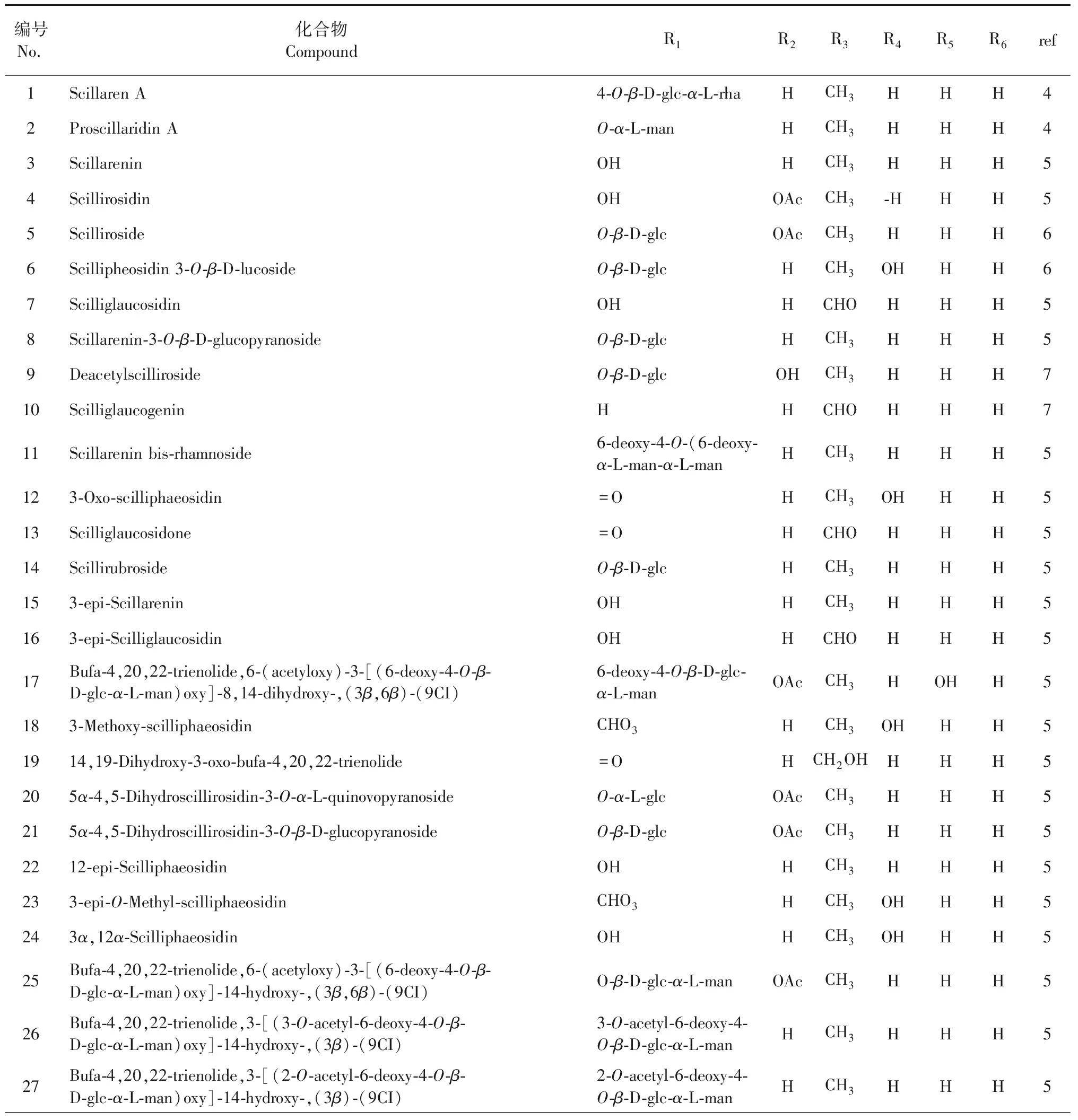
表1 红海葱的蟾蜍二烯羟酸内酯类成分
续表1(Continued Tab.1)

编号No. 化合物CompoundR1R2R3R4R5R6ref286β-Acetoxy-scillarenin-3-O-β-D-glucopyranoside6-(acetyloxy)-3-β-D-glcOAcCH3HHH529Glucoscillaren AO-β-D-glc-O-β-D-glc-6-deoxy-α-L-manHCH3HHH830Scilliphaeoside6-deoxy-α-L-manHCH3OHHH831Glucoscillipheoside6-deoxy-4-O-β-D-glc-α-L-manHCH3OHHH8329-Hydroxyscilliphaeoside6-deoxy-α-L-manHCH3OHHH833Bufa-4,20,22-trienolide,3-[(4-O-β-D-glucopyranosyl-β-D-glucopyrano-syl)oxy]-14-hydroxy-,(3β)-(9CI)O-β-D-glc-β-D-glcHCH3HHH834Scillirosidin3-O-α-L-rhamnopyranoside6-deoxy-α-L-manOAcCH3HOHH535Bufa-4,20,22-trienolide,3-[[6-deoxy-4-O-(6-deoxy-α-L-man)-α-L-man]oxy]-8,14-dihydroxy-,(3β)-(9CI)6-deoxy-4-O-6-deoxy-α-L-man-α-L-manHCH3HOHH536Bufa-20,22-dienolide,6-(acetyloxy)-3-[(6-deoxy-4-O-β-D-glc-3-O-methyl-α-L-glc)oxy]-8,14-dihydroxy-,(3β,5α,6β)-(9CI)6-deoxy-4-O-β-D-glc-rhaOAcCH3HOHH83712β-Hydroxyscilliroside6-(acetyloxy)-3-(β-D-glcOAcCH3OHOHH73812β-HydroxyscillirosidinOHOAcCH3OHOHH839Bufa-4,20,22-trienolide,6-(acetyloxy)-3-[(4-O-β-D-glc-β-D-glc)oxy]-8,14-dihydroxy-,(3β,6β)-(9CI)6-(acetyloxy)-3-(4-O-β-D-glc-β-D-glcOAcCH3HOHH840Bufa-20,22-dienolide,6-(acetyloxy)-3-[(O-β-D-glc-(1-4)-O-β-D-glc-(1→4)-6-deoxy-3-O-methyl-α-L-glc)oxy]-8,14-dihydroxy-,(3β,5α,6β)-(9CI)O-β-D-glc-O-β-D-glc-6-deoxy-3-O-methyl-α-L-glcOAcCH3HOHH841Bufa-20,22-dienolide,6-(acetyloxy)-3-[(6-deoxy-4-O-β-D-glc-3-O-methyl-α-L-glc)oxy]-8,12,14-trihydroxy-,(3β,5α,6β,12β)-(9CI)O-β-D-glc-3-O-meth-yl-α-L-glcOAcCH3OHOHH842Bufa-4,20,22-trienolide,3-[(4-O-β-D-glc-β-D-glc)oxy]-8,14-di-hydroxy-,(3β)-9CI)O-β-D-glc-β-D-glcHCH3HOHH843Bufa-4,20,22-trienolide,3-[(4-O-β-D-glc-β-D-glc)oxy]-8,14-di-hydroxy-,(3β)-9CI)O-β-D-glc-O-β-D-glc-6-deoxy-α-L-manHCH3HOHH844Bufa-4,20,22-trienolide,3-(β-D-glc)-6,8,12,14-tetrahydroxy-,(3β,6β,12β)-(9CI)O-β-D-glcOHCH3OHOHH845Bufa-4,20,22-trienolide,3-[(6-deoxy-α-L-man)oxy]-8,12,14-trihy-droxy-,(3β,12β)-(9CI)6-deoxy-α-L-manHCH3OHOHH846Bufa-4,20,22-trienolide,3-[(6-deoxy-α-L-man)oxy]-14,16-di-hydroxy-,(3β,16β)-(9CI)6-deoxy-α-L-manHCH3HHOH847Bufa-4,20,22-trienolide,3-(β-D-glc)-14,16-dihydroxy-(3β,16β)-(9CI)β-D-glcHCH3HHOH848Bufa-4,20,22-trienolide,3-[(O-β-D-glc-(1-4)-O-β-D-glc-(1-4)-6-de-oxy-α-L-man)oxy]-14,16-dihydroxy-,(3β,16β)-(9CI)O-β-D-glc-O-β-D-glc-6-deoxy-α-L-manHCH3HHOH849Bufa-4,20,22-trienolide,16-(acetyloxy)-3-[(6-deoxy-α-L-man)oxy]-14-hydroxy-,(3β,16β)-(9CI)6-deoxy-α-L-manHCH3HHOAc850Bufa-4,20,22-trienolide,16-(acetyloxy)-3-[(O-β-D-glc-(1→4)-O-β-D-glc-(1→4)-6-deoxy-α-L-glc)oxy]-14-hydroxy-,3β,16β)-(9CI)O-β-D-glc-O-β-D-glc-6-deoxy-α-L-glcHCH3HHOAc851Bufa-4,20,22-trienolide,16-(acetyloxy)-3-[(O-β-D-glc-(1→4)-O-β-D-glc-(1→4)-6-deoxy-α-L-glc)oxy]-14-hydroxy-,3β,16β)-(9CI)β-D-glcHCH3HHOAc852Bufa-4,20,22-trienolide,16-(acetyloxy)-3-[(4-O-β-D-glc-β-D-glc)oxy]-8-hydroxy-,(3β,16β)-(9CI)4-O-β-D-glc-β-D-glclHCH3HHOAc853Bufa-4,20,22-trienolide,16-(acetyloxy)-3-[(O-β-D-glc-(1→4)-O-β-D-glc-(1→4)-6-deoxy-α-L-man)oxy]-14-hydroxy-,(3β,16β)-(9CI)O-β-D-glcl-O-β-D-glc-6-deoxy-α-L-manHCH3HHOAc8
续表1(Continued Tab.1)
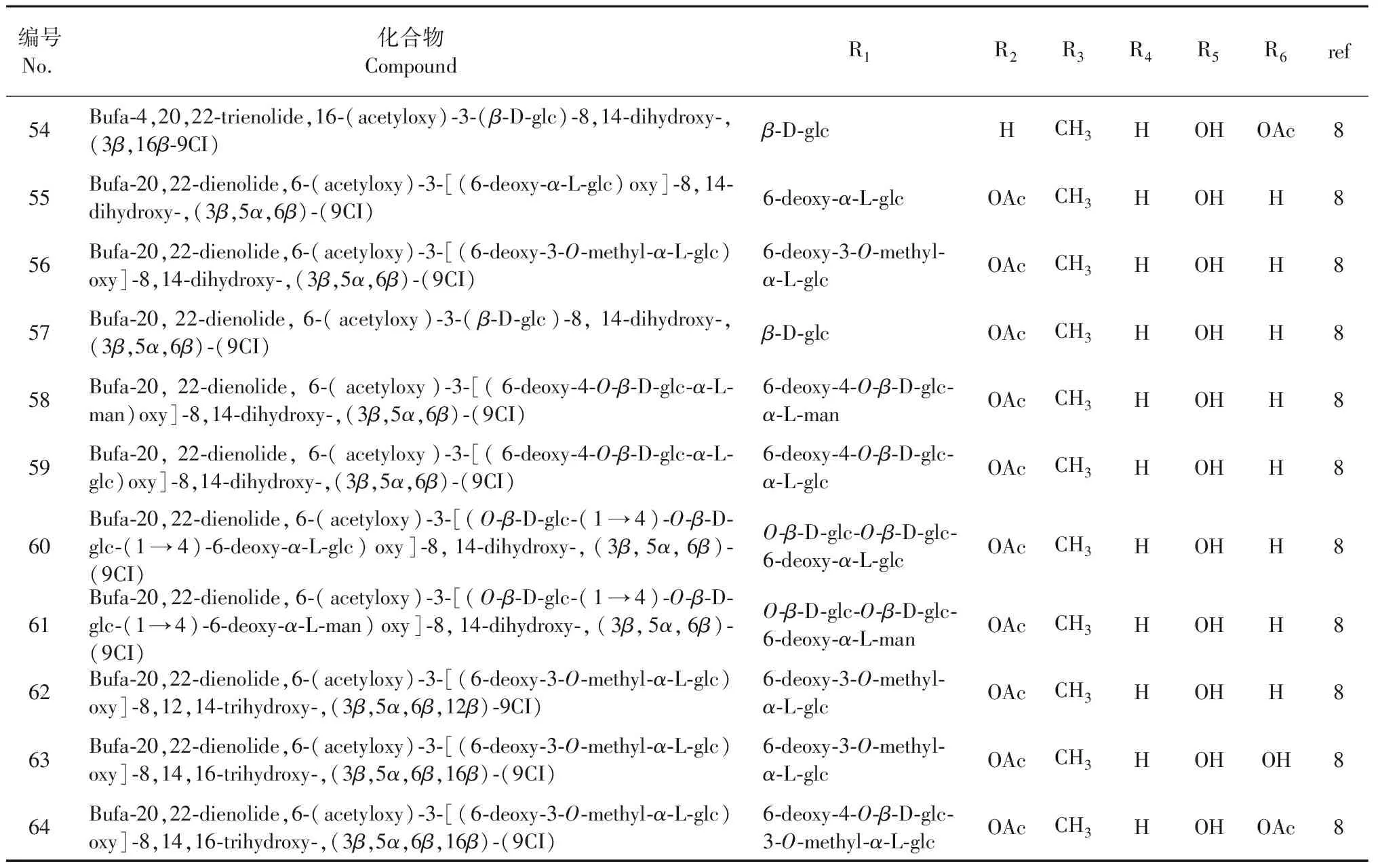
编号No. 化合物CompoundR1R2R3R4R5R6ref54Bufa-4,20,22-trienolide,16-(acetyloxy)-3-(β-D-glc)-8,14-dihydroxy-,(3β,16β-9CI)β-D-glcHCH3HOHOAc855Bufa-20,22-dienolide,6-(acetyloxy)-3-[(6-deoxy-α-L-glc)oxy]-8,14-dihydroxy-,(3β,5α,6β)-(9CI)6-deoxy-α-L-glcOAcCH3HOHH856Bufa-20,22-dienolide,6-(acetyloxy)-3-[(6-deoxy-3-O-methyl-α-L-glc)oxy]-8,14-dihydroxy-,(3β,5α,6β)-(9CI)6-deoxy-3-O-methyl-α-L-glcOAcCH3HOHH857Bufa-20,22-dienolide,6-(acetyloxy)-3-(β-D-glc)-8,14-dihydroxy-,(3β,5α,6β)-(9CI)β-D-glcOAcCH3HOHH858Bufa-20,22-dienolide,6-(acetyloxy)-3-[(6-deoxy-4-O-β-D-glc-α-L-man)oxy]-8,14-dihydroxy-,(3β,5α,6β)-(9CI)6-deoxy-4-O-β-D-glc-α-L-manOAcCH3HOHH859Bufa-20,22-dienolide,6-(acetyloxy)-3-[(6-deoxy-4-O-β-D-glc-α-L-glc)oxy]-8,14-dihydroxy-,(3β,5α,6β)-(9CI)6-deoxy-4-O-β-D-glc-α-L-glcOAcCH3HOHH860Bufa-20,22-dienolide,6-(acetyloxy)-3-[(O-β-D-glc-(1→4)-O-β-D-glc-(1→4)-6-deoxy-α-L-glc)oxy]-8,14-dihydroxy-,(3β,5α,6β)-(9CI)O-β-D-glc-O-β-D-glc-6-deoxy-α-L-glcOAcCH3HOHH861Bufa-20,22-dienolide,6-(acetyloxy)-3-[(O-β-D-glc-(1→4)-O-β-D-glc-(1→4)-6-deoxy-α-L-man)oxy]-8,14-dihydroxy-,(3β,5α,6β)-(9CI)O-β-D-glc-O-β-D-glc-6-deoxy-α-L-manOAcCH3HOHH862Bufa-20,22-dienolide,6-(acetyloxy)-3-[(6-deoxy-3-O-methyl-α-L-glc)oxy]-8,12,14-trihydroxy-,(3β,5α,6β,12β)-9CI)6-deoxy-3-O-methyl-α-L-glcOAcCH3HOHH863Bufa-20,22-dienolide,6-(acetyloxy)-3-[(6-deoxy-3-O-methyl-α-L-glc)oxy]-8,14,16-trihydroxy-,(3β,5α,6β,16β)-(9CI)6-deoxy-3-O-methyl-α-L-glcOAcCH3HOHOH864Bufa-20,22-dienolide,6-(acetyloxy)-3-[(6-deoxy-3-O-methyl-α-L-glc)oxy]-8,14,16-trihydroxy-,(3β,5α,6β,16β)-(9CI)6-deoxy-4-O-β-D-glc-3-O-methyl-α-L-glcOAcCH3HOHOAc8

图2 红海葱中其他萜类成分结构式Fig.2 Chemical structures of other terpenoids in Urginea maritima
1.2 黄酮类
从海葱中分离出来的黄酮类成分24种,多数为黄酮、黄酮醇以及相应的苷类化合物,少数为花色素和二氢黄酮类。具体化学结构式如图3。
1.3 其他
红海葱中的其他化学成分,如海葱糖[14]、果聚糖[15]、木酚素[5];胆固醇、豆甾醇、菜油甾醇[16]、生物碱[17]、阿魏酸、香草酸、4-羟基丙甲酸、酚醛树脂类、鞣质酸等成分,但这些含量相对较少。Aliaga A从中分离出了谷甾醇、十八烯酸、亚油酸、棕榈酸、亚麻酸[18]。Mohamed GA等[19]分离出一种新的单酰甘油;此外,红海葱中还含有铅、铝、镍、锶、钴、铬、镉、钼[20]等多种微量元素。

图3 红海葱中的黄酮类成分的化学结构Fig.3 Chemical structures of flavones in Urginea maritima
2 海葱的药理作用
2.1 抗肿瘤作用
Bozcuk H等[21]采用V-FITC 法比较红海葱不同药用部位提取液、顺氯氨铂及吉西他滨对A549 非小肺癌细胞毒性试验,结果表明红海葱根茎部乙醇提液抗癌效果最好,其IC50范围为0.02 μg/mL~22 μg/mL。进一步研究其抗癌机制发现,红海葱甲醇提取物对正常纤维原细胞AGO1522无显著性毒性,但能有效抑制MCF-7和MDA-MB-468型乳腺癌细胞,其主要通过调节UPR-CHOP-PERK-EIF2α-ATF-4 信号通路的基因表达,提高细胞内ROS 含量,触发氧化应激反应介导乳腺癌细胞凋亡;同时还能促使线粒体的释放细胞色素C,提高线粒体膜蛋白Bax/Bcl-2的比率,导致线粒体外层膜蛋白的功能紊乱,增加线粒体膜通透性,从而介导乳腺癌细胞凋亡,这表明红海葱提取对乳腺癌细胞具有一定的选择性;另外,细胞色素C还能激活Apaf-1,其能激活caspase-9,进而激活下游caspase-6、caspase-7介导乳腺癌细胞的凋亡,并具有明显的量效关系[22]。El-Seedi等[23]研究表明红海葱中的海葱次苷A(PSN-A)能有效抑制淋巴瘤细胞U-973 GTB的生长,其IC50=4.2±1.2 ng/mL。此外,何洋洋等[24]研究发现海葱次苷A(PSN-A)不仅通过触发氧化应激通路和诱导线粒体膜蛋白功能紊乱通路介导前列腺癌细胞凋亡;还能以抑制信号转换因子JAK 和信号激活因子STAT3磷酸化的方式介导前列腺癌细胞死亡,但目前研究只发现PSN-A是通过调控该通路上游信号因子发挥作用,并不能确定其具体相关因子;PSN-A能明显增加细胞内的Ca2+浓度,并且能拮抗阿霉素的抗癌作用,推测这与其强心作用有关。红海葱糖蛋白29315Da具有强效的抗肿瘤作用,这种糖蛋白既能抑制血管内皮生长因子(VEGF)的合成,使肿瘤细胞无法生成新的血管,抑制肿瘤细胞生长;也可以诱导生成Caspase-3 酶抑制剂(Ac-DEVD-CHO),阻碍肿瘤细胞关键DNA片段转录翻译,介导肿瘤细胞的凋亡;还能诱导DNA染色体分离过程中关键基因成分CAD发生转移,从而介导肿瘤细胞的凋亡[25]。
2.2 抗心衰作用
早在1930年,Stoll等[1]就从红海葱中提取分离出强心苷成分,并鉴定证实此强心苷类成分属蟾蜍二烯酸内酯类化合物,命名为海葱苷。早期药理实验研究发现,海葱苷具有与洋地黄相似的强心效果,风湿性心脏病患者静脉注射海葱苷B后,其血压和心律显著降低;而对伴有心房纤维化导致的心动过缓患者,海葱次苷A能明显升高心收缩压及泵送压,暗示海葱对心脏有双重调节作用[3]。近年来,David K等[26]研究表明海葱苷能抑制细胞膜上的Na+-K+-ATP 泵,阻碍细胞膜上的Na+、K+主动运输通道,升高细胞内的Na+和细胞外的K+浓度,促使细胞内的Ca2+浓度累积升高,进而增强心肌细胞的收缩力,增加心输出量,降低心率,起到治疗慢性充血性心力衰竭、心律失常的作用,并且海葱苷作用迅速,体内残留量少。Dizaye等[27]研究发现红海葱提取物能明显扩张兔子麻醉状态下的外周血管,这可能与其提取物中含阻断α肾上腺素受体成分有关。进一步研究发现,红海葱醇提物能扩张肺主动脉血管,降低血压和心收缩压,并具有拮抗硝酸异山梨醇的作用效果,表明其对肺主动脉血管具有双重调节作用[28]。
2.3 利尿作用
记载于英国药物杂志的制剂配方表明:完全干燥的红海葱加10倍量水煎煮,趁热虑取药液并加入适量的蜜和醋,温服,可缓解水肿症状。Grollman A等[29]以地高辛为阳性对照组进行对比试验,结果表明红海葱苷具有强效的利尿作用,明显增加兔子的尿液排泄量,并且作用效果比地高辛强;进一步研究发现,红海葱并不是通过升高血压或者增加血流量来促进尿液的排泄,而是直接作用于肾脏,促使尿排泄量增加,这可能与海葱影响肾小管重吸收有关。Çelik TA等[30]通过火焰光度法分析尿液成分,发现尿液中Na+含量升高,K+含量降低。这与保钾排钠利尿药效果相似,为避免高血钾症,可以与排钾利尿药联用,能更好发挥其作用优势,这也证实了红海葱影响肾小管重吸收,但具体的药效物质基础及作用机制尚不清楚,有待进一步深入研究。
2.4 止咳平喘作用
在欧洲国家,红海葱醋蜜剂广泛用于治疗哮喘病,并且取得良好的疗效[30]。Nejatbakhsh 等[31]以呼吸量测定法和体积描记法对60位重度哮喘患者进行不同研究试验,结果表明红海葱醋蜜剂能明显改善患者的肺功能,其最大呼气量FEV1 提升20%以上,与对照组相比具有显著性差异(P<0.001)。进一步研究发现,红海葱可以通过抑制副交感神经和阻滞Ca2+通道,从而拮抗氨甲酰胆碱能受体及k+诱导的支气管收缩,其作用效果与双环胺类化药相似[32]。此外,红海葱醋蜜剂能抑制支气管粘液分泌,对支气管炎引起的哮喘有一定的疗效,这与其抑制嗜酸性粒细胞、肥大细胞和淋巴细胞等多种炎症细胞分泌致炎因子有关。Terness P等[33]发现海葱次苷A作为重要的生物免疫调剂剂,其能抑制T细胞前体的活性,甚至阻碍活化T细胞的增殖,导致炎症因子的分泌量减少。
2.5 抗菌作用
现代研究表明多数药用植物制剂都有一定抗菌活性[34],其既能协同传统的抗菌药物如黄连素等共同发挥作用,也可以直接破坏细菌的耐药机制如抑制细菌合成水解酶等[35,36]。红海葱醇提物既能抑制金黄色酿脓葡萄球菌、葡萄球菌、巨大芽孢杆菌、奈瑟氏球菌、枯草芽孢杆菌及藤黄微球菌等革兰氏阳性菌的增殖,也能抑制绿脓杆菌、伤寒杆菌、乙型副伤寒沙门杆菌、肺炎杆菌等革兰氏阴性菌增殖[37],其中对革兰氏阳性菌的金黄色葡萄球菌以及革兰氏阴性菌的大肠杆菌的有效抑菌效果最为明显[38]。相关研究报道表明,红海葱中的低聚糖能抑制真核细胞生物生长,如对真菌类的黄曲霉菌、白色念珠球菌、梨孢菌及海藻类的小球藻等均具有明显抑制效果,其最低的抑菌浓度(MIC)仅为200 μg/mL[39]。
2.6 抗氧化作用
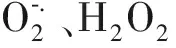
2.7 免疫调节作用
Ulukoy G等[44]通过呼吸爆发试验、血清中总蛋白分析、溶解酵素活性以及血液学分析试验研究发现,红海葱醇提物能增强巨噬细胞吞噬能力、提高溶解酵素的活性,进而增强机体的非特异性免疫调节功能。研究表明,不同蟾蜍二烯羟酸内酯(海葱苷)免疫抑制活性不同,17-β位内酯环缺失以及14位β-OH被环氧基树脂基团取代都降低其生物活性,非特异性免疫调节能力降低;但3-C位有-OH取代较没有-OH取代活性强1 000倍[33]。深入研究发现,红海葱中海葱次苷A 可以通过抑制淋巴细胞上的 Na+/K+-ATP泵,使T细胞因无法得到足够的能量而降低其细胞活性,直接抑制T细胞的增殖,实现免疫调节作用[33]。
2.8 抗病毒作用
Sato N等[45]进行海葱苷抗病毒种类筛选实验,结果表明海葱苷能有效地抑制小核糖体核酸病毒,其中对鼻病毒和小儿麻痹病毒的抑制效果最明显,最低有效浓度分别为0.004、0.016 μg/mL。进一步研究发现海葱苷能抑制小分子RNA复制,有效的抑制感染初期的病毒增殖,但并不能直接是病毒失活,在病毒感染3小时后,这种抑制效果会逐渐消退。因此,考虑此为非特异性的免疫抑制,对特异性病毒的无显著性抑制效果。另外,海葱苷对大分子的DNA和RNA病毒无效,可能因为海葱苷不能抑制细胞生物大分子如DNA、RNA和蛋白的合成[46]。
2.9 杀虫作用
Pascualvillalobos[47]研究5种从海葱中提取分离的蟾蜍二烯羟酸内酯(包括海葱次苷A、海葱苷A、蟾蜍毒苷元、红海葱苷以及红海葱苷元)对甲虫的急性毒性试验和生长发育抑制性试验,结果表明这5种物质都有杀虫作用,其中毒性最强的是红海葱苷元,LD50为25.5 μg;Pascual MJ研究发现当甲虫幼虫摄入其食物量10%的海葱提取物时,甲虫会延迟发育21到29天,同时雌性甲虫的产卵数会大大的减少[47]。红海葱提取物还可杀死稻旁叶螨,其LD50、LC50及RC50分布为19.03 μg、2.35 μg/cm2、0.009 μg/cm2;当浓度达到1000 μg/mL时,对叶螨中的乙酰胆碱酶活性抑制率达到73.7%[48,49]。因此可以考虑将红海葱开发为杀虫剂。
2.10 镇痛作用
Bayazit V等[50]通过临床试验用药研究海葱次苷A、海葱苷及花旗松素在人体不同病痛部位(包括膝关节、肩部、小腿、后背、尾椎骨和纤维肌等)中的镇痛效果,并同时检测了病人在用药前后的ASO、CRP及RF值,结果表明病人在用药前后的痛疼感存在显著性差异(P<0.01),ASO、CRP及RF值也明显降低了(P<0.01),但目前对其具体的镇痛机制尚不是十分清楚。
3 总结与展望
红海葱作为国外常用的药用植物,药用历史悠久,其分布极为广泛、资源丰富,具有多种药理活性,尤其近年红海葱在抗肿瘤、强心等方面的药理活性引起研究者的关注。目前,外国研究者对红海葱研究的比较多,已从中分离出得到三萜类和黄酮类等多种化学成分,对其主要的有效成分海葱苷类成分的抗肿瘤、强心等药理活性也做了初步的阐明;但其利尿、平喘止咳及免疫调节等药理活性的作用机制尚不明确,其具体的母核结构、糖链数目顺序及其药理活性的构效关系有待进一步的探索研究;另外,因为红海葱极高的药用价值,国内慢慢引种红海葱(欧洲海葱),因此,有必要深入对该植物的化学成分药理毒理作用进行系统研究。本文通过对红海葱的主要化学成分及药理活性进行综述,为后续国内结合中药多成分、多靶点、多疗效的特点对其进行全面深入的化学成分、药理药效研究提供一定的参考依据。

