靶向5-LOX中药黄酮类化合物的活性筛选及其作用方式和共性规律研究
邵欣欣,陈 聪,王振国,付先军*
1山东中医药大学中医文献与文化研究院;2山东中医药大学 中医经典理论教育部重点实验室;3山东中医药大学中药网络药理学实验室,济南 250355
目前,恶性肿瘤(癌症)已经成为威胁人类健康和导致人类死亡的重要原因之一,如何有效治疗肿瘤己成为生命科学研究的热点[1]。从20世纪下半叶开始,随着恶性肿瘤内的细胞凋亡、血管生成以及炎症等机制的阐明,以癌症相关蛋白为靶点的分子靶向性治疗已成为当今肿瘤治疗的重要方向。相比传统抗肿瘤药物,分子靶向药物具有高效、低毒、选择性高等优点,已经取得了显著的临床疗效[2]。动物实验及人类癌症研究表明,炎症是癌症发生和发展的重要机制之一,人类的多种癌症都是由炎症直接或间接驱动的,使用抗炎药物可以通过抑制炎症和阻止血管生成等来阻断肿瘤生长[3]。
5-脂氧合酶(5-lpoxygenase,5-LOX)是炎症机制中的重要蛋白靶点,是花生四烯酸(arachidonic acid,AA)代谢到白三烯A4(leukotriene A4,LTA4)的关键酶。已有研究报道,5-LOX、5-LOX活化蛋白(FLAP)以及其他白三烯(LT)生物合成酶在多种恶性细胞中过表达[4]。5-LOX抑制剂可以通过抑制酶反应过程中产生的炎症因子,直接参与多种类型癌症的进展,最终发挥抑制癌症的效果。
黄酮类化合物是一类重要的植物类中药次生代谢产物,该类化合物具有共同的结构特点,即2-苯基色原酮,2个具有酚羟基的苯环(A、B环)通过中央3碳原子相互连结而成的一类化合物(见图1)。
5-LOX的活性位点在其金属离子Fe3+周围,而黄酮类化合物与Fe3+周围氨基酸结合,以阻断5-LOX与底物结合,发挥催化作用,从而发挥抑制作用[5]。因此,本研究拟以5-LOX、天然黄酮类化合物为研究对象,借助计算机模拟和实验方法进行构效关系的研究,以期发现靶向5-LOX的中药黄酮类成分及其来源中药的共性特征,为开发靶向5-LOX抗肿瘤新药提供思路和先导化合物。

图1 2-苯基色原酮结构图Fig.1 Structure of 2-phenyl chromogen
1 中药黄酮类成分的筛选及信息来源
筛选标准[6]:① 2015版《中华人民共和国药典》一部收载中药的主要功效成分,即含量测定中标注的黄酮类化合物(不包括黄酮苷类化合物)[7];②来源于植物中药。
依据筛选标准,本研究选择18味植物类中药的17种黄酮类化合物,其成分信息、中药性味归经及功效等信息均来源于2015版《中华人民共和国药典》一部[7]。成分结构信息来源于Pubchem[8],具体见表1、图2。
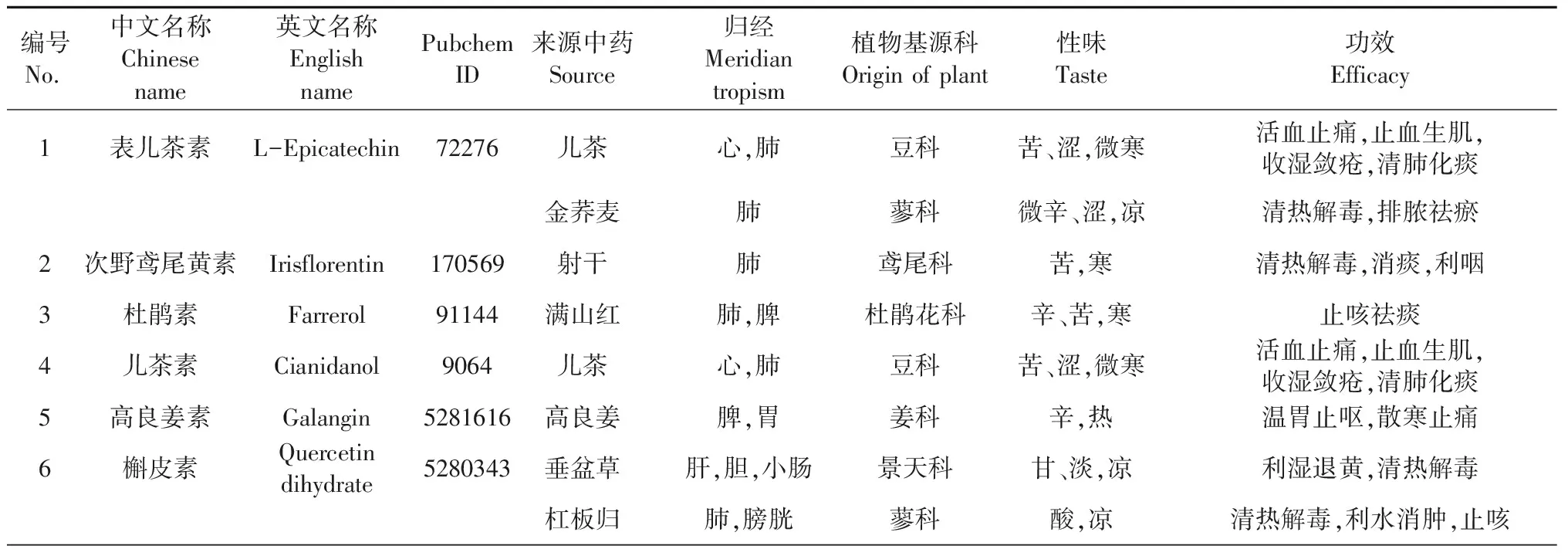
表1 黄酮类化合物及其来源中药信息表
续表1(Continued Tab.1)
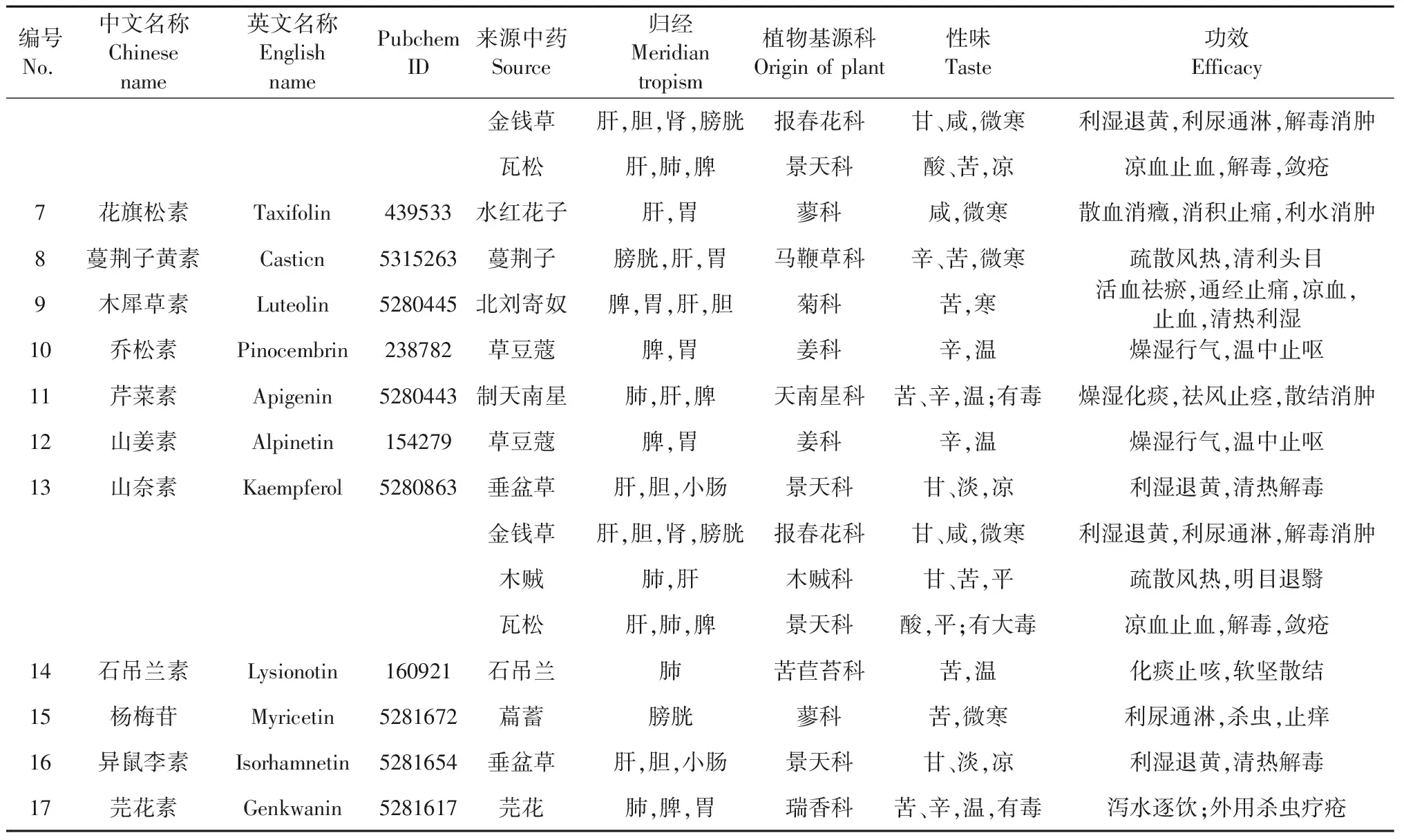
编号No.中文名称Chinese name英文名称English namePubchem ID来源中药Source归经Meridian tropism植物基源科Origin of plant性味Taste功效Efficacy金钱草肝,胆,肾,膀胱报春花科甘、咸,微寒利湿退黄,利尿通淋,解毒消肿 瓦松肝,肺,脾景天科酸、苦,凉凉血止血,解毒,敛疮7花旗松素Taxifolin439533水红花子肝,胃蓼科咸,微寒散血消癥,消积止痛,利水消肿 8蔓荆子黄素Casticn5315263蔓荆子膀胱,肝,胃马鞭草科辛、苦,微寒疏散风热,清利头目9木犀草素Luteolin5280445北刘寄奴脾,胃,肝,胆菊科苦,寒活血祛瘀,通经止痛,凉血,止血,清热利湿 10乔松素Pinocembrin238782草豆蔻脾,胃姜科辛,温燥湿行气,温中止呕11芹菜素Apigenin5280443制天南星肺,肝,脾天南星科苦、辛,温;有毒燥湿化痰,祛风止痉,散结消肿 12山姜素Alpinetin154279草豆蔻脾,胃姜科辛,温燥湿行气,温中止呕 13山奈素Kaempferol5280863垂盆草肝,胆,小肠景天科甘、淡,凉利湿退黄,清热解毒金钱草肝,胆,肾,膀胱报春花科甘、咸,微寒利湿退黄,利尿通淋,解毒消肿 木贼肺,肝木贼科甘、苦,平疏散风热,明目退翳瓦松肝,肺,脾景天科酸,平;有大毒凉血止血,解毒,敛疮14石吊兰素Lysionotin160921石吊兰肺苦苣苔科苦,温化痰止咳,软坚散结15杨梅苷Myricetin5281672萹蓄膀胱蓼科苦,微寒利尿通淋,杀虫,止痒 16异鼠李素Isorhamnetin5281654垂盆草肝,胆,小肠景天科甘、淡,凉利湿退黄,清热解毒17芫花素Genkwanin5281617芫花肺,脾,胃瑞香科苦、辛,温,有毒泻水逐饮;外用杀虫疗疮

图2 黄酮类化合物结构图Fig.2 Structures of flavonoids
2 研究方法
2.1 分子间相互作用实验
2.1.1 实验仪器及耗材
实验仪器:Biacore T200生物分子相互作用分析系统。
实验耗材:靶点蛋白5-LOX(货号:L6632,购自sigma);DMSO(ACS,货号:0457C072,购自VWR);吐温20(货号:0777-1L,购自 VWR);CM5芯片(货号:BR-1005-30,购自GE);标准品单体均购于上海源叶生物科技有限公司。
2.1.2 实验步骤
将5-LOX用醋酸盐缓冲溶液(PH=4.5)稀释为20 μg/mL采用氨基偶联的方式偶联至CM5芯片上(偶联量为6 452 RU),将17种单体成分以及阳性对照药物棉酚分别溶于DMSO中至10 mmol/L,用PBS-P稀释至500 μmol/L再用缓冲溶液PBS-P+(含5% DMSO)稀释为250 μM作为最高进样浓度,设置浓度梯度为250、125、62.5、31.25、15.6 μmol/L依次进样,若出现亲和力或者动力学信号,进一步减小浓度梯度进样。
2.2 5-LOX抑制剂药效团模型的构建
由Drug Bank[9](https://www.drugbank.ca/drugs/DB00711)中选取已经实验验证的作用于5-LOX的有效抑制剂,构建药效团模型,运用Discovery Studio 2017 R2(DS 2017 R2)中的Pharmacophores模块进行药效团分析。药效团建立分为两个阶段:(1)Common Feature Pharmacophores阶段,参数设置为:Conformation Generation为BEST,构象上数设置为200,Energy Threshold 参数为10;(2)与测试训练集匹配阶段:参数设置为Conformation Generation为None,Maximum Omitted Features为-1。
2.3 分子对接
将与5-LOX具有亲和力的小分子化合物根据其PubChem_ID号于PubChem(https://pubchem.ncbi.nlm.nih.gov/)中下载3D结构,在PDB[10](http://www.rcsb.org/pdb/home/home.do)蛋白质数据库下载5-LOX(PDB_ID:1F8N)的晶体结构。借助软件Discovery Studio 2017 R2中的Receptor-Ligand International模块将此类小分子化合物分别与5-LOX进行CDOCKER分子对接。蛋白的的活性位点以晶体结构中自身标注的原配体作用的活性氨基酸位点为中心,构建相应“活性口袋”,使得系统搜寻在活性位点附近的“活性口袋”,最后将“活性口袋”信息为45.757 9、40.541 8、11.638 9,半径为20.4定位目标“活性口袋”,使小分子通过CDOCKER算法模块与“活性口袋”中的氨基酸进行对接,参数设置:Pose Cluster Radius设置为0.5,Random Conformations 设置为10,Orientations to Refine设置为10,其余维持默认参数不变。
2.4 关联网络构建
黄酮类成分来源中药的药性等信息按照2015年版《中华人民共和国药典》一部进行规范,将“大寒”“寒”“微寒”等规范为“寒”,“大热”“热”等规范为“热”,“温”“微温”等规范为“温”,分为寒、热、温、凉、平。按照《中华人民共和国药典》记载,药味按记载分为苦、辛、甘、咸、涩、酸、淡,归经按记载分为肝、肺、肾、心、脾、胃、大肠、膀胱、胆、小肠、心包、三焦。将数据导入R软件平台3.3.1[11],在R语言软件平台调用arules程序包进行关联规则的挖掘[12],并采用arulesViz将结果构建靶向肿瘤相关炎症蛋白5-LOX中药黄酮类化合物活性与中药性味等信息关联网络并进行可视化处理[13]。
3 研究结果
3.1 分子相互作用的实验结果
本研究共纳入表1中列出的黄酮类化合物17种,以棉酚作为阳性对照,其中与5-LOX具有亲和力的有11种,与5-LOX具有亲和力的黄酮类成分中,其中儿茶素、乔松素、表儿茶素为二氢黄酮,高良姜素、芹菜素、山奈酚、异鼠李素、石吊兰素、杨梅苷、木犀草素为黄酮。成分与蛋白出现结合显示出一定的响应值(单位:RU),运用Biacore T200 Evaluation Software进行分析,拟合出动力学常数KD值(具体见表2、图3),根据KD=[A][B]/[AB]公式,KD表示出处于平衡状态时AB的解离程度,KD越大说明解离越多,代表AB之间亲和力越弱,KD越小说明解离越少,代表AB间亲和力越强。分析亲和力图(图3)的结合解离曲线,中药黄酮类成分与5-LOX的结合呈现出3种模式,分别为“快结合快解离”“慢结合慢解离”和“快结合慢解离”,其中杨梅苷、石吊兰素结合动力学常数较低,解离较弱,高良姜素、对照品棉酚是典型的“快结合慢解离”;乔松素是典型的“快结合快解离”。

表2 黄酮类化合物与5-LOX的亲和力
续表2(Continued Tab.2)
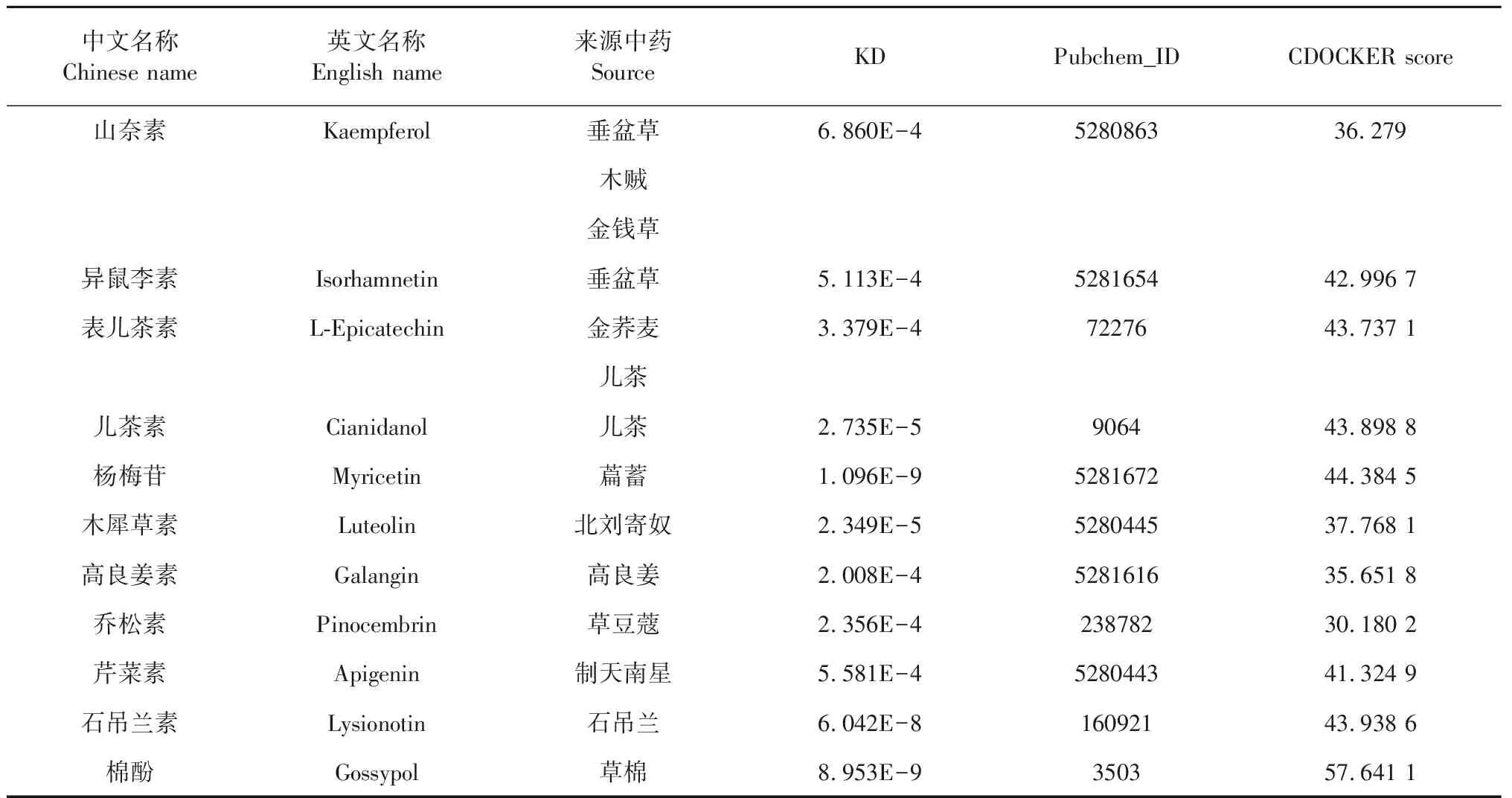
中文名称Chinese name英文名称English name来源中药SourceKDPubchem_IDCDOCKER score山奈素Kaempferol垂盆草6.860E-4528086336.279木贼金钱草异鼠李素Isorhamnetin垂盆草5.113E-4528165442.996 7表儿茶素L-Epicatechin金荞麦3.379E-47227643.737 1儿茶儿茶素Cianidanol儿茶2.735E-5906443.898 8杨梅苷Myricetin萹蓄1.096E-9528167244.384 5木犀草素Luteolin北刘寄奴2.349E-5528044537.768 1高良姜素Galangin高良姜2.008E-4528161635.651 8乔松素Pinocembrin草豆蔻2.356E-423878230.180 2芹菜素Apigenin制天南星5.581E-4528044341.324 9石吊兰素Lysionotin石吊兰6.042E-816092143.938 6棉酚Gossypol草棉8.953E-9350357.641 1
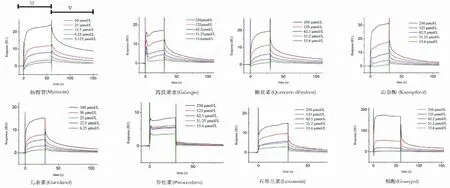
图3 黄酮类化合物与5-LOX的亲和力图Fig.3 Affinity diagram of flavonoids and 5-LOX注:上图中U代表结合阶段,V代表解离阶段。Note:As shown in the diagram,U stands for the stage of combination,V stands for the stage of dissociation.
3.2 药效团及分子对接结果
3.2.1 药效团建立模型与评价
由Drug Bank中选取已经实验验证的作用于5-LOX的6个有效抑制剂为分子训练集1(表3),构建药效团模型,以上述11个来源于中药的黄酮类成分建立分子训练集2,查看药效团与分子训练集2的匹配情况,得到药效团评价结果如图4所示,由图4中的Fit value作为评价指标筛选最优药性团模型,结果显示药效团8的得分20.606 08为最高,提示受试活性分子与药效团8更为匹配,因此将药效团8作为研究黄酮小分子药效团最优模型,然后将11个与5-LOX具有亲和力的小分子黄酮类化合物分别与5-LOX经行分子对接,根据对接结果分析此11个小分子与5-LOX的相互作用模式以及可能的作用活性位点。
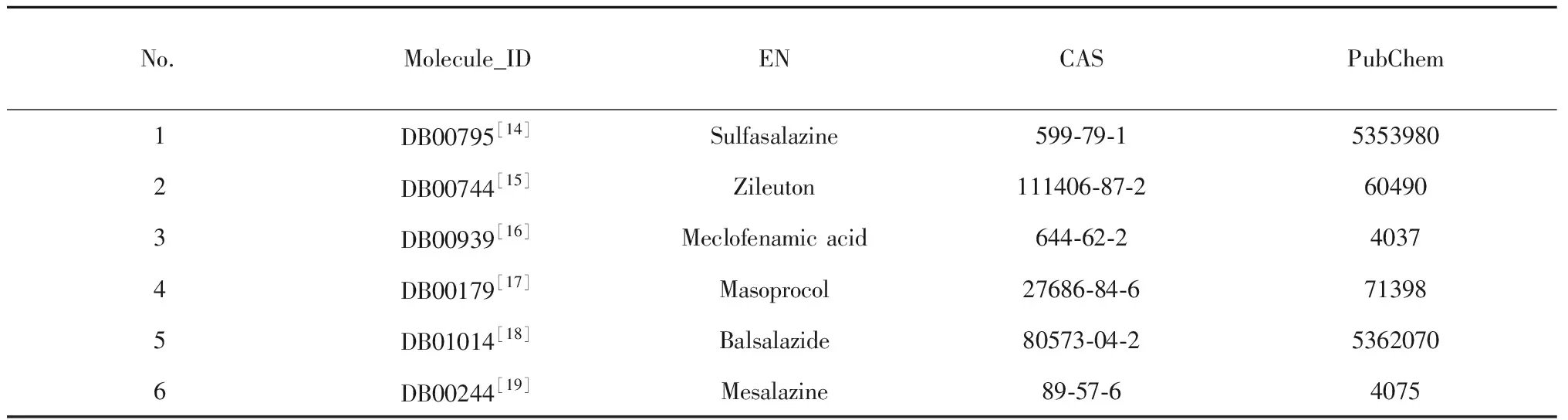
表3 5-LOX抑制剂分子集

图4 药效团评价热图Fig.4 Heat map of pharmacophore evaluation

图5 5-LOX抑制剂药效团模型(A)与训练集2药效团匹配结果(B)Fig.5 Pharmacophore model of 5-LOX inhibitor注:图中HB蓝色圆形球体表示疏水基团;HA绿色圆形球体表示氢键受体;HD紫红色圆形球体表示氢键供体。Note:As shown in the diagram, HB stands for the feature of hydrophobic,HA stands for the feature of hydrogen bonding acceptor,HD stands for the feature of hydrogen bonding donor
3.2.2 分子对接结果分析
分子对接打分结果见表2,如表所示,CDOCKER Score的分数多在30以上,通过分析小分子与关键氨基酸的成键及其与药效团模型匹配结构图(图6-8),可以发现其成键作用有如下3种方式。
3.2.2.1 木犀草素、槲皮素、表儿茶素、高良姜素、石吊兰素5个黄酮小分子均是由B环与5-LOX在活性位点ASP243形成静电中心,以便与5-LOX相互作用(以木犀草素为例,详见图6)。
3.2.2.2 芹菜素、山奈素、乔松素、异鼠李素此4种黄酮小分子均含有不同的类型的-OH,从而由数量或者位置上给黄酮赋予了不同的极性与结构,导致黄酮的苯环呈现出电子偏移的现象,与5-LOX结合方式也发生了改变,由原来的B环与ASP243以静电中心相连,转变为A环与活性位点VAL520以疏水键相连,与ASP243形成氢键。儿茶素是右旋结构的二氢黄酮,具有特殊的空间结构,使得它呈现出一个特殊的药效团特征,虽然儿茶素的药效团特征与其它10个小分子不同,但是其通过构型变换使得与5-LOX的结合位点同乔松素、山奈素、芹菜素、异鼠李素相似,即A环活性位点VAL520以疏水键相连,而ASP243氨基酸则形成氢键(以芹菜素、儿茶素为例,详见图7)。
3.2.2.3 杨梅苷是一个具有较强极性的黄酮单体,其B环上的3个-OH以及3号位的-OH使得杨梅苷B环上的电子排布发生变化,出现电子偏移,从而展现出较强的极性,由图8药效团模型可以看出,杨梅苷在没有形成疏水键的情况下形成静电中心,与5-LOX在活性位点ASP243产生相互作用(详见图8)。
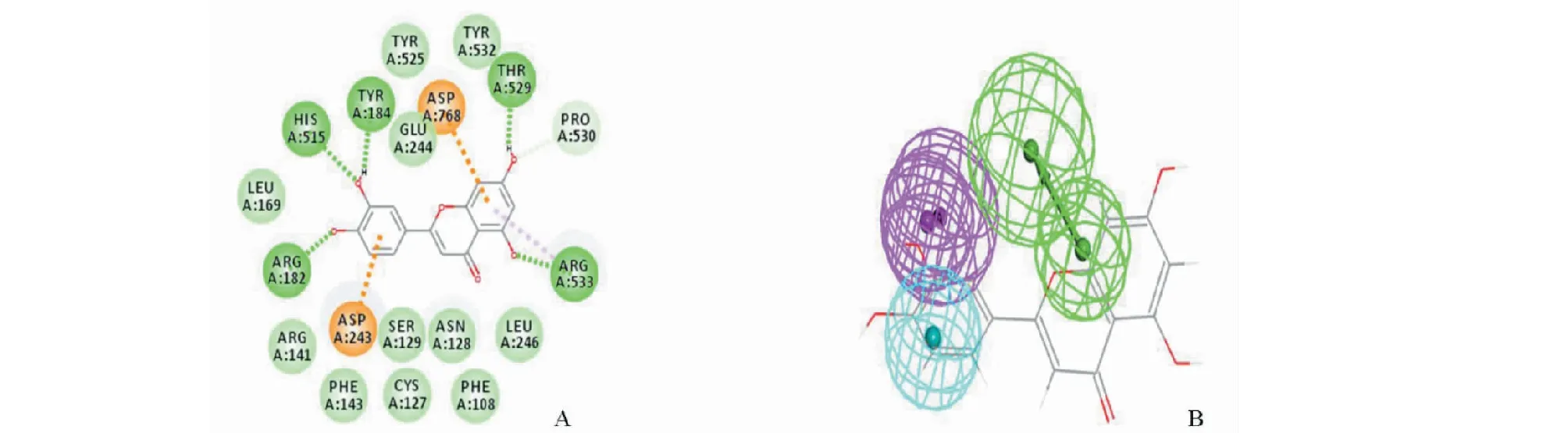
图6 木犀草素与5-LOX的分子对接(A)及药效团模型图(B)Fig.6 Molecular docking (A) and pharmacophore (B) model of luteolin with 5-LOX

图7 芹菜素(A-B)、儿茶素(C-D)与5-LOX的分子对接及药效团模型图Fig.7 Molecular docking and pharmacophore model of 5-LOX with apigenin(A-B) and catechin(C-D)
3.3 关联网络研究结果
以5-LOX活性为中心节点(Center Node),以靶向5-LOX黄酮类成分来源中药的药性、功效等信息作为关联节点(Related nodes),以各信息节点之间的关联关系作为网络的边(Edge),通过R语言软件平台arules和arulesViz程序包,构建了靶向肿瘤相关炎症蛋白5-LOX中药黄酮类化合物活性与中药性味等信息关联网络图(见图9)。从图中可以发现,靶向肿瘤相关炎症蛋白5-LOX中药黄酮类化合物活性与其来源中药的利湿、退黄、解毒、止血以及清热等功效,甘苦寒性味,以及景天科具有一定的关联关系,结果提示具有甘苦寒药性,利湿、退黄、解毒等功效,归肝胆经,且来源于景天科植物的黄酮类天然产物更有可能对5-LOX具有活性作用,可以为从中药中筛选靶向5-LOX的活性化合物提供线索和参考。
图8 杨梅苷与5-LOX分子对接图(A)及药效团模型图(B)Fig.8 Molecular docking (A) and pharmacophore model (B) of 5-LOX with myricetin
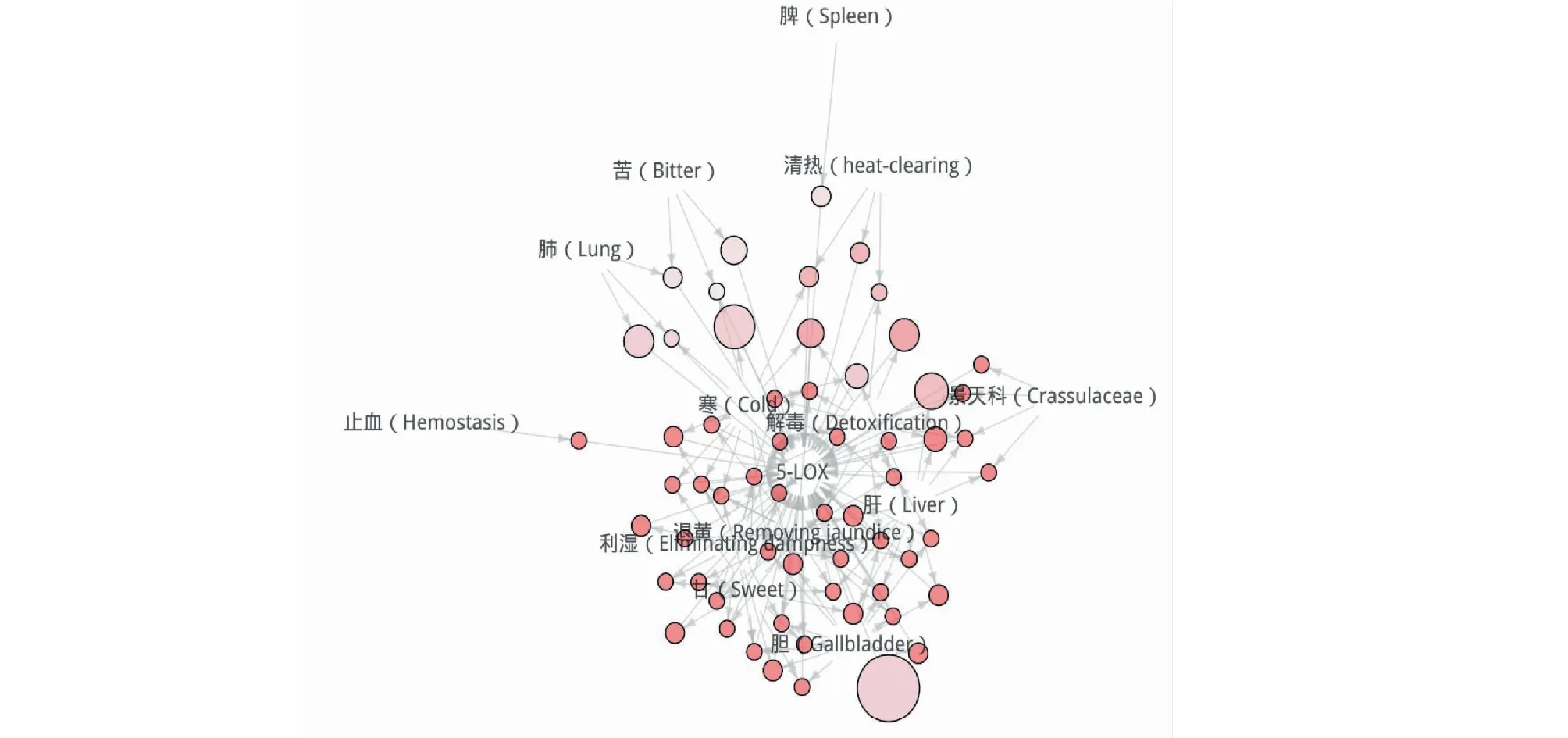
图9 关联网络图Fig.9 Association network diagram
4 结论
研究中药来源的天然产物及其衍生物作为治疗药物的先导化合物,对于我国创新药物的开发具有重要价值。目前,大量天然产物来源的化合物已被批准进入临床试验和新药市场[20]。天然产物结构具有高化学多样性、生物化学特异性等特点,这使它们成为药物发现的先导结构,同时也使其不同于合成化合物和组合化合物。5-LOX作为炎症级联反应重要的参与者,在多种癌症中均有异常表达。
本研究共发现11种黄酮小分子与5-LOX具有相互作用,其中异鼠李素、乔松素、石吊兰素为首次发现。借助分子对接技术分析这11种小分子与5-LOX的作用活性位点,发现了11种小分子的药效团模型以及其与5-LOX相互作用的方式。其中,槲皮素、木犀草素、表儿茶素、高良姜素、石吊兰素是由B环与5-LOX在活性位点ASP243形成静电中心,以便与5-LOX相互作用;乔松素、芹菜素、异鼠李素、山奈素、儿茶素是由A环与活性位点VAL520以疏水键相连,与ASP243形成氢键;杨梅苷在未体现疏水特征的情况下形成静电中心,与5-LOX在活性位点ASP243产生相互作用。
结果还发现,靶向肿瘤相关炎症蛋白5-LOX中药黄酮类化合物活性与其来源中药的利湿、退黄、解毒、止血以及清热等功效,甘苦寒性味,以及景天科具有一定的关联关系。有研究发现清热、解毒、利湿、退黄中药在慢性乙型肝炎的治疗中有干预和抑制肝炎炎症活动的作用,具有显著抗炎和抗肿瘤活性[21,22]。而且有文献报道抗肿瘤中药以寒性和苦味药最多,分别占32%和35%,归肝经的中药占24%,抗肿瘤中药功效频次较高的为解毒、止痛、消肿、清热[23];也有研究证实景天科景天属植物药中的黄酮类成分确实具有抗肿瘤效果[24],与我们的研究结果基本一致,这也为从中药中筛选抗肿瘤活性成分提供思路。
5-LOX是肿瘤相关炎症通路的重要靶点,然而这11种化合物抗肿瘤活性及其作用机制有待进一步深入研究。另外由于本研究纳入的中药及其黄酮类化合物样本量较少,靶向肿瘤相关炎症蛋白5-LOX中药黄酮类化合物活性与中药性味等信息的关联关系还有待进一步证实。

