桉树枝瘿姬小蜂虫瘿对桉树光合生理的影响
高旭,郭文锋,项瑶,申思,李晓琼,
(1.广西森林生态与保育重点实验室,广西大学林学院,广西南宁 530004;2.广西作物遗传改良生物技术重点实验室,广西南宁 530007;3.广西友谊关森林生态系统定位观测研究站,广西凭祥 532600)
虫瘿是致瘿生物诱导植物组织加速分裂产生的异常组织[1],其中最主要的致瘿生物为昆虫。在虫瘿形成过程中,会导致一系列生理生化反应,影响植物的正常生长与发育[2-4]。光合作用是植物物质生产的基础。虫瘿形成对植物光合有很大影响,但其趋势及机制尚未定论。Florentine 等[5]认为,虫瘿阻碍水分运输导致植物光合作用降低。Prade 等[6]也报道巴西胡椒木Schinus terebinthifolia被虫瘿侵染后,光合速率明显降低。Jiang 等[7]发现虫瘿叶片光合速率的降低与气孔导度有关。另有研究表明,虫瘿形成导致寄主植物的光合作用升高[4,8-10]或没有显著影响[11-12],其原因是植物库源关系改变、补偿性光合作用及昆虫食性差异。植物抗性强弱影响植物对虫害的光合响应[10,13-14],不同虫瘿形成,生长阶段对植物光合的影响也不同[4,15]。但已有研究鲜少比较植物抗性及虫瘿生长过程对植物光合生理的影响。
桉树枝瘿姬小蜂Leptocybe invasaFisher & La-Salle 起源于澳大利亚,是一种严重影响全球桉树种植的害虫。该虫能危害多种桉树品系,在植物各部分形成虫瘿,严重时可导致苗木倒伏、停止生长,给桉树产业造成巨大经济损失[16-17]。窿缘桉Eucalyptus exserta(EA)和巨圆桉Eucalyptus grandis×Eucalyptus tereticornis(DH201-2)是曾大面积推广造林的2个桉树品系,其中,EA 对桉树枝瘿姬小蜂的抗性较高,为低感品系,而DH201-2 易感染桉树枝瘿姬小蜂,为高感品系[18-19]。桉树品系间对姬小蜂虫瘿胁迫的生理响应不同[20-21]。但目前桉树与姬小蜂关系的研究多集中于化学物质、营养、植物激素及水力结构等[19,21-23],桉树枝瘿姬小蜂不同发育阶段的虫瘿对桉树光合生理的影响尚不清楚。因此,笔者以桉树枝瘿姬小蜂卵期(S1)、幼虫期(S2)、蛹期(S3)3 个发育阶段2 个桉树品系(EA、DH201-2)的虫瘿叶片及对照(S0)叶片为研究对象,比较虫瘿形成前后及虫瘿发育过程中桉树的光合生理变化,探讨不同抗性寄主植物对虫瘿形成的生理响应机制。
1 材料与方法
1.1 供试苗木 EA、DH201-2 幼苗由广西林科院提供,于广西大学林学院苗圃进行试验。将供试苗木移入20 cm×15 cm 塑料盆中,基质为壤土与草炭土以1∶1 混合。苗木置于100 目尼龙罩内以隔绝其他昆虫,2 个月后,选取生长良好且长势一致的桉树幼苗供试。
1.2 桉树枝瘿姬小蜂虫瘿侵染处理 向虫瘿处理组尼龙罩内放置4 根长1 m 被感染枝条,感染桉树幼苗。其他未感染幼苗为对照组。3 个月后,筛选形成明显虫瘿并包含虫瘿全部发育时期的桉树幼苗进行试验。
根据虫瘿外部形态特征,判断其中姬小蜂的发育阶段[卵期(S1)、幼虫期(S2)、蛹期(S3)],以划分虫瘿发育时期[21]。同批未感染的桉树叶片为对照(S0)。品系 EA 和 DH201-2 各 4 个处理。
1.3 数据测定及方法 每个品系桉树选择3 株,取植株顶端正常生长的第3~5 片叶,使用Li-6400 便携式光合仪测定光合参数和光响应指标。每株桉树选取20 枚叶片测定,取平均值。
光合指标测定:设定叶面温度为(26±3)℃,光强为1 500 μmol·m-2·s-1,测定时间为08:30—11:30,测定指标包括叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)。并计算水分利用效率(WUE=Pn/Tr)。
光响应指标测定:光强梯度为 0,50,100,200,400,600,800,1 000,1 200,1 500 μmol·m-2·s-1。采用非直角双曲线模型[24],对光响应曲线进行拟合,得到最大净光合速率(Amax)、表观量子效率(AQY)、暗呼吸速率(Rd)、光补偿点(LCP)、光饱和点(LSP)。
叶绿素含量测定:每个品系桉树选择4 株,使用SPAD-502plus 测定叶片叶绿素含量(SPAD 值),每株选取20 枚叶片测定,取平均值。
1.4 数据统计及分析 采用双因素方差分析比较桉树品系及姬小蜂不同发育阶段对桉树叶片光合指标、光响应指标、叶绿素含量的影响。将桉树品系和姬小蜂发育阶段作为固定因素,并考虑二者交互效应。差异显著水平设定为P<0.05。数据采用SPSS 20.0 进行统计,用Sigmaplot 12.5 绘图。
2 结果与分析
2.1 姬小蜂发育过程中桉树光合参数差异 桉树品系与姬小蜂发育阶段对Pn产生显著的交互影响(F3,15=3.558,P=0.040)。两品系的 Pn在 S0及虫瘿发育3 个阶段均无显著差异。EA 的Pn随虫瘿中姬小蜂发育略有下降,而DH201-2 的Pn则呈现出先上升后下降的趋势,但差异不显著(图1A)。
Tr受桉树品系(F1,15=16.004,P=0.001)及桉树品系与姬小蜂发育阶段互作(F3,15=4.690,P=0.017)的显著影响。EA 的Tr在不同发育阶段间均无显著差异,而DH201-2 的Tr随虫瘿中姬小蜂发育呈现出先上升后略微下降的趋势,在S2阶段达到最大值,显著高于S0、S1阶段及同一阶段下EA 的Tr(图1B)。
桉树品系(F1,15=25.725,P< 0.001)、发育阶段(F3,15=4.255,P=0.023)及桉树品系与发育阶段互作(F3,15=5.134,P=0.012)显著影响 WUE。EA的WUE 在姬小蜂3 个发育阶段均显著高于DH201-2。EA 各发育阶段 WUE 均高于 S0,在 S1阶段达到最大值,而DH201-2 各发育阶段WUE 均低于 S0,且 S2、S3阶段 WUE 显著低于 S0(图1C)。
Amax受桉树品系与发育阶段互作的显著影响(F3,15=3.556,P=0.042)。EA 各阶段 Amax无显著差异,而 DH201-2 的 Amax在 S1、S2阶段显著高于S0(图1D)。
桉树品系(F1,15=6.228,P=0.026)、姬小蜂发育阶段(F3,15=9.164,P=0.001)及桉树品系与发育阶段互作(F3,15=5.527,P=0.010)均显著影响AQY。DH201-2 各阶段 AQY 无显著差异,而 EA在S1阶段的 AQY 显著高于 S0,且高于同阶段下DH201-2 的 AQY(图1E)。
Rd也受桉树品系(F1,15=76.541,P< 0.001)、姬小蜂发育阶段(F3,15=9.908,P=0.001)及桉树品系与姬小蜂发育阶段互作(F3,15=14.636,P<0.001)的显著影响。EA 的Rd随姬小蜂发育呈现出先下降后上升的趋势,S1、S3阶段Rd显著高于S2阶段。DH201-2 各发育阶段 Rd无显著差异,而EA 各姬小蜂发育阶段Rd均显著高于S0及同一发育阶段下DH201-2 的Rd(图1F)。
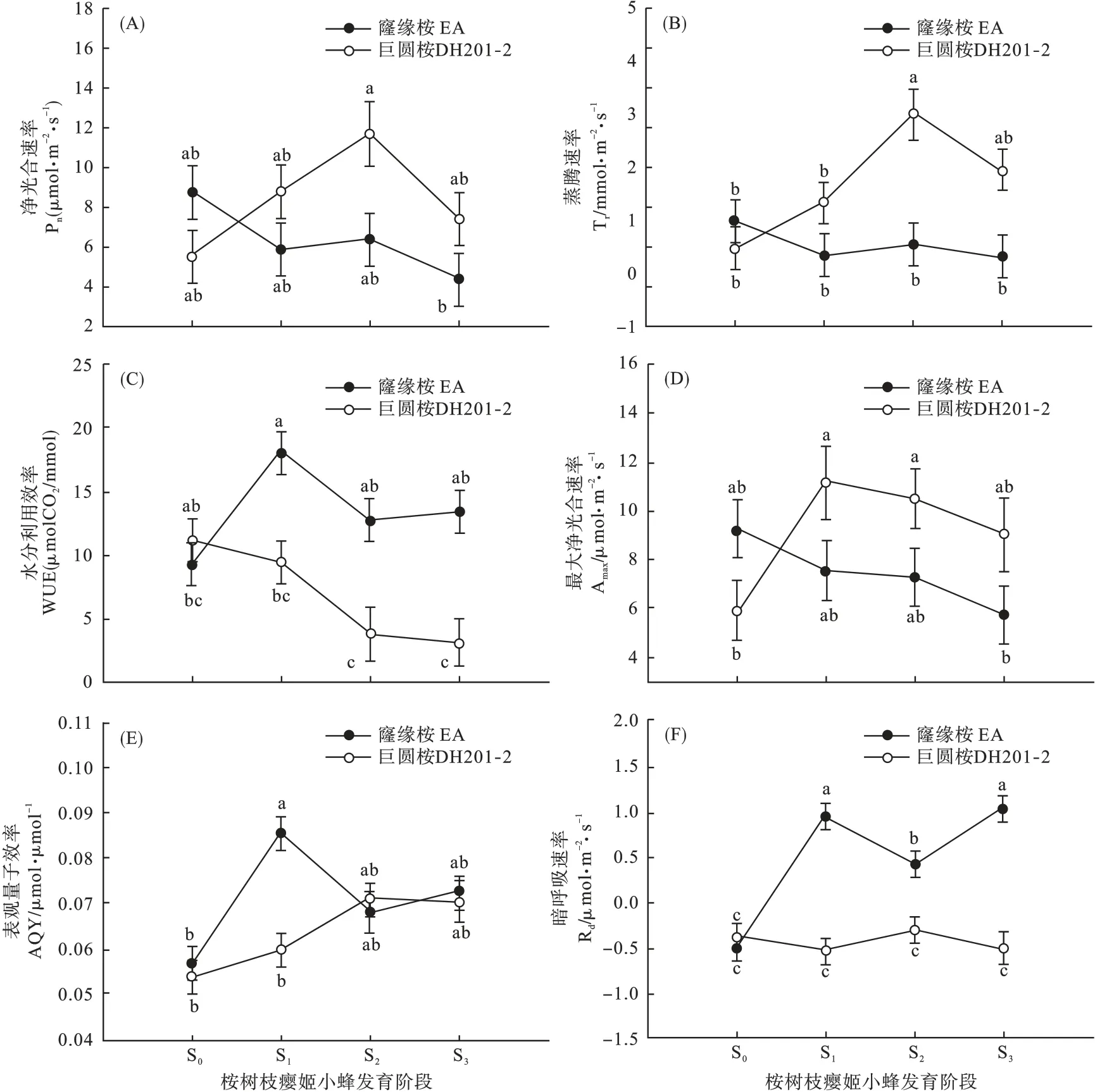
图1 不同发育阶段桉树光合参数的差异Fig.1 Differences of photosynthetic parameters of eucalypts at different developmental stages
桉树品系间 Gs显著不同(F1,15=7.140,P=0.017)。DH201-2 的Gs(0.061 ±0.009)mol·m-2·s-1显著高于EA(0.029 ±0.008)mol·m-2·s-1。不同发育阶段 Gs也显著不同(F3,15=4.147,P=0.025)。S2阶段的 Gs显著高于 S0、S1和 S3阶段(图2A)。而桉树品系与姬小蜂发育阶段互作未对Gs形成显著影响(F3,15=2.425,P=0.106)。
桉树品系间的 LCP 显著不同(F1,15= 5.953,P=0.028),EA(9.757±0.861)μmol·m-2·s-1显著高于DH201-2(6.695 ±0.913)μmol·m-2·s-1。不同姬小蜂发育阶段的LCP 也显著不同(F3,15=5.127,P=0.012),S2阶段的 LCP 显著低于 S1、S3阶段,但姬小蜂各发育阶段虫瘿叶片的LCP 与S0相比,无显著差异(图2B)。
Ci在桉树品系间显著不同(F1,15=5.311,P=0.036)。DH201-2 的 Ci(5.720 ±50.563)μmol/mol显著高于 EA(-154.421 ±47.671)μmol/mol。姬小蜂发育阶段(F3,15=1.308,P=0.309)及桉树品系与姬小蜂发育阶段互作(F3,15=2.880,P=0.071)未对Ci形成显著影响。

图2 不同发育阶段桉树气孔导度及光补偿点差异Fig.2 Differences of stomatal conductance and light compensation points of eucalypts among developmental stages
2.2 姬小蜂发育对桉树叶绿素含量的影响 桉树品系(F1,24=30.222,P< 0.001)、姬小蜂发育阶段(F3,24=282.143,P< 0.001)及桉树品系与发育阶段互作(F3,24=57.345,P< 0.001)均对 SPAD 值形成极显著影响(图3)。两品系各发育阶段SPAD 值均显著低于S0,随姬小蜂发育呈现出先上升后略微下降的趋势,在S1阶段达到最小值。EA 在S0阶段的SPAD 值显著高于DH201-2,但在同一发育阶段下,EA 和 DH201- 2 间 SPAD 值无显著差异(图3)。

图3 姬小蜂不同发育阶段桉树叶绿素含量的差异Fig.3 Differences of chlorophyll content of eucalypts among larva developmental stages
3 结论与讨论
植物对虫瘿感染的光合响应机制尚不明确[4-12]。本文通过比较不同抗性桉树品系在桉树枝瘿姬小蜂不同发育阶段光合参数、光响应指标及叶绿素含量的动态变化,揭示桉树对姬小蜂虫瘿发育的光合响应差异。本研究结果表明:姬小蜂不同发育阶段的虫瘿在不同程度上影响虫瘿叶片的光合作用,且这种影响与植物抗性密切相关。此外,两个品系虫瘿叶片间的光合指标也有差异:DH201-2的WUE、Rd在感染虫瘿后显著低于EA,Tr在S2阶段显著高于EA,AQY 在S1阶段显著低于EA。
气孔是气体交换的主要通道,调控着植物的气体交换率和水分蒸腾率[25-26]。Gs为气孔张开的程度,是影响植物光合、呼吸及蒸腾的主要因素。Tr可调节水分损失以保证体内水分的有效利用[27]。WUE 则反映植物对水分的利用水平,由光合速率与蒸腾速率共同决定[14]。试验中,两桉树品系受害后,在水分利用、光能利用能力以及暗呼吸强弱方面存在差异:感染虫瘿后,DH201-2 各阶段Gs均高于EA,S2阶段Tr也显著高于EA,但WUE 均低于EA,说明DH201-2 调节水分损失及水分利用的能力低于EA。寇江涛等[14]也发现苜蓿抗性无性系受蓟马危害后,对水分损失的调节能力和水分利用效率均高于高感无性系。此外,本文中两品系的Gs均在S2阶段显著升高,说明S2阶段是虫瘿生长的旺盛时期,其气体交换及呼吸、蒸腾速率均高于其它阶段。
AQY 为弱光阶段光响应曲线的斜率,AQY 越高,植物对弱光的利用能力越强[28]。本文中,EA 的AQY 在S1阶段显著升高,且显著高于DH201-2,说明EA 在S1阶段对弱光的利用能力增强。光合产物的合成与运输需要呼吸提供能量[29],Rd升高不利于有机物的积累[30]。但呼吸速率越大,植物的生理活性越强[4],因而有利于植物在强光下的光合作用。试验中EA 的Rd在各发育阶段均显著升高,且高于同一阶段下的DH201-2;而DH201-2 受害前后无显著变化。表明 EA 的有机物积累低于DH201-2,但对强光的适应性要强于DH201-2。
补偿效应普遍存在于生命系统中[31-33],植物受害后可在生长、生理上形成补偿[34]。其主要有3 种表现形式:超补偿、等量补偿及不足补偿[35]。两品系的Pn在各阶段均无显著差异,DH201-2 的Amax在S1、S2阶段反而显著升高,表明两品系均具有一定的光合补偿能力,短期内净光合速率不受影响,且DH201-2 的补偿效应更强,形成超补偿。这可能是由于 Gs和 Tr的提高增加了叶片 CO2供应(DH201-2 的 Ci显著高于 EA)。但随着虫瘿发育,Pn、Amax下降,表明随植物受害时间延长,净光合速率降低。叶绿素在植物吸收和传递光能中极其重要,其含量将直接影响植物的光合作用速率[36]。EA 和DH201-2 受害后,叶片叶绿素含量均显著降低。其它研究也报道,被虫瘿侵染后,植物叶绿素含量呈降低趋势[6,15,23,37]。相反地,吴耀军 等发现,被桉树枝瘿姬小蜂侵染后,巨圆桉DH201-2和巨尾桉GL-UG9 叶绿素含量显著升高[20]。此外,虫瘿数量[8]、叶片和虫瘿的相对位置[4,10]、昆虫食性[11-12]及植株营养状况[38]等均可能影响植物光合作用。

