一株桑椹菌核病生防菌分离鉴定及其拮抗作用分析
朱志贤,于翠,李勇,莫荣利,邓文,胡兴明
(1.湖北省农业科学院经济作物研究所,湖北武汉 430064;2.湖北省农业科学院,湖北武汉 430064)
果桑是以产果为主、果叶兼用型桑树的统称。其果实桑椹具有丰富的营养和药用价值,花青素含量极高,抗氧化功效明显,具有促进造血细胞生长、降血糖、降血脂等药理作用,被原卫生部列为“既是食品又是药品”名单[1-2]。桑椹除直接食用外,目前已开发出果汁饮品、桑果酒、桑果酱、桑椹膏及花青素等产品,表现出巨大的产业发展潜力和广阔的市场前景[3]。然而在果桑产业发展过程中,桑椹菌核病来势猛、发病快,发病率高达30%~90%,有些果桑园甚至绝产[4],桑椹菌核病已成为限制果桑产业发展的瓶颈问题。
桑椹菌核病又称白果病,目前公认且常见的菌核病有桑椹肥大型菌核病、桑椹缩小型菌核病和桑椹小粒型菌核病3 种,病原菌分别为桑实杯盘菌Ciboria shiraiana、桑椹核地杖菌Scleromitrula shiraiana和肉阜状杯盘菌Ciboria carunculoides[5-8]。除上述病原菌外,王国良 等在宁波地区还发现了Scleromitrulasp.、Scleromitrula rubicola和Synciboria ningpoensis等桑椹菌核病菌[9];贺磊 等报道了桑茎点霉Phoma moricola同样可以引发桑椹菌核病,且其病果形态与桑椹肥大型菌核病颇为相似[10];胡军欢 等在宁波天宫庄园桑果基地发现核盘菌Sclerotinia sclerotiorum也能导致桑椹菌核病[11]。所有报道的病原菌中,由C.shiraiana引起的桑树肥大型菌核病在亚洲分布最广泛[4,9,12]。
目前生产上防治桑椹菌核病主要靠化学药剂防治。常用药剂有70%甲基托布津和50%多菌灵,两者均为单作用位点的内吸性杀菌剂,大量滥用后,病原菌很容易产生抗药性,己报道多菌灵在多种作物防治上产生了抗药性[13];而且农药残留还会引发食品安全、环境污染等问题。一些农业措施如清除病枝病果、合理栽植、深翻土壤、合理施肥、覆盖地膜等,可一定程度减轻病害发生,但不能从根本上控制病害。利用有益微生物防治桑椹菌核病可以维持生态环境平衡,是一种安全有效措施,逐渐受到人们重视。已经发现一些对桑椹菌核病菌具有拮抗作用的微生物,如苏云金杆菌Bacillus thuringiensis、肠杆菌Enterobactersp.、哈茨木霉Trichoderma harzianum、棘孢木霉Trichoderma asperellum等[12,14-15],但是不同拮抗微生物的应用范围各有其局限性,因此筛选更多更有效的拮抗微生物尤为重要。已报道应用于桑椹菌核病生物防治的生防菌以芽孢杆菌为主,脂肽类化合物是芽孢杆菌产生的主要抑菌活性物质,可划分为表面活性素(Surfactin)、伊枯草菌素(Iturin)和丰原素(Fengycin)3 大类。其中Surfactin的分泌利于细菌定殖,Iturin 和Fengycin 具有较强抑制真菌菌丝生长的作用。目前报道芽孢杆菌脂肽类化合物的功能基因主要有srfAA、srfAB、bmyB、fenD、bioA和ituC等[16]。笔者从健康桑椹中分离获得一株对桑椹菌核病菌具有拮抗活性的内生菌,对其进行抑菌谱测定和分类鉴定,并对其发酵浓滤液的性质及拮抗机理进行初步研究,以期为桑椹菌核病的生物防治提供有应用价值的生防菌株。
1 材料与方法
1.1 抑菌谱测定靶标菌株 桑椹核地杖菌分离自湖北宜昌市三斗坪镇采集的桑椹菌核病病果,肉阜状杯盘菌分离自湖北恩施市龙凤镇采集的桑椹菌核病病果;所用其它真菌核盘菌S.sclerotiorum、灰霉菌Botrytis cinerea、链铬孢菌Alternaria alternata、拟茎点霉Phomopsissp.、镰刀菌Fusariumsp.、节菱孢霉Arthriniumsp.分离自发病桑椹;桑实杯盘菌(CCTCC AF 2014019)购自中国典型培养物保藏中心。
1.2 内生菌的分离纯化 将采集的健康桑果小核果用75%酒精表面消毒30 s,然后用4%次氯酸钠溶液处理2 min,无菌水漂洗3 次,随即取出,置于PDA 平板上,25 ℃培养[17];待组织边缘长出菌落后,将长出的细菌用平板划线法进行纯化,获得内生菌Wh-1 菌株。
1.3 内生菌Wh-1 的抑菌谱测定 采用对峙培养法测定分离获得的内生细菌Wh-1 菌株抑菌谱,以未接细菌的菌落为对照,每个处理设置3 个重复,置25 ℃培养箱恒温培养5 d 后,测量其抑菌率;其中,桑椹核地杖菌、肉阜状杯盘菌在培养20 d 时测算抑菌率;桑实杯盘菌培养2 d 时测算抑菌率。
抑菌率(%) = (对照菌落直径- 处理菌落直径)/对照菌落直径×100。
1.4 内生拮抗菌Wh-1 的鉴定
1.4.1 形态学观察 首先将Wh-1 划线接种于PDA 培养基,37 ℃培养48 h 后观察菌落形态特征。挑取培养基上的菌落进行革兰氏染色和芽孢染色,显微镜(DM500,Leica,德国)下观察其菌体形态特征。
1.4.2 鉴定仪鉴定 对Wh-1 菌株进行形态鉴定后,利用Biolog 进行证实。Biolog 系统鉴定结果主要有 3 个参数, 即可能性(Probability,PROB)、相似性(Similarity,SIM) 和位距 (Distance,DIST),以SIM 值最为重要,SIM 值表示测试结果与数据库相应数据的相似程度。Biolog 系统规定:细菌培养当SIM >0.50,为系统确定的种属鉴定结果,且该值越接近1.00,鉴定结果的可信度越高。当 SIM <0.75(4~6 h)或 0.5(16~24 h),自动给出的鉴定结果为属名[18]。具体方法是:将纯化的菌株划线转接到BUG 培养基上,于30 ℃培养24 h,用无菌棉签蘸轻轻擦下培养基上的菌落,转入专用接种液中(Biolog公司),制备成均一的菌悬液,再用8 孔移液器将菌悬液分加在 Biolog 鉴定板的各孔中, 每孔各150 μL。盖上鉴定板盖,置于25 ℃的培养箱中培养,培养 16~24 h 后,取出鉴定板,置于 Biolog 自动微生物鉴定系统(MicroStationTM,Biolog,美国)上读取结果。
1.4.3 分子生物学鉴定 采用 CTAB 法提取Wh-1菌株的基因组DNA,利用超微量分光光度计(NanoDrop One,Thermo Scientific,美国)检测其浓度及质量。采用引物 27 F(5′-AGAGTTTGATCCTGGCTCAG-3′) 和 1492R(5′-TACGGCTACCTTGTTACGACTT-3′)进行 16S rDNA 片段 PCR 扩增。委托擎科生物科技有限公司进行PCR 产物纯化和测序。将测序结果与GenBank 中已知的16S rDNA序列进行 BLAST 比对分析。用 MEGA 5.05 软件中的最大似然法,选用Tamura-Nei model 模型构建系统进化树,进化树用自展分析法进行检验,循环1 000 次。
1.5 菌株Wh-1 发酵滤液理化特性分析
1.5.1 发酵滤液的制备 先将菌株Wh-1 在PDA平板上于25 ℃活化2 d,再将单菌落接种到含有50 mL PDB 的三角瓶中,于 180 r/min 下,33 ℃振荡培养48 h,得到浓度为OD600值等于1.95 的Wh-1发酵菌液;将所述的发酵菌液,6 000 r/min 下离心20 min,取离心后的上清液,用孔径为0.22 μm 的细菌过滤器过滤,得到无菌发酵滤液。后续试验均在发酵滤液中加入一定量的吐温,使吐温终浓度为0.025%。
1.5.2 不同发酵时间对发酵滤液生物活性的影响将Wh-1 单菌落接种到50 mL 液体PDB 培养基置于25 ℃摇床,180 r/min 下,分别振荡培养24,48,60,72,84 h 后,将不同处理的发酵滤液按体积分数1%(V/V)加入PDA 中,用打孔器(直径6 mm)打取桑实杯盘菌菌丝块分别接于PDA 平板中央,每个处理设置3 个重复,置培养箱25 ℃恒温培养3 d后,进行抑菌率测定。
1.5.3 不同体积分数发酵滤液生物活性测定 按体积分数分别为0.1%,0.2%,0.6%,1%,2%,5%(V/V)将不同含量的发酵滤液分别加入到总体积为10 mL的PDA 平板中,用打孔器打取桑实杯盘菌菌丝块分别接于发酵滤液的PDA 上培养,以不加发酵滤液作为对照,每个处理设置3 个重复,置培养箱25 ℃恒温培养3 d 后,分别测定抑菌率。
1.5.4 不同温度对发酵滤液生物活性的影响 将制备好的发酵滤液分别经 4, 20,40,60,80,100 ,120 ℃处理20 min 后,将不同处理的发酵滤液按体积分数1%(V/V)加入PDA 中,用打孔器打取桑实杯盘菌菌丝块分别接于PDA 平板中央,每个处理设置3 个重复,置培养箱25 ℃恒温培养3 d 后,进行抑菌率测定。
1.6 菌株Wh-1 拮抗机理初步分析
1.6.1 发酵滤液对桑实杯盘菌抑菌作用的显微观察 用打孔器打取桑实杯盘菌菌丝块接种于发酵滤液体积分数为1%(V/V)的PDA 平板中央,25 ℃培养箱培养,48 h 后挑取桑实杯盘菌菌丝体置于显微镜下观察,以不加发酵滤液PDA 平板上的菌丝体作为对照。
1.6.2 脂肽类化合物合成相关功能基因分析 用已报道的srfAA、bmyB、bacA、bioA和fenD基因的特异引物[19-21]对菌株Wh-1 的脂肽类化合物合成相关功能基因进行扩增(表1)。PCR 反应在25 μL 体系中进行:2 × Es Taq Mastermix 12.5 μL,10 μM 引物各 1 μL,模板 DNA 50 ng 1 μL,加入 ddH2O 至体系体积达25 μL。其中srfAA、bmyB、bacA基因 PCR反应条件:95 ℃预变性 5 min;94 ℃变性 1 min、58 ℃退火 45 s、72 ℃延伸 1 min,共 35 个循环;最后72 ℃ 延伸 10 min。bioA和fenD基因 PCR 反应条件:95 ℃预变性 4 min;94 ℃变性 1 min、58 ℃退火1 min、70 ℃延伸 1 min,共 40 个循环;最后 70 ℃延伸10 min。反应完成后取 5 μL 扩增产物,2 μL 6 × Loading Buffer 溶液和 2 μL Goldenview 核酸染料混合后用于琼脂糖凝胶电泳(2.5% 琼脂糖凝胶),120 V 电压,电泳40 min 后,在 Bio-Rad 凝胶成像下检查扩增结果。
1.7 数据处理和分析 内生拮抗菌抑菌率测定的数据,采用DPS(version 3.01)软件对其进行方差分析,并用LSD 法比较不同处理间的差异显著性。

表1 供试脂肽类化合物合成相关功能基因PCR 扩增引物Tab.1 Primers used for PCR analysis of lipopeptide compounds related functional genes
2 结果与分析
2.1 内生菌Wh-1 的抑菌谱测定 菌株Wh-1对桑实杯盘菌、桑椹核地杖菌和肉阜状杯盘菌的菌丝生长有显著抑制作用,抑菌率依次分别为63.15%,100%,100%;对从发病桑椹上分离的真菌灰霉、链格孢、拟茎点霉、镰刀菌、节菱孢霉均具有强烈拮抗作用,抑菌率依次分别为88.97%,67.54%,44.23%,37.62%,47.92%(图1)。
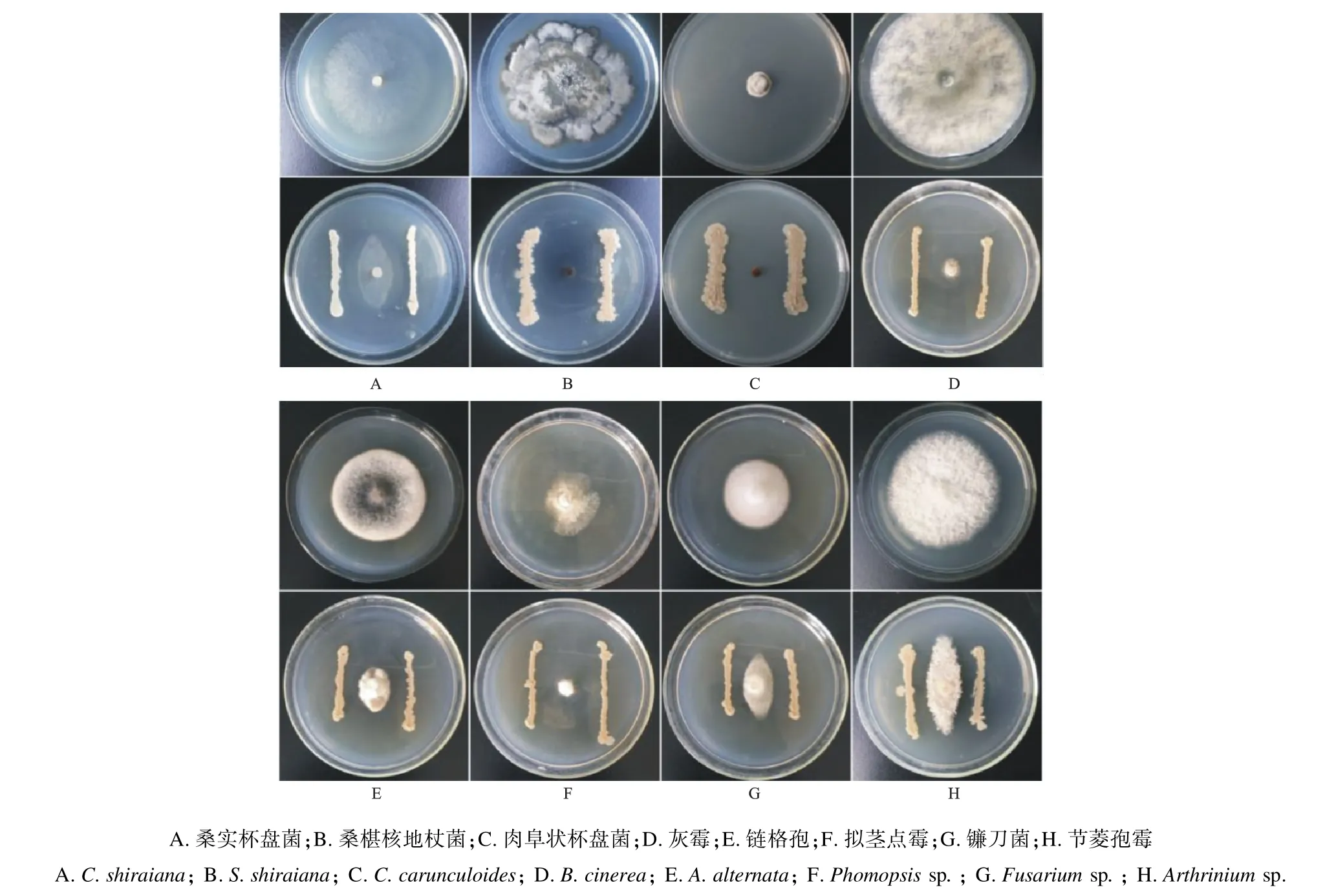
图1 菌株Wh-1 对发病桑椹上分离的真菌的拮抗作用Fig.1 Antagonistic effect of strain Wh-1 on fungi isolated from diseased mulberry fruits
2.2 内生拮抗菌Wh-1 的鉴定
2.2.1 形态学鉴定 内生菌Wh-1 在PDA 培养基上培养48 h 后,菌落呈圆形,表面及边缘粗糙,呈乳白色,蜡状(图2A)。革兰染色显示该菌体为革兰氏阳性杆状菌株,且能产芽孢(图2B,C)。
2.2.2 Biolog 鉴定 当Wh-1 菌株 25 ℃恒温箱中培养16~24 h,Biolog 自动微生物鉴定系统给出的最大可能结果是Bacillus megaterium(巨大芽孢杆菌),其 SIM 值为 0.175;SIM <0.50,只能初定为芽孢杆菌属的细菌。
2.2.3 16S rDNA 序列测定及系统发育分析 内生菌Wh-1 菌株16S rDNA 基因PCR 扩增测序后得到长度为1 425 bp 的片段,提交该序列相关信息至GenBank,获得登录号MF375212,与 GenBank 中序列在线比对,与多株贝莱斯芽孢杆菌Bacillusvelezensis16S rDNA 序列的同源性高达99%以上。基于16S rDNA系统发育分析结果显示,Wh-1 菌株与登录号为 CP022341,MH259879,KX129838 等B.velezensis的亲缘关系最近,处于系统发育树的同一分枝(图3)。

图3 桑椹内生拮抗细菌Wh-1 菌株基于16S rDNA 序列的系统发育树Fig.3 Phylogenetic tree of mulberry endophytic antagonistic bacterial strain Wh-1 based on 16S rDNA sequence
2.3 发酵滤液理化特性
2.3.1 不同培养时间发酵滤液的生物活性 菌株Wh-1 在发酵滤液中培养48~72 h 时,其发酵滤液中拮抗物质活性最强,对桑实杯盘菌的抑菌率为90%以上(表2)。
表2 不同处理Wh-1 发酵滤液对桑实杯盘菌的抑菌作用Tab.2 The inhibition effect of different treaments of Wh-1 fermentation filtrates on C.shiraiana
2.3.2 不同体积分数发酵滤液的生物活性 随着发酵滤液体积分数不断升高,发酵滤液对桑实杯盘菌的抑制作用不断增强。当发酵滤液的体积分数达到5%时,在PDA 上可以完全抑制桑实杯盘菌的生长(表2)。
2.3.3 不同温度对发酵滤液生物活性的影响 发酵滤液经20 ℃处理后抑菌效果最好,4 ℃低温处理与40~100 ℃高温处理后,抑菌效果无显著性差异(表2),表明发酵滤液活性成分热稳定性好。
2.4 菌株Wh-1 拮抗机理初步分析
2.4.1 Wh-1 发酵滤液对桑实杯盘菌的抑制作用桑实杯盘菌在混有Wh-1 发酵滤液的PDA 培养基上菌落生长衰弱、缓慢。在PDA 培养基上培养的菌丝分支近直角,分支处稍有缢缩;而在含有1%发酵液的PDA 培养基上培养的菌丝体膨大成鸟巢状。说明该菌对桑实杯盘菌菌丝有致畸作用,可以有效抑制菌丝扩展(图4)。
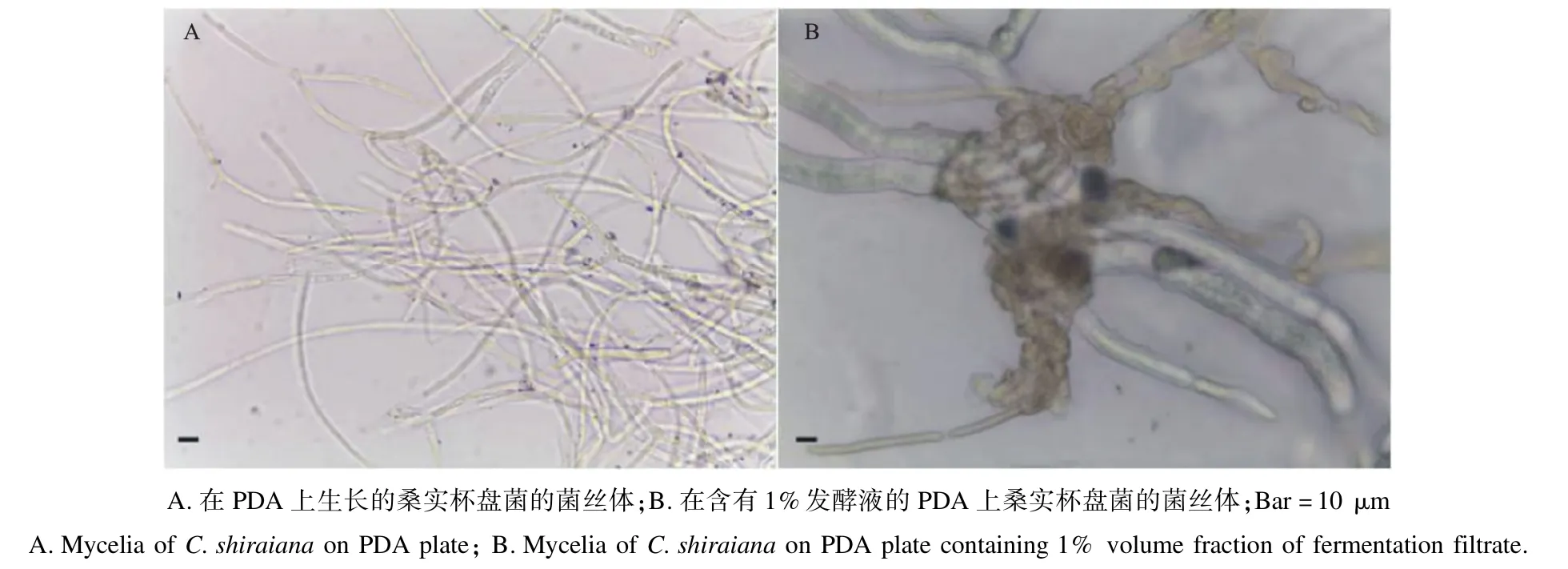
图4 菌株Wh-1 发酵滤液对桑实杯盘菌菌丝的破坏作用Fig.4 The destruction effect of fermentation filtrate of strain Wh-1 on hyphae of C.shiraiana
2.4.2 脂肽类化合物合成相关功能基因分析 利用已报道的5 对特异引物可从Wh-1 菌株中扩增到srfAA、bmyB、bacA、bioA、fenD基因,如图5。

图5 菌株Wh-1 脂肽类化合物合成相关功能基因扩增结果Fig.5 PCR amplification of strain Wh-1 lipopeptide compounds related functional genes
3 结论与讨论
芽孢杆菌Bacillusspp.是广泛存在于自然界中重要的微生物资源,以生长速度快、 营养需求简单、抗逆性强以及可以产生多种拮抗物质等优点成为近年来生防微生物研究的热点。Sultana 和 Kim 发现B.thuringiensis优于Enterobactersp.抑制桑实杯盘菌菌核萌发,阻止子囊盘形成,田间试验表明B.thuringiensis可以降低发病率[12]。谢洁 等研究发现B.subtilis7PJ-16 菌株96 h 发酵滤液对10 种植物病原真菌具有不同程度的抑制作用,其中对桑椹核地杖菌的抑菌率高达100%,且发酵滤液的热稳定性强[22]。发酵滤液有利于种子萌发和种苗生长,且对组培苗有促生作用。三年田间试验结果表明生防菌悬浮液和发酵滤液均具有田间防效: 2015年在桑树花期喷施5 次7PJ-16 菌株的发酵上清液,其病果率仅为1.83%,较清水对照处理组降低18.66%;2016年生防菌发酵滤液的防效达到了72.13%,比多菌灵防效低26.03%;2017年喷洒3次109CFU/mL 生防菌悬浮液及其发酵滤液防效分别为90.84% 和87.78%[22-23]。方翔 等从健康桑树中分离筛选发现甲基营养型芽孢杆菌Bacillus methylotrophicus对桑椹核地杖菌和核盘菌的抑菌效果最为显著,抑菌率高达98.23%和99.72%,对灰霉菌、腐霉菌等10 种常见植物病原菌具不同程度的抑制作用,且其发酵滤液热稳定性强[24]。本文作者从健康的桑椹中分离获得一株内生菌Wh-1 对桑椹菌核病3 种主要病原菌均有显著拮抗作用。根据菌株的形态、Biolog 鉴定及分子生物学特征,将其鉴定为贝莱斯芽孢杆菌B.velezensis。在Wh-1 发酵滤液体积分数为5%的PDA 平板上桑实杯盘菌不能生长,且Wh-1 发酵滤液热稳定性好。抑菌机理初步分析发现该菌发酵滤液对桑实杯盘菌菌丝有致畸作用,可以有效抑制菌丝扩展;同时该菌株对从发病桑椹上分离的其它真菌如灰霉、链格孢、拟茎点霉、镰刀菌及节菱孢霉等也有强烈拮抗作用。表明Wh-1 菌株所产生的拮抗物质抗菌谱广,具有开发成生防菌剂的潜力,可用于桑椹病害的生物防治,其应用价值值得进一步探索。
芽孢杆菌对病原微生物生长及代谢的抑制作用主要源于其自身产生的代谢产物,如酶类、细菌素、脂肽类及成分复杂的挥发性物质等[25]。有研究证明,贝莱斯芽孢杆菌能产生具有广谱抗菌活性的次生代谢产物,是增加作物产量、维护生态环境和农业生态系统的首选生物药剂[26]。笔者通过对多种脂肽类化合物合成相关功能基因的PCR 检测,发现菌株Wh-1 具有杆菌溶素、芽孢菌霉素等多种脂肽类化合物合成相关功能基因。脂肽类化合物合成相关功能基因的分析为研究Wh-1 的代谢活性物质提供了新线索;其相关功能基因编码产物的活性,还需要做进一步深入的研究。此外,菌株Wh-1 发酵滤液的主要抑菌活性成分,其用于桑椹菌核病生物防治的安全性及田间防病效果,有待进一步研究。

