伴病理性乳头溢液的乳腺癌患者癌组织整合素β1的表达及意义
孙全武,杜小平*,郝 杰,时 荣,刘 波,黄海云
(甘肃省人民医院乳腺外科,甘肃 兰州 730000)
乳头溢液是女性患者在乳腺科门诊常见就诊原因之一[1]。虽然导管内乳头状瘤是病理性乳头溢液(pathological nipple discharge,PND)的最常见病因,但既往研究发现,2.8%~21.3%的女性乳头溢液患者最终被诊断为乳腺癌[2],因为当乳腺癌侵犯大导管引起乳管内出血性或导管内乳头状癌刺激乳管分泌增加,可出现病理性乳头溢液。一项meta分析纳入3 110名乳头溢液患者,结果乳腺癌的发病率占18.7%[3]。国内学者研究发现整合素β1高表达与浸润性微乳头状癌的侵袭性和淋巴结转移密切相关[4]。我们前期通过meta分析发现整合素β1高表达与乳腺癌总生存期低显著相关[5], 合 并 风 险 比 HR=1.88, 95%CI(1.46, 2.42)(P<0.01);整合素β1高表达与乳腺癌无病生存期降低显著相关,合并HR=1.63,95%CI(1.17,2.25)(P<0.01)。目前,以病理性乳头溢液为首发症状的乳腺癌患者病理特征研究较少,本研究采用免疫组化检测乳腺癌伴病理性乳头溢液患者癌组织中整合素β1的表达,并选取同期以乳房肿块或体检发现异常而就诊的乳腺癌病例作为对照,分析整合素β1与临床病理学特征的关系,探讨其对乳腺癌预后的影响。
1 材料与方法
1.1 临床资料
自甘肃省人民医院病案管理系统调阅2006年1月1日—2013年12月31日期间在乳腺外科行手术治疗的乳腺癌病例资料。检索这些患者的临床资料,包括初诊时年龄、绝经状况、肿瘤大小、是否转移至局部淋巴结、术后病检及免疫组化结果、术后复发、远处转移及死亡时间。排除随访资料不完整、后续在其他医院复查以及Her-2检测不确定的患者。以该院收治的112例伴乳头溢液就诊的乳腺癌作为研究对象(PND组),部分患者查体或影像学检查可伴有乳房肿块。选取同期以乳房肿块或体检发现异常而就诊的112例乳腺癌作为对照组,这部分患者在发病过程以及体格检查均未见乳头溢液。在该院病理科调取以上患者标本,所有标本经10%福尔马林固定及石蜡包埋,采用免疫组化检测乳腺癌组织中整合素β1的表达。
1.2 方法
1.2.1 病理及免疫组化检测方法 分析以下临床因素和病理组织学指标:年龄、肿瘤大小、组织学分级、淋巴结和雌激素受体(ER)、孕激素受体(PR)状态、人表皮生长因子受体-2(Her-2)状态等。ER、PR、Ki-67、Her-2为术后常规检测,数据记录在病案数据库。ER和PR免疫组化检测结果判定参照文献[6],Her-2/neu蛋白(+++)阳性表达者直接确定为阳性,(++)阳性表达者进一步行多重荧光原位杂交(fluorescence in situ hybridization,FISH)检测,根据基因扩增结果确定为阳性或阴性,具体判定标准参照文献[7],对于个别Her-2的FISH检测结果不确定者送其他实验室进一步核实,确保Her-2检测结果的准确性。免疫组化用切片厚4μm,抗体为小鼠抗人整合素β1(1∶100稀释)单克隆抗体(4B7R),美国圣克鲁斯生物科技公司产品。根据常规亲和素-生物素-过氧化物酶复合物法(avidin biotin-peroxidase comples,ABC)使用DAKO全自动免疫组化仪染色。免疫组化结果判定参照文献[8],根据染色强度(无色0分、淡黄色1分、棕黄色2分、棕褐色3分),肿瘤细胞膜或核阳性染色百分比(<10%计 0分、≥10%~25%计 1分、≥25%~50%计2分、≥50%计3分),染色强度与阳性细胞百分比的乘积≤4分确定为阴性(-),≥6分确定为阳性(+)。
1.2.2 统计学方法 采用Graphpad prism 7.0软件绘制生存曲线;其余统计采用SPSS 19.0软件,率的比较采用Pearson卡方检验,Cox风险比例模型分析单因素及多因素对伴乳头溢液组患者总生存期的影响,Kendall’s tau-b检验分析伴乳头溢液组整合素β1表达与Her-2的相关性;卡方检验分析伴乳头溢液组整合素β1表达与淋巴结转移以及远处转移的相关性,α=0.05为检验水准。
2 结果
2.1 研究对象一般资料的对比
伴病理性乳头溢液组与对照组患者在年龄构成、肿瘤大小、组织学分级以及淋巴结转移等方面基线值差异均无统计学意义(P>0.05,表1),说明两组患者间具有可比性。

表1 伴病理性乳头溢液组与对照组患者资料及病理学特征基线值对比(n=112)
2.2 伴乳头溢液组整合素β1的阳性表达
癌组织整合素β1免疫组化结果见图1。伴乳头溢液组整合素β1阳性表达率为14.29%(16/112),显著低于对照组阳性表达率25%(28/112),差异具有统计学意义(χ2=4.073,P=0.044);伴乳头溢液组发生淋巴结转移或远处转移时整合素β1阳性表达率明显高于无转移者(P均<0.05),见表2。

图1 乳腺癌组织整合素β1免疫组化结果(×200)

表2 整合素β1在伴乳头溢液组癌组织中的表达情况
2.3 整合素β1表达对乳腺癌预后的影响
Kaplan Meier法生存分析发现,对照组总生存期明显低于伴乳头溢液组(HR=1.773,P=0.012),伴乳头溢液组整合素β1高表达患者的总生存期明显低于低表达组(HR=2.573,P=0.023),见图2。进一步采用Cox风险模型分析单变量和多变量对伴乳头溢液组患者总生存期的影响。结果显示乳头溢液组整合素β1的表达与Her-2呈正相关(r=0.281,P=0.001),淋巴结转移、组织学分级以及整合素β1高表达是影响伴乳头溢液组乳腺癌患者总生存期的3个独立危险因素(P均<0.01),见表3和表4。

图2 乳腺癌患者生存曲线图
3 讨论
整合素β1作为黏附分子与肿瘤细胞耐药有关,最近研究发现,半乳糖凝集素-1与整合素β1的结合通过促进生存素在乳腺癌细胞中的表达而增强了耐药性[9]。整合素β1与Her-2共享部分信号通路下游分子,如磷脂酰肌醇3-激酶/Akt和细胞外信号调节激酶1/2(ERK1/2)信号通路[10]。Lesniak 等[11]采用小干扰 RNA基因敲低整合素β1的表达,证明整合素β1高表达促进肿瘤细胞增殖是通过活化PI3K/Akt和ERK1/2信号通路活性而起作用。而曲妥珠单抗是通过拮抗Her-2/PI3K/Akt信号活性抑制肿瘤细胞增殖。此外,整合素介导的生长因子受体活化可能进一步触发其他生存信号机制,并抵消曲妥珠单抗的抗肿瘤作用[11],所以整合素β1高表达会降低曲妥珠单抗对Her-2阳性乳腺癌的疗效。而且整合素β1通过细胞外基质的相互作用活化PI3K/Akt信号通路,保护乳腺癌细胞免受化疗[12]或电离辐射诱导的细胞凋亡[13],所以整合素β1表达不但降低曲妥珠单抗的抗肿瘤作用,而且影响肿瘤细胞对放化疗的敏感性,显著影响乳腺癌的预后。

表3 Cox风险比例模型分析单变量对乳头溢液组患者总生存期的影响
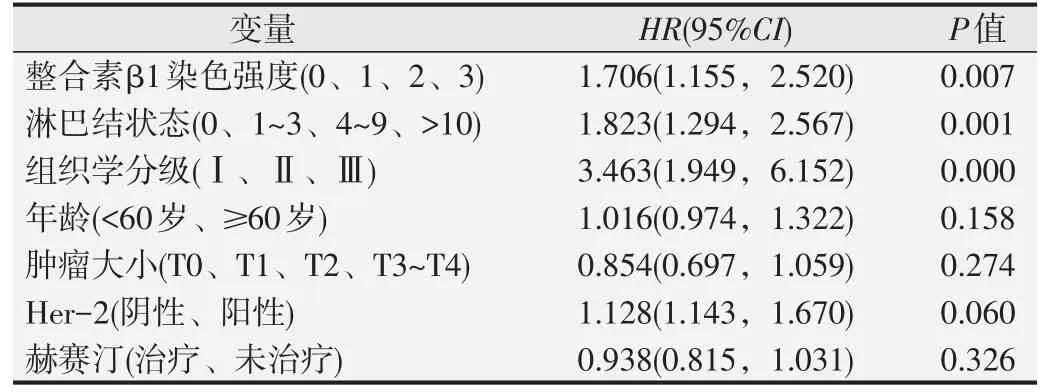
表4 Cox风险比例模型分析多变量对乳头溢液组患者总生存期的影响
已有研究[14]证明,整合素可以促进癌细胞迁移和侵袭。整合素β1是整合素家族最广泛表达于肿瘤细胞的生物标记物,可预测肿瘤患者的临床过程和预后[15]。本次实验结果显示伴乳头溢液组整合素β1阳性表达率为14.29%(16/112),显著低于对照组阳性表达率25%(28/112),差异具有统计学意义(χ2=4.073,P=0.044);伴乳头溢液组发生淋巴结转移或远处转移时整合素β1阳性表达率明显高于无转移者(P均<0.05);且乳头溢液组患者整合素β1高表达者总生存期显著降低,提示整合素β1表达水平越高预后越差。这与整合素β1阳性表达与乳腺癌、前列腺癌、胰腺癌等预后不良密切相关的结论相符合[15]。早期纳入研究的部分患者因交通条件受限以及术后不按时复查,无病生存期数据有偏差,所以,未分析整合素β1高表达对乳头溢液组患者无病生存期的影响。Lee等[16]研究发现,血管内皮生长因子可以通过上调和(或)活化整合素β1促进血管形成,进一步采用脑微血管内皮细胞实验显示,阻断整合素β1表达后所有血管生成过程均受到抑制(包括黏连、迁移、毛细血管形态发生),因此,他们提出整合素α6β1与乳腺癌细胞转移至大脑密切相关。针对整合素β1的靶向治疗或许能延缓乳腺癌脑转移、延长乳腺癌患者总生存期和无病生存期。近来,国外学者曾针对Her-3和整合素β1联合靶向治疗Her-2阳性乳腺癌,发现是一种非常有效的治疗措施,且证实了Her-3也是介导Her-2阳性乳腺癌进展的主要因素[17]。今后采用抗Her-2、Her-3以及整合素β1的多靶点治疗或许成为Her-2阳性乳腺癌的治疗方向。
本研究中,我们发现整合素β1在伴乳头溢液组的癌组织高表达可显著降低乳腺癌患者总生存期,可能与乳腺癌转移密切相关,整合素β1有望成为判定乳腺癌预后的新指标。与其他首发症状为主的患者相比,以乳头溢液为首发症状的乳腺癌预后相对较好,如果及时筛查、早发现、早诊治,将会显著提高其治愈率。本次研究的局限性在于纳入Her-2阳性乳腺癌例数较少、可能导致研究结果偏倚,统计分析发现其对伴乳头溢液组患者总生存期无明显影响。以及出院后的治疗依存性等都会影响本次研究结果,所以研究结论尚需多中心大量本试验进一步证实。今后更严格地选择对曲妥珠单抗治疗敏感的患者,尽量减少不必要的药物毒性,如心脏事件[18],避免因整合素β1过表达引起曲妥珠单抗治疗无效或疗效不佳。对于整合素β1过表达的乳腺癌患者,探索新的替代治疗策略,如研制针对整合素β1的小分子或抗体抑制剂或许能进一步提高疗效、延长总生存期。

