TGF-β1对UVB辐射诱导人角质形成细胞m iRNA和环氧合酶-2表达的影响及机制
李玉文,李 辰,封江彬,范 莉,刘建香,刘青杰,田 梅*
(中国疾病预防控制中心辐射防护与核安全医学所,辐射防护与核应急中国疾病预防控制中心重点实验室,北京 100088)
紫外(ultraviolet,UV)线电磁辐射,根据波长分为UVA(315~400 nm)、 UVB(280~315 nm)和 UVC(190~280 nm),UV线能对人体健康产生不良效应,可导致DNA损伤、炎症、免疫抑制、光老化、基因突变和皮肤癌。目前,世界癌症研究协会已将紫外线(UVA和UVB)列为1类致癌源[1]。UVB对皮肤的损伤作用最强,研究表明,过量的UVB照射是皮肤癌的主要危险因素[2]。
角质形成细胞是人体抵御紫外线辐射的第一道防线,不仅是机体的保护细胞,而且参与各种细胞生物学过程,如免疫、炎症、增生以及肿瘤转化等[3-5]。有研究发现紫外线照射可诱导人角质形成细胞产生大量的 转 化 生 长 因 子-β(transforming growth factor-β,TGF-β)[6-7]。TGF-β可以调节细胞的生长、增殖、分化、迁移和凋亡等过程,与皮肤炎症和皮肤癌的进展密切相关[9]。因此,研究TGF-β在UVB诱导的皮肤损伤、炎症及皮肤癌中的作用机制,可以为预防与治疗紫外诱发皮肤肿瘤寻找新的生物靶点。
miRNA芯片研究发现,紫外线诱导皮肤细胞某些miRNA的表达变化可能与辐射后TGF-β1通路的表达和调控有关,可能在UV引起的致癌过程中发挥作用[9],TGF-β1是调控UV辐射诱导miRNA表达的重要的节点分子之一,这些miRNA包括let-7c,miR-23a、b,miR-139-6p等,其中miR-23a的表达与肿瘤生长、侵袭及血管生成有关。let-7c是let-7基因家族中的一员,在细胞生长、增殖等方面具有重要作用,与关键的原癌基因直接相关。
环氧合酶(cyclooxygenase,COX)是催化花生四烯酸转变为前列腺素的限速酶,与炎症、癌症和其他许多病理过程密切相关。高剂量紫外线照射能够诱导皮肤中COX-2的上调表达,在UVB长期照射以及UVB所引发的鳞状细胞癌中COX-2的表达也显著增高[10-11],在皮肤癌的发生中起重要作用。
本研究利用UVB照射TGF-β1处理的人角质形成细胞(HaCaT),检测细胞中敏感的与多种人恶性肿瘤密切相关的miRNA-23a和let-7c两种miRNA及炎症反应蛋白COX-2通路相关蛋白的表达变化,探讨TGF-β1与紫外辐射诱导的细胞损伤、炎症反应、肿瘤发生等的关系。
1 材料与方法
1.1 主要试剂
胎牛血清购自Gibco公司;MEM培养基购自康宁公司;TGF-β1购自CST公司;Trizol RNA提取试剂盒购自Invitrogen公司;TaqMan microRNA反转录试剂盒、miRNA引物和探针以及TaqMan Gene Expression Master Mix实时荧光定量PCR试剂盒均购自Applied Biosystems公司;BCA蛋白浓度检测试剂盒购自Thermo公司;β-actin、COX-2、caspase-3抗体均购自CST公司;HRP标记的山羊抗兔和抗鼠二抗购自中杉金桥公司。
1.2 细胞培养与细胞照射
HaCaT细胞购自北京协和医院细胞库,将细胞接种于含有10%胎牛血清的MEM培养基中,在37℃、CO2体积分数为5%、饱和湿度的培养箱中进行培养。
紫外照射是利用Ultra-Violet Products公司的CL-1000系统,UVB波长为302 nm,辐照度为55.5 W/m2,照射距离约为15 cm,照射剂量依据本所辐射防护研究室TN-2340紫外线强度剂量校准。将细胞培养皿放入仪器内,照射一定时间后取出。研究量效关系时选取10、20、30 mJ/cm2的UVB;研究时效关系时选择30 mJ/cm2的UVB。
1.3 细胞分组
对照组细胞采用常规培养基培养;处理组细胞是将 3 μL 的 TGF-β1(浓度为 10 ng/μL)加入到 3 mL HaCaT细胞培养基中,TGF-β1的终浓度为10 ng/mL,作用48 h后再进行转录水平和翻译水平的实验。
研究转录水平的表达时,采用10、20、30 mJ/cm2的UVB分别照射对照组和处理组细胞,于照后6 h检测两组细胞中miR-23a和let-7c的表达变化;采用30 m J/cm2的UVB分别照射对照组和处理组细胞,于照后4、12和24 h检测照后不同时间对两组细胞中miR-23a和let-7c表达变化的影响。
研究翻译水平的表达时,利用30 mJ/cm2的UVB分别照射对照组和处理组细胞,于照后不同时间(0、2、4、8、12、24和48 h)检测两组细胞中COX-2和凋亡执行分子caspase-3蛋白表达的变化。
1.4 实时荧光定量PCR检测m iR-23a和let-7c表达水平
使用Trizol试剂盒提取各组细胞RNA。利用TaqMan microRNA反转录试剂盒合成cDNA,反应总体积为7.5μL,其中RNA样本量为2.5μL(12.5 ng/μL),反应条件为16℃、30 min,42℃、30 min,85℃、5 min。利用TaqMan Gene Expression Master Mix实时荧光定量PCR试剂盒进行PCR扩增,反应总体积为12μL,其中反转录产物为0.9μL,每个样品设置3个平行样,每组实验重复3次。反应条件为:95℃预变性10 min,95℃、15 s,60℃、1 min,45个循环。HaCaT细胞的miRNA-23a和let-7c表达水平以U6为内参,利用Applied Biosystems 7500 Sequence Detection Software软件,依据相对定量的2-ΔCT法进行结果分析。
1.3 Western blot检测COX-2和caspase-3蛋白表达水平
收集各组细胞,加入细胞裂解液,冰上裂解提取总蛋白,并采用BCA法进行蛋白定量。配制12%的分离胶和4%积层胶进行SDS-PAGE电泳(恒压100 V),蛋白上样量为30μg,后将蛋白电转至PVDF膜(恒压100 V,1.5 h),加入5%脱脂牛奶室温封闭60 min,依据说明书分别加入COX-2和caspase-3的一抗(1∶1 000稀释),4℃孵育过夜,TBST洗涤3次,每次10 min;再分别加入相应的HRP标记的二抗(1∶3 000稀释),室温孵育60 min,TBST洗涤3次,每次20 min,加入ECL化学发光试剂,显影并成像。利用Image J软件对COX-2蛋白条带进行灰度分析。
1.4 统计学分析
应用SPSS 20.0统计软件分析,计量资料以均数±标准差(xˉ±s)表示,多组间比较采用单因素方差分析,各组均数间的两两比较用Bonferroni校正的f检验,以α=0.05为检验水准。
2 结果
2.1 TGF-β1对照后m iR-23a和let-7c表达的影响
实时荧光定量PCR检测各组细胞miR-23a的相对表达水平,结果如图1所示,对照组细胞经10和30 m J/cm2的UVB照射后6 h,miR-23a的表达未见明显变化;20 m J/cm2的UVB照射后6 h,miR-23a的表达略有升高。30 mJ/cm2的UVB照射后12 h和24 h,对照组miR-23a的表达增强(P均<0.05)。结果表明当一定能量的UVB照射一段时间后可以诱导正常HaCaT细胞中miR-23a的表达上调。
处理组细胞经10、20、30 m J/cm2的UVB照射后6 h,miR-23a的表达均升高(P均<0.05),且与同一照射剂量的对照组相比,处理组miR-23a的表达均显著增强(P均<0.05);30 m J/cm2的UVB照射后不同时点,处理组miR-23a的表达均增强(P均<0.05),在照后12 h时表达上调最显著;且与同一时点的对照组相比,处理组miR-23a的表达均明显增强(P均<0.05),说明TGF-β1可促进受照细胞中miR-23a的表达水平。然而,未受照的处理组细胞中miR-23a的表达无明显变化,说明TGF-β1作用于HaCaT细胞48 h,不能诱导未受照细胞中miR-23a的表达上调。此外,结合A、B两图可以看出,对照组细胞在30 mJ/cm2的UVB照射后6 h,未见miR-23a的表达明显增强,而处理组细胞在30 m J/cm2的UVB照射后0 h即出现显著的miR-23a表达上调,进一步说明TGF-β1可对受照HaCaT细胞中miR-23a的表达起到促进作用。
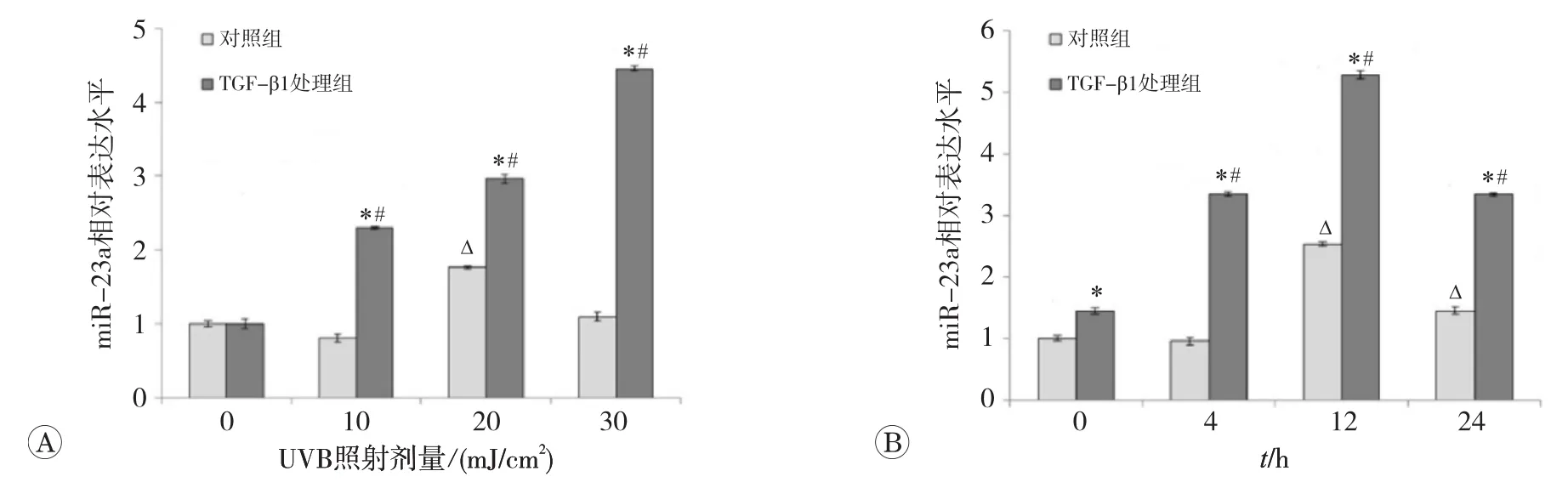
图1 实时荧光定量PCR检测m i-23a的表达变化情况
实时荧光定量PCR检测各组细胞let-7c的相对表达水平,结果如图2所示,20和30 m J/cm2的UVB照射后6 h,对照组细胞中let-7c的表达显著升高(P均<0.05),且30 m J/cm2的UVB照射后不同时点,对照组let-7c的表达均明显上升(P均<0.05),可以看出,UVB照射可促进正常HaCaT细胞中let-7c的表达。
与同一受照剂量的对照组相比,处理组未受照细胞与受10 mJ/cm2UVB照射的细胞内let-7c表达明显升高(P均<0.05),而20和30 m J/cm2UVB照射后,处理组let-7c表达明显下调(P均<0.05)。30 mJ/cm2的UVB照射后4、12和24 h,处理组细胞let-7c的表达与同一时点的对照组相比,均有所降低(P均<0.05),提示TGF-β1可在一定范围内抑制受照HaCaT细胞的let-7c表达。
2.2 TGF-β1对照后COX-2和Caspase-3表达的影响
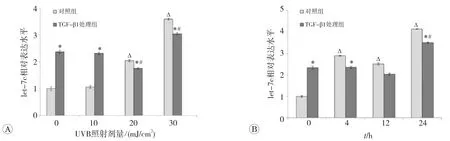
图2 实时荧光定量PCR检测let-7c的表达变化情况
Western blot检测HaCaT细胞中COX-2的蛋白表达水平,结果如图3所示,未受照和照射后0 h的对照组细胞中COX-2不表达,自照射后2 h开始,对照组细胞中出现COX-2的蛋白表达,说明UVB照射一段时间后可以诱导正常HaCaT细胞中COX-2的表达;而处理组细胞在UVB照射前后,COX-2蛋白均表达,尤其是照射后12、24和48 h,COX-2的表达较照射后0 h组明显增强(P均<0.05),照后同一时点内,处理组较对照组COX-2表达均显著上调(P均<0.05),提示TGF-β1和UVB均可诱导HaCaT细胞中COX-2的表达,而TGF-β1预先作用于细胞后,可使受照细胞中COX-2的表达水平上调更为明显。

图3 30 m J/cm2 UVB照射后不同时间COX-2蛋白的表达变化
Western blot检测HaCaT细胞中caspase-3的蛋白表达水平,结果如图4所示:对照组细胞经UVB照射后2、12、24和48 h,活化的caspase-3亚基表达显著增加,特别是照射后12 h开始caspase-3的活化明显增强,并一直持续至48 h;而处理组细胞受照后,活化的caspase-3亚基在照射后12 h时增加明显,而后随时间延长而明显减少,提示TGF-β1预先作用于HaCaT细胞,可抑制caspase-3亚基的活化。
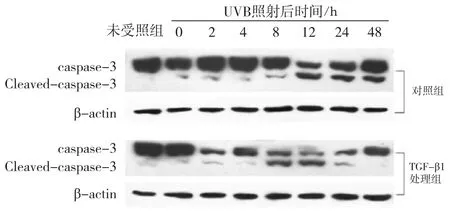
图4 30 m J/cm2 UVB照射后不同时间caspase-3蛋白的表达变化
3 讨论
紫外线可致癌,其中UVB致癌性最强,晒红及晒伤作用为UVA的1 000倍。由于紫外线照射不能穿透人体皮肤,因此表皮层是紫外线诱导的损伤和致癌的主要部位[9]。正常情况下,受损细胞可通过自身修复或诱导细胞凋亡来应对损伤,若受损细胞未能及时修复可导致肿瘤细胞的形成[12]。
有研究报导紫外线照射可诱导角质形成细胞产生大量的TGF-β[6]。众所周知,TGF-β在调节多种生物学事件中表现出双重作用,如细胞增殖和分化、血管生成、炎症和免疫应答以及癌症。在皮肤癌早期,TGF-β是角质形成细胞的有效生长抑制剂,对肿瘤起抑制作用;而到晚期,TGF-β失去对癌细胞生长抑制,且TGF-β诱导的皮肤炎症有利于皮肤癌进展和转移[13]。TGF-β的细胞和分子功能的复杂性使得其在组织稳态、疾病发展和肿瘤发生中的作用变得复杂。
本研究在前期建立紫外辐射模型的基础上,利用TGF-β1预先对HaCaT细胞进行干预,检测UVB照射后辐射敏感的肿瘤相关miRNA-23a、let-7c的表达水平,分析炎症相关蛋白COX-2、凋亡执行分子caspase-3的表达变化,探讨TGF-β1在UVB诱导的皮肤细胞辐射损伤中的作用及机制。
miRNA是一类广泛参与细胞重要生命过程的小分子RNA,已被公认为是参与人类肿瘤发生的一类新基因[14],在皮肤癌的发生、侵袭和转移中起重要作用[15]。Kraemer[9]等利用miRNA芯片和生物信息学分析发现,TGF-β1是调控UV辐射诱导miRNA表达的重要的节点分子之一,这些miRNA包括let-7c,miR-23a、b,miR-139-6p等,其中miR-23a的表达与肿瘤生长、侵袭及血管生成有关,可调节UV诱导的光化学产物环丁烷嘧啶二聚体(CPD)的清除、抗凋亡和端粒酶1/Caspase-7/STK4表达[16]。在对HaCaT细胞的研究中发现,miR-23a是一种光保护性miRNA,过表达的miR-23a可以通过抑制几个下游靶标来减轻UVB诱导的角质形成细胞损伤[16]。let-7c是let-7基因家族中的一员,在细胞生长、增殖等方面具有重要作用。研究发现,let-7能直接调节细胞周期关键的原癌基因,阻断细胞G1/S期的转换过程,从而抑制肿瘤细胞增殖,具有抑癌基因样作用[17]。此外,研究证实,let-7可通过调控高迁移率族蛋白A2(HMGA2)而抑制多种肿瘤的EMT过程[18-20]。
本研究发现,TGF-β1可诱导经UVB照射的HaCaT细胞中miR-23a的表达上调,与相关研究结果一致[16]。对于let-7c蛋白,则表现为在未受照细胞及较低剂量UVB照射细胞中let-7c表达增加,而在较高剂量UVB照射细胞中,let-7c的表达明显受到抑制,提示TGF-β1可能通过调节miR-23a和let-7c的表达进而影响HaCaT细胞损伤的修复、CPD清除、抗凋亡甚至肿瘤细胞的产生等,但这种作用与受照剂量有关,TGF-β1对较高剂量UVB照射产生的损伤可能会有不同的作用和机制,有待进一步深入研究。
环氧合酶(cyclooxygenase,COX)是前列腺素(prostaglandins,PG)在合成过程中的重要限速酶。目前发现的亚型有3种:COX-1、COX-2和COX-3。COX-2是可在细胞因子、激素、致癌物质、生长因子、紫外线等多种诱导因子的刺激下快速表达的诱导型酶,正常细胞中不表达。研究发现,COX-2不仅广泛参与机体炎症等多种病理生理过程,而且参与多种肿瘤的发生和发展。COX-2在UV诱导的炎症反应和肿瘤发生过程中发挥重要作用[21],炎症过程通过释放各种炎性因子促进表皮过度增殖和增生,进而导致皮肤癌[10]。研究证实非甾体抗炎药和选择性COX-2的抑制剂可以降低皮肤癌的发生[22],目前COX-2已成为肿瘤预防与治疗的新的生物靶点。
本研究结果发现,TGF-β1预先作用于HaCaT细胞后,COX-2的表达水平明显增加,而对凋亡执行分子caspase-3的检测发现:对照组细胞经UVB照射后不同时点,活化的caspase-3亚基表达均显著增加,特别是照射后12 h开始,表达增强更为明显,与我们前期观察到的凋亡结果相符[23];而处理组细胞受照后,活化的caspase-3亚基自照后24 h开始明显减少,可能与TGF-β1诱导COX-2表达增加有关,有研究表明COX-2蛋白的过度表达可促进肿瘤细胞过度增殖,抑制caspase-3的表达[24],从而使细胞增殖和凋亡之间的平衡失调,促进肿瘤恶性行为的发生。
通过本研究结果可以发现,TGF-β可以调控多个基因/蛋白的表达,作为UVB辐射诱导miRNA表达的关键调控分子,其调节的miR-23a在一定UVB照射剂量范围内的高表达一方面可通过清除CPD保护受照细胞,增强HaCaT的细胞抗性;另一方面又因其抗凋亡作用而不利于细胞的损伤修复。TGF-β对let-7c的作用则可能导致let-7c的抑癌基因样作用减弱,有发生皮肤肿瘤的风险。TGF-β诱导COX-2在UVB辐射后的高表达可以增加受照皮肤的炎症反应和损伤细胞的抗凋亡作用,Allen Guanqun Li等甚至认为在皮肤癌发生的早期阶段,TGF-β1诱导的皮肤炎症可能超越了TGF-β1肿瘤抑制作用[13]。
TGF-β1对于UVB诱导的细胞辐射损伤的作用机制非常复杂,明确TGF-β调控的生物因子的作用及与其他信号通路之间的关系对于UVB诱导的皮肤疾病的预防与治疗十分重要。本研究针对的是在一定剂量范围UVB的单次短时照射及TGF-β1的影响,以后还需进一步模拟人体长期紫外暴露深入探讨紫外辐射损伤及致癌作用。

