水分胁迫对桢楠幼树光合生理特性的影响
郑鹏丽,黄晓蓉,费永俊,周明芹
(长江大学 楠木种质资源评价与创新中心,湖北 荆州 434025)
桢楠Phoebe zhennanS.Lee,别名雅楠,樟科楠属常绿大乔木。其木质坚硬耐腐,生长缓慢,寿命长,树形优美,是上等的用材树种和园林绿化树种[1],被称为四川阔叶树材之冠。由于野生资源破坏严重,致使自然界楠木大多散生,难见成林分布,陷入濒危状态,已被列为国家二级保护树种[2,3]。我国虽然很早就开始人工培育楠木属植物,但因缺乏对楠木属植物所需的环境因子的系统研究,不能做到适地适树。因此,研究水分胁迫对桢楠光合生理特性的影响,有利于揭示植物在逆境条件下对水分胁迫响应的方式和程度。
水分胁迫是指植物所处的环境中水分状态超出植物正常生长的生态幅,从而遭受到伤害的一种环境条件的统称,分为涝渍胁迫和干旱胁迫[4]。植物在水分胁迫的逆境条件下,不仅会在外观形态上表现出一系列的变化,而且也会在生理、生态特性方面进行响应,导致植物光合作用受抑,呼吸紊乱,代谢异常[5-8],直接影响植物的生长发育和生存。当前,学者针对桢楠的研究主要集中在野生种质资源分布[9]、形态研究[10]、繁育技术研究[11]以及优良家系选择[12]等方面,而水份胁迫等逆境对桢楠生长发育的影响报道较少。鉴于此,本研究以2年生桢楠幼树为研究对象,设置了4 个水分处理水平,记录其生长状况,测定其光合生理参数,旨在了解桢楠抗旱、耐水淹的能力,揭示干旱、涝渍胁迫与其光合生理特性的关系,为桢楠的引种栽培与园林应用栽培提供理论参考。
1 材料与方法
1.1 试验地概况
试验地位于湖北省荆州市长江大学西校区植物园内,为亚热带季风气候,年日照时数1 800~ 2 000 h,年平均气温15.9~16.6 ℃,年无霜期242~263 d,年平均降水量1 100~1 300 mm,四季分配很不均匀,其中4—10月份,荆州全区的降水量占全年总降水量的80%,≥10℃的积温占全年总积温的80%。
1.2 试验材料与设计
2013年10月17日选取生长强健,长势一致的2年生桢楠幼苗100 株植于塑料花盆(规格:21 cm×15 cm×18.5 cm)中,基质为河沙∶椰粉∶珍珠岩∶陶粒=3∶2∶2∶1(v/v),每盆一株。栽植后,用HH2 土壤水分速测仪监测土壤含水量,控制盆土含水量为田间持水量的80%左右。
2014年6月25日,开始对所有植株进行控水或淹水试验。采用单因素试验设计,设置4 个处理,分别为重度水淹胁迫,幼苗处于水涝状态(P1,双套盆法,水面始终高于盆土面4~5 cm)、轻度水淹胁迫,幼苗处于水渍状态(P2,水面始终位于盆土的1/2 处)、对照(P3,正常生长)、干旱胁迫,保证土壤自然干旱(P4),每处理25个重复共100盆。胁迫试验期间,P1 和P2 每隔3 d 换水一次,定期续水,保证其相应的水淹深度;P3 每天晚上18:00采用称重法,按要求进行控水补水。
1.3 指标测定及方法
1)生长状况。胁迫试验期间,定期观察并记录苗木形态变化,并于复水后第5 天,统计各处理桢楠幼苗苗木的存活株数。
2)生理指标。试验阶段于第0、15、30、45 d 和复水后第5 天采集各处理叶片测定生理指标,每个指标重复3 次。用硫代巴比妥酸法、考马斯亮蓝法、酸性茚三酮法分别测定丙二醛(MDA)、可溶性蛋白(SP)和脯氨酸(Pro)[16]的含量。超氧化物歧化酶(SOD)和过氧化物酶(POD)的活性分别采用氮蓝四唑法和愈创木酚显色法[13]测定。
3)光合参数。于试验第0、15、30、45 天和复水后第5 天早上9:00—11:30,利用Li—6400 型便携式光合仪设定光照强度为1 200 μmol(m2·s),CO2浓度为400 μmol/mol,温度为30 ℃,测定不同水分胁迫处理下桢楠叶片的净光合速率(Pn),胞间CO2浓度(Ci),蒸腾速率(Tr)和气孔导度(Gs)。每个处理随机选取5 株幼苗重复测定,每株选择幼苗中部的2~3 片健康的完全展开叶,每片叶的光合生理参数作3 次记录,取其平均值作为测定结果。
1.4 数据分析
本试验主要使用Excel 2007 软件和DPS 7.0 统计软件进行方差分析。
2 结果与分析
2.1 水分胁迫对桢楠幼苗生长的影响
水涝胁迫(P1)15 d 后,植株表现出生长不适,下部老叶发黄、下垂等现象,随着胁迫时间的延长,幼苗的生长受到抑制,死亡率逐渐增加,至胁迫结束后其存活率仅为56.4%。在水渍(P2)和自然干旱(P4)胁迫下,幼苗胁迫症状出现的时间比较晚,症状较轻,胁迫解除后,有所改善(表1),桢楠植株存活率均达100%。表明桢楠幼苗对土壤自然干旱和水渍产生的胁迫有较强的忍耐性,但在长时间的水淹下,涝害胁迫加剧,使其生长受影响,植株出现死亡现象。

表1 水分胁迫对桢楠幼苗生长的影响Table1 Effects of water stress on the growth of P.zhennan seedlings
2.2 水分胁迫对桢楠幼苗生理影响
2.2.1 水分胁迫对桢楠幼苗丙二醛含量的影响
水分胁迫对桢楠幼苗叶片中的MDA 含量产生了显著的影响(图1)。P1 和P2 处理中,MDA 含量均在45 d 达到峰值,分别比对照增加了62.08%、48.69%(P<0.05),复水后,MDA含量有所下降,但与第45 天无显著性差异,与第0 天差异著性。P4 处理MDA 含量表现为先上升后下降的趋势,胁迫第30 天达到峰值,比对照增加了65.96%,胁迫解除后,MDA 含量有所下降,与第45 天表现一定差异,与第0 天无显著性差异,说明干旱处理下桢楠幼树已基本恢复到正常生长的状态。胁迫第45 天,各处理桢楠幼树叶片内的平均MDA 含量从大到小排列依次为P1 >P2 >P4 >P3。

图1 叶片丙二醛含量Fig.1 MDA content of leaf
2.2.2 水分胁迫对桢楠幼苗SOD 含量的影响
由图2可知,随着水分胁迫时间的延长,SOD 活性在前15 d 显著上升,达到峰值,15 d 后呈下降趋势,但仍维持在较高的水平。P1、P2、P4 的SOD 活性在胁迫第15 天分别为141.10、118.64 和109.44 U·g-1·min-1,比第0天增加了130.74%、105.22%、82.98%,胁迫解除后,所有处理的SOD 活性呈现下降的趋势,P1、P2 与第0天差异显著,P4 与第0 天无显著性差异。
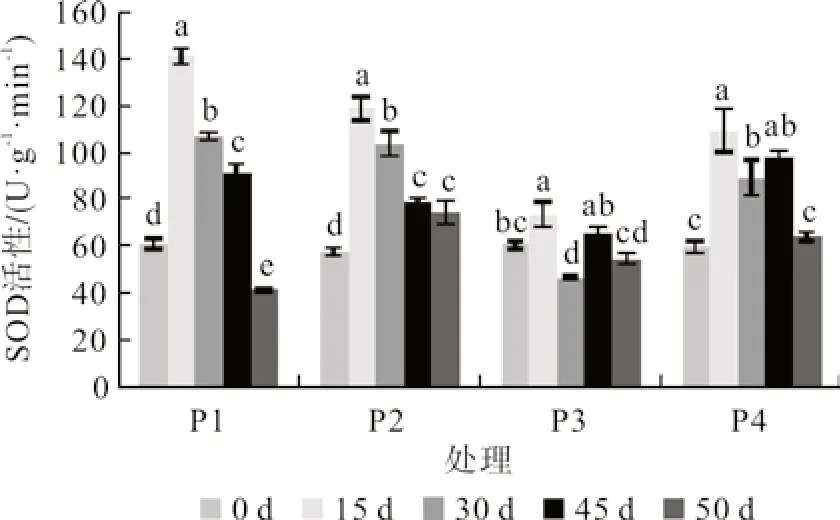
图2 桢楠叶片SOD 活性变化Fig.2 Changes of SOD activity in leaves of P.zhennan
2.2.3 水分胁迫对桢楠幼苗POD 含量的影响
干旱和水涝均会引起POD 活性显著增强。P1处理POD 活性在胁迫第15 天达到最大值,比对照增加了179.53%,与第0、30、45、50 天差异显著。P2 和P4 处理POD 活性的变化趋势均表现为先上升后下降,第30 天达到最大值,与第15 天存在显著差异,分别比对照增加了48.02%和44.49%(图3)。以胁迫第45 天来看,各处理间桢楠幼苗叶片POD 值在长时间内都能保持着较高的活性,其POD 活性强弱依次为P1 >P2 >P4 >P3,水渍和干旱差异不显著,说明两者对桢楠幼苗的影响程度相近。

图3 桢楠叶片POD 活性变化Fig.3 Changes of POD activity in leaves of P.zhennan
2.2.4 水分胁迫对桢楠幼苗SP 含量的影响
随着水分胁迫时间的延长,桢楠幼苗SP 含量在各处理间均表现为先上升后下降的变化趋势,在水分胁迫的第15 天达到最大值,与第0天存在显著性差异,分别比对照增加了55.88%、42.68%和26.28%;胁迫解除后,P1 处理下的SP含量继续上升,与第45 天无显著性差异,而其它处理SP 值呈下降趋势,接近对照水平(图4)。SP 值的先升后降说明胁迫前期水分胁迫能诱导幼苗合成蛋白,但长时间的胁迫会造成其体内的蛋白质降解。
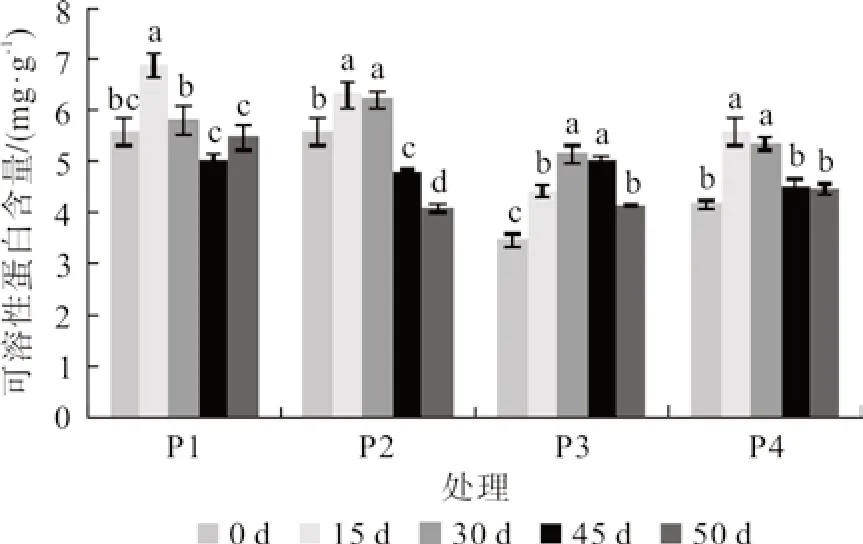
图4 叶片可溶性蛋白含量Fig.4 Content of soluble protein in leaf
2.2.5 水分胁迫对桢楠幼苗Pro 含量的影响
胁迫前期,各处理Pro 含量显著增加。P1 处理在胁迫第45 天,Pro 含量最高,为3.67 μg/g,比对照增加了183.63%,与第30 天差异显著。P2和P4 处理Pro 含量随着胁迫时间的延长,表现为先上升后下降的趋势。P2 处理第15 天Pro 含量最高,比对照增加了148.70%,与第0 天存在显著性差异。P4 处理中Pro 含量在胁迫处理的第30 天最高,比对照增加了52.47%(图5)。胁迫解除后,所有处理的Pro 含量均呈现不同程度的下降趋势,以胁迫处理的第45 天来看,楠木幼苗的Pro 含量从高到低依次为P1 >P4 >P2 >P3。
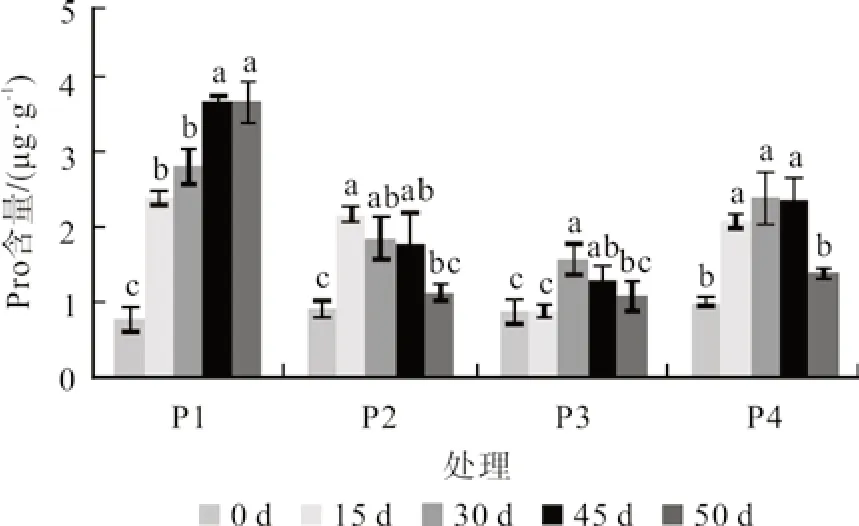
图5 叶片脯氨酸含量Fig.5 Proline content in leaf
2.3 水分胁迫对桢楠幼苗光合生理的影响
2.3.1 水分胁迫对桢楠幼苗净光合速率(Pn)的 影响
水分胁迫会导致各处理桢楠幼苗Pn值显著下降,复水后,显著上升(图6)。随着水分胁迫时间的延长,Pn值呈先下降后上升再下降的“S”型变化趋势。胁迫结束时,P1、P2、P4 的Pn值分别为0.15、3.10 和3.21 μmol·m-2·s-1,分别比第0 天降低了97.30%、42.16%、38.86%,差异性极显著。第45 天平均净光合速率由大到小依次为:P3 >P4 >P2 >P1,表明其在水淹条件下受到的伤害更大,植物体的光合作用受到完全抑制。
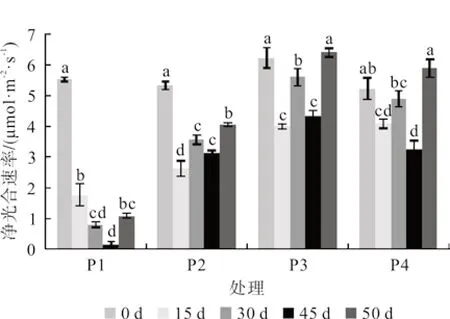
图6 水分胁迫对桢楠幼苗净光合速率的影响Fig.6 Effects of water stress on net photosynthetic rate of P.zhennan
2.3.2 水分胁迫对桢楠幼苗气孔导度(Gs)的影响
从图7可知,随着水分胁迫时间的延长,各处理的Gs值变化趋势与Pn值的变化趋势相似。P1 处理Gs值逐渐下降,胁迫第45 天时比对照降低了82.61%,且与第0 天存在显著性差异;胁迫解除后,Gs值持续下降,与第45 天无显著性差异。P2 至胁迫处理结束时,Gs值下降至 0.049 mol·m-2·s-1,比对照降低了38.22%,但与第0 天 差异性不显著。P4 处理Gs值在第30 天达 到 峰 值,为0.085 mol·m-2·s-1,与 第0 d 存 在显著性差异,在第45 天达到谷值,比对照降低了52.88%,复水后,Gs值上升,与第45 天存在显著性差异。在水涝和干旱胁迫中,各处理的平均Gs值由大到小依次为:P3 >P4 >P2 >P1。
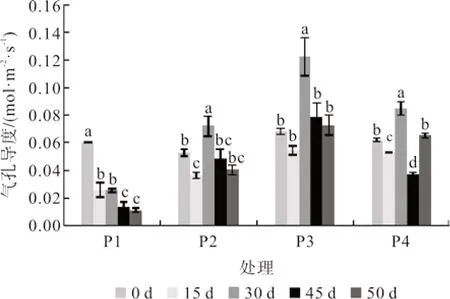
图7 水分胁迫对桢楠幼苗气孔导度的影响Fig.7 Effects of water stress on stomatal conductance of P.zhennan
2.3.3 水分胁迫对桢楠幼苗胞间CO2 浓度(Ci)的影响
随着水分胁迫时间的延长,桢楠幼苗Ci值表现为先上升后下降的变化趋势,胁迫解除后,Ci值下降,与第45 天均存在显著性差异。P1 处理在第45天Ci值达到峰值,比第0 天增加了77.89%。P2、P4 处理,Ci值均在试验的第30 天达到峰值,分别比第0 天增加了64.64%和42.59%,且存在显著性差异(图8)。水淹和干旱条件下,各处理CO2浓度的平均值由大到小依次为P1 >P3 >P2 >P4。

图8 水分胁迫对桢楠幼苗胞间CO2 浓度的影响Fig.8 Effects of water stress on intercellular CO2 concentration of P.zhennan
2.3.4 水分胁迫对桢楠幼苗蒸腾速率(Tr)的影响
由图9,随着水分胁迫加剧,P1 处理中的Tr值呈现逐渐下降的变化趋势,第45 天时最低蒸腾速率为0.288 mmol·m-2·s-1,比第0天降低了84.66%,胁迫解除后,Tr值有所下降,但与第45天无显著性差异。P2、P3、P4 处理的Tr 值大致表现为先下降后上升再下降的“S”型变化趋势。在P2 处理中,Tr值在第15 天达到谷值,比对照降低了38.97%,15 d 以后变化平缓,没有显著性差异;胁迫解除后,Tr值有所上升。P4 处理Tr值在前30 d 变化幅度不大,差异性不显著,到水分胁迫结束时,Tr值达到谷值,为0.966 mmol·m-2·s-1,比对照降低了33.31%。各处理的第50 d 平均蒸腾速率由大到小依次为:P3 >P4 >P2 >P1,表明水涝对桢楠幼苗的蒸腾速率产生了显著的影响。

图9 水分胁迫对桢楠幼苗蒸腾速率的影响Fig.9 Effects of water stress on transpiration rate of P.zhennan
3 结论与讨论
不同的植物在水分胁迫处理中表现出来的形态、生理代谢等特征变化情况不同,反映出各植物抗涝渍和干旱的能力也不尽相同[14]。研究表明,水涝加剧时,植物生长受抑,植株叶颜色变浅,边缘呈现坏死症状,如连香、枫杨[15];同理,干旱条件也会对植物生长产生抑制作用,但耐旱型植物能增强细胞渗透调节能力来应对干旱胁迫,如黄金香柳。本试验中,在水涝胁迫下桢楠植株存活率明显低于水渍和自然干旱胁迫,植株叶片发黄,叶下垂,说明长时间的水涝胁迫会致使桢楠生长缓慢,恶化其土壤中的供氧状态,从而影响植物的正常生长。
作为植物体细胞与外界环境之间进行能量和物质交换的界面,质膜在各种逆境胁迫下首当其冲受到影响,过量的O2-增生,大量地积累MDA等有害的过氧化产物,表现为膜脂过氧化,造成细胞膜系统的破损,加速了植物的衰老[16],甚至威胁到植物细胞的存活[17]。而植物体内存在的活性氧保护酶系统,包括SOD 和POD 等是活性氧的重要清除剂,对保持活性氧的平衡起到至关重要的作用[18]。本研究中,与对照相比,各处理MDA 含量均有所增加,以水涝胁迫最为显著,表明水涝对桢楠植株膜透性损伤较为严重。胁迫第15 天,MDA 含量升高较慢,此时SOD 和POD 酶活性高,它们之间协同作用抑制了MDA 产生;胁迫第30 天,SOD 和POD 酶活性开始下降,MDA含量迅速增加;胁迫后期及胁迫解除后桢楠幼苗逐渐形成了适应性,MDA 含量呈现下降趋势,这是桢楠适应逆境时MDA 与SOD 和POD 酶系统存在一定相关性的表现。
在水分胁迫下,植物依靠渗透势的降低和一定膨压力的维持来抵御不利环境带来的伤害,而Pro、SP[19]作为主要的渗透调节物质能提高细胞内原生质渗透压,维持原生质胶体的稳定[20,21]。本研究表明,桢楠在胁迫初期可以通过Pro 和SP 含量提高抗涝抗旱能力,随着胁迫加剧,Pro 升高,SP 含量下降。这是因为胁迫初期酶活性较高,加速了蛋白酶水解,胁迫后期RNA 的转录和翻译被抑制,蛋白质合成减少。水渍、干旱胁迫下,Pro含量均表现出较强恢复能力,表明桢楠幼苗具有一定的抗旱性和抗水渍能力。
植物在遭受水分胁迫时,生理变化为最显著的是光合作用[22]。本研究结果显示,由涝渍和干旱引起的水分胁迫会导致桢楠幼苗的光合作用和蒸腾作用降低,而Gs和Pn、Tr的变化趋势基本相同,有助于植物延迟脱水,说明桢楠幼苗能够在一定的水淹和干旱的条件下生存。这与洋白蜡[23]、藏川杨[24]等植物的研究结果一致。胁迫初期,光合色素减少或叶肉细胞光合活性下降致使桢楠幼苗的净光合速率和气孔导度均有大幅度下降,与此同时胞间CO2浓度却上升,细胞呼吸产生的CO2增加,且能够用于光合作用;胁迫中期,桢楠幼苗适应了涝渍和干旱,光合作用会有所提高,胞间CO2浓度和气孔导度增大;胁迫后期,在长时间的水淹状态下,桢楠叶片光合色素含量降低,光合器官遭到不同程度破坏,致使其利用光和CO2的能力降低,净光合速率、胞间CO2浓度和气孔导度持续下降,说明桢楠无法通过自身的调节抵御恶劣环境,到水淹45 d 后,幼苗几乎不再进行光合作用。胁迫解除后,均有所回升。这说明水淹和干旱条件下,桢楠幼苗存在气孔因素和非气孔因素降低了桢楠幼苗的净光合速率,一旦停止伤害后,其光合作用恢复。
综上,桢楠幼苗不耐长期水涝,水涝胁迫45 d 植株存活率明显降低,生长受阻,叶片大量累积SP、SOD、POD、Pro 来降低伤害,膜脂过氧化加重,MDA 含量显著增大,Pn、Ci、Tr含量降低。因此,在种植桢楠时切忌选择积水严重地方,须做好排涝措施以保障桢楠植株正常生长。
由于桢楠抗涝渍和抗旱能力包含许多复杂且相互关联的物质及能量的变化过程。本试验重点研究了桢楠幼苗光合生理生态指标对水分胁迫的响应,可能存在片面性。水分胁迫下的桢幼苗的叶片结构变化和植物体内内部调控机制有待进一步的研究探讨。

